Kleszczowate
| Ixodidae | |
| Dugès, 1834 | |
| Okres istnienia: kreda–dziś | |
 kleszcz jeżowy (Ixodes hexagonus) | |
| Systematyka | |
| Domena | |
|---|---|
| Królestwo | |
| Typ | |
| Podtyp | |
| Gromada | |
| Podgromada | |
| Nadrząd | |
| Rząd | |
| Podrząd | kleszcze właściwe |
| Rodzina | kleszczowate |
Kleszczowate (Ixodidae) – rodzina pajęczaków z podgromady roztoczy i rzędu kleszczy. Liczy ponad 700 opisanych gatunków. Takson kosmopolityczny. Przedstawiciele są obligatoryjnymi pasożytami zewnętrznymi kręgowców lądowych. Mają w cyklu życiowym trzy stadia rozwoje: larwę, nimfę i postać dorosłą oraz 1–3 żywicieli. Larwy mają trzy, a pozostałe stadia cztery pary odnóży. Samce mają grzbietową stronę idiosomy w całości, a samice i stadia młodociane w przedniej części przykrytą tarczką grzbietową. W zapisie kopalnym znane od kredy.
Pajęczaki te żerując mogą wywoływać różne choroby, jak również są przenosicielami innych organizmów chorobotwórczych. Wskutek tego mają duże znaczenie medyczne i weterynaryjne.
Opis


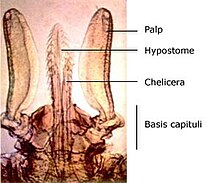
Kleszczowate mają ciało długości do 30 mm, złożone z gnatosomy i idiosomy, u osobników głodnych silnie spłaszczone grzbietobrzusznie, u najedzonych samic nawet kuliste. Gnatosoma (kapitulum) składa się z podstawy (basis capituli) i osadzonych na niej: nogogłaszczków, hypostomu i wsuwanych do pochowek szczękoczułków[1]. Hypostom ma skierowane w tył ząbki lub wcięcia[2][1], a szczękoczułki nożycowate szczypce[1]. Z kątów tylno-bocznych listewki grzbietowej gnatosomy wyrastać mogą cornua, a za panewkami nasad nogogłaszczków auriculae[2]. Nogogłaszczki u dorosłych są 4-członowe i mają zmysłowy organ głaszczkowy na członie ostatnim[2][1]. Na grzbietowej stronie części nasadowej gnatosomy występują u dorosłych samic pola porowate (areae porosae)[2]. Gnatosoma ulokowana jest w kamerostomie na przednim krańcu idiosomy, przy czym u najedzonych nimf, larw i samic zagięta jest na spodnią stronę[1].
Z wierzchu idiosomy leży tarczka grzbietowa, która u samców pokrywa cały jej grzbiet (conscutum), a u samic, nimf i larw pokrywa tylko przednią jego część (scutum), podczas gdy reszta pozostaje błoniasta (alloscutum). Kształt tarczy może być okrągły, owalny, sześciokątny lub sercowaty, mogą się na niej znajdować przednie wyrostki (scapulae) oraz różne bruzdy, wyniosłości czy żeberka. Na bokach lub brzegach tarczki grzbietowej znajdować się mogą oczy[2]. U obu płci niektórych rodzajów brzegi boczne idiosomy podzielone są bruzdkami tworząc festony. U osobników dorosłych i nimf z tyłu bioder czwartej pary leżą przecinkowate lub prawie owalne tarczki oddechowe, na których znajdują się przetchlinki[2]. Powszechnie występuje zawór analny (płytka z odbytem)[1]. U samców ponadto występować mogą inne tarczki brzuszne: analne, adanalne, subanalne i dodatkowe[3][1]. Istotne w diagnostyce mogą być także położone w okolicy odbytu bruzdy, tzw. anal grooves[3][2].
Odnóża są siedmioczłonowe. Nimfy i dorosłe mają 4 pary, a larwy 3 pary. Pierwsza para ma na stopach zmysłowe narządy Hallera[1]. Biodra często wyposażone są w 1 lub więcej ostróg, a u niektórych gatunków zakrywa je częściowo oskórek idiosomy, tworząc syncoxae[2].
Biologia i ekologia
Kleszczowate są kosmopolityczne i występują wszędzie, gdzie można znaleźć kręgowce lądowe, których są obligatoryjnymi pasożytami zewnętrznymi[2][1]. Kleszczowate są rodzielonopłciowe, ale mogą się też rozmnażać partenogenetycznie. Samica składa jaja poza ciałem gospodarza. Z jaj wylęgają się sześcionogie i pozbawione przetchlinek larwy. Po linieniu larwy zmieniają się w ośmionogie nimfy, które po kolejnym linieniu przechodzą w postać dorosłą. Nimfy różnią się od dorosłych nierozwiniętymi otworami płciowymi i brakiem pól porowatych u samic[2]. Większość kleszczowatych przechodzi wylinki poza ciałem gospodarza i ma w cyklu życiowym trzech żywicieli – po jednym na każde stadium. Niektóre gatunki mają 2 żywicieli (larwa i nimfa żerują na tym samym gospodarzu) lub tylko jednego[1].
Większość kleszczowatych prowadzi pozagniazdowy tryb życia – wszystkie ich stadia rozwojowe występują w środowisku, gdzie poszukują żywicieli. Inne, jak kleszcz łąkowy, przechodzą wylinkę między larwą a nimfą w gnieździe gospodarza i tylko larwy i dorosłe występują w środowisku. Z kolei u gatunków jednożywicielowych larwa po znalezieniu gospodarza przechodzi cały cykl rozwojowy na jego ciele[1].
Systematyka i ewolucja
Takson ten wprowadził w 1834 Antoine Louis Dugès[4]. Przedstawiciele kleszczowatych znani są w zapisie kopalnym od kredy, a najstarsze okazy pochodzą z birmańskiego bursztynu. Jako ich żywicieli w mezozoiku rozważa się żółwie, gady ssakokształtne i opierzone dinozaury[5]. Kleszczowate łączone bywają z Nuttalliellidae w grupę kleszczy właściwych[1], ale wyniki molekularne każą je raczej łączyć z obrzeżkowatymi, a Nuttalliellidae uznawać za klad bazalny[6].
Dotychczas opisano ponad 700 gatunków kleszczowatych (702 z 14 rodzajów według listy z 2010). Należą tu rodzaje[7]:
Część autorów umieszcza rodzaje Amblyomma, Dermacentor, Haemaphysalis, Hyalomma, Rhipicephalus w osobnej rodzinie Amblyommidae[1][8].
Znaczenie medyczne i weterynaryjne
Żerowanie kleszczowatych wywołuje u żywicieli liczne negatywne skutki zdrowotne. U zwierząt hodowlanych stres wywołany przez licznie żerujące kleszcze skutkować może anoreksją i anemią, co przyczynia się do obniżenia tempa wzrostu i produkcji mleka[9][10]. Uszkodzenia fizyczne skóry powodują m.in. obniżenie jej wartości handlowej, a w przypadku większych ran narażają żywiciela na muszyce[11][12]. Substancje zawarte w ślinie kleszczowatych wywoływać mogą u ludzi, psów, bydła i owiec paraliż kleszczowy[13][14][15][16] – choroba ta może prowadzić do śmierci, a wśród ludzi szczególnie podatne są na nią dzieci do 2. roku życia[1].
Kleszczowate są przenosicielami wielu chorobotwórczych drobnoustrojów. Do przenoszonych przez nie wirusów należą np.: flawiwirusy wywołujące kleszczowe zapalenie mózgu[17], CTFV wywołujący gorączkę kleszczową Kolorado[18], NSDV wywołujący chorobę Nairobi u owiec oraz CCHFV wywołujący u wielu ssaków, w tym ludzi, gorączkę krwotoczną krymsko-kongijską[13][19]. Do przenoszonych bakterii należą m.in.: krętki Borrelia wywołujące boreliozę[20], riketsje wywołujące gorączkę plamistą, Francisella tularensis wywołująca tularemię[21], Anaplasma wywołujące anaplazmozy (np. A. phagocytophilum wywołuje anaplazmozę granulocytarną ludzi[1]) oraz Ehrlichia ruminantium wywołująca wodosierdzie bydła, owiec i kóz[22][23]. Wśród przenoszonych przez kleszczowate pierwotniaków znajdują się: Babesia wywołująca babeszjozy[1], Theileria annulata wywołująca tropikalną teileriozę bydła[24], Theileria parva wywołująca gorączkę wschodniego wybrzeża Afryki[25] oraz Cytauxzoon felis wywołujący u kotów cytaukszoonozę[26].
Profilaktyka
U ludzi w terenie zasiedlonym przez kleszczowate zaleca się stosowanie odpowiedniego ubioru (długie spodnie zaciśnięte na wysokich butach, podkolanówkach lub skarpetkach oraz górne nakrycie włożone w spodnie i zaciśnięte paskiem) oraz częste przeglądanie odzieży, celem usunięcia wędrujących po niej osobników. 2-3 razy dziennie należy również dokonać przeglądu ciała. Stosować można również repelenty odstraszające lub zapobiegające przyczepianiu się ich do ciała[1]. W ochronie psów stosuje się miejscowe opryski preparatami typu spot-on oraz impregnowane akarycydami obroże[27].
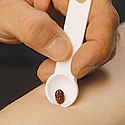
W przypadku znalezienia kleszcza już przyczepionego należy go jak najszybciej usunąć, gdyż np. ryzyko zarażenia boreliozą zarówno u ludzi jak i innych zwierząt wzrasta znacząco po 1 i jeszcze silniej po 2 dobie od przyczepienia[28]. Najefektywniejszą, zalecaną m.in. przez WHO, metodą jest uchwycenie pajęczaka jak najbliżej skóry i ciągnięcie go prosto wzdłuż osi wkłucia[29][28]. W przypadku postaci dorosłych najlepiej sprawdza się w tym celu gięta, tępa pęseta lub kleszcze o średnich rozmiarów wierzchołkach[28]. W przypadku osobników młodocianych (nimf) w jednym z badań lepiej sprawdziły się produkty do usuwania kleszczy wyposażone w V-kształtny rowek – przy ich użyciu ryzyko pozostawienia w ciele aparatu gębowego tych stadiów było mniejsze. Według wyników jednego z badań holenderskich obracanie kleszcza przy wyciąganiu zwiększa ryzyko pozostawienia aparatu gębowego w skórze, stąd nie jest ono zalecane[29]. Nie należy używać do usuwania rozgrzanych zapałek ani żadnych substancji chemicznych – wszystkie testowane w badaniach okazały się nieefektywne[29][28], a ponadto mogą one wywoływać u pajęczaka ślinienie i wymioty, teoretycznie zwiększając ryzyko zakażenia[28]. Inne metody mechaniczne (np. lasso) zostały niedostatecznie przebadane (stan w 2006)[29]. Po usunięciu kleszcza należy upewnić się, że usunięty został również aparat gębowy i przemyć miejsce antyseptykiem[28].
Zobacz też
Przypisy
- ↑ a b c d e f g h i j k l m n o p q Krzysztof Siuda: Kohorta: kleszcze – Ixodida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 153–173. ISBN 978-83-01-16568-0.
- ↑ a b c d e f g h i j Josef Nosek, Wolf Sixl. Central-European Ticks (Ixodoidea) – Key for determination. „Mitt. Abt. Zool. Landesmus. Joanneum”. 1 (2), s. 61–92, 1972.
- ↑ a b Glossary of morphological features. [w:] Bristol University tick ID [on-line]. University of Bristol. [dostęp 2016-01-12]. [zarchiwizowane z tego adresu (19-06-2015)].
- ↑ Frédéric Beaulieu i inni, Superorder Parasitiformes Reuter, 1909, „Zootaxa”, 3148, 2011 (Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness), s. 165–191 [dostęp 2017-02-28].
- ↑ Jason A. Dunlop, Dmitry A. Apanaskevich, Jens Lehmann, René Hoffmann, Florian Fusseis, Moritz Ehlke, Stefan Zachow and Xianghui Xiao. Microtomography of the Baltic amber tick Ixodes succineus reveals affinities with the modern Asian disease vector Ixodes ovatus. „BMC Evolutionary Biology”. 16, 2016. DOI: 10.1186/s12862-016-0777-y.
- ↑ Gu, X. B.; et al. The complete mitochondrial genome of the scab mite Psoroptes cuniculi (Arthropoda: Arachnida) provides insights into Acari phylogeny. „Parasit Vectors”. 7 (340), 2014. DOI: 10.1186/1756-3305-7-340.
- ↑ Alberto A. Guglielmone; Richard G. Robbing; Dmitry A. Apanaskevich; Trevor N. Petney; Agustín Estrada-Peña; Ivan G. Horak; Renfu Shao; Stephen C. Barker. The Argasidae, Ixodidae and Nuttalliellidae (Acari: Ixodida) of the world: a list of valid species names. „Zootaxa”. 2528, s. 1–28, 2010.
- ↑ Amblyommidae. [w:] Fauna Europaea [on-line]. [dostęp 2017-03-01].
- ↑ N.N. Jonsson. The productivity effects of cattle tick (Boophilus microplus) infestation on cattle, with particular reference to Bos indicus cattle and their crosses. „Veterinary Parasitology”. 137 (1–2), s. 1–10, 2006. DOI: 10.1016/j.vetpar.2006.01.010.
- ↑ R.G. Pegram. Studies on the economics of ticks in Zambia. „Experimental and Applied Acarology”. 12, s. 9–26, 1991. DOI: 10.1007/BF01204396.
- ↑ F. Stachurski. Invasion of West African cattle by the tick Amblyomma variegatum. „Medical and Veterinary Entomology”. 14 (4), s. 391–399, 2000. DOI: 10.1046/j.1365-2915.2000.00246.x.
- ↑ J.L. Lancaster: Arthropods in livestock and poultry production. Chichester: Ellis Horwood Ltd., s. 1986. ISBN 0-85312-790-5.
- ↑ a b D.E. Sonenshine: Biology of ticks. New York: Oxford University Press, 2014. ISBN 978-0-19-974405-3.
- ↑ R. Gothe, K. Kunze, H. Hoogstraal. The mechanisms of pathogenicity in the tick paralyses. „Journal of Medical Entomology”. 16 (5), s. 357–369, 1979.
- ↑ B.F. Stone. Tick/host interactions for Ixodes holocyclus: role, effects, biosynthesis and nature of its allergenic oral secretions. „Experimental and Applied Acarology”. 7, s. 59–69, 1989. DOI: 10.1007/BF01200453.
- ↑ S.C. Barker. Ticks of Australia. The species that infest domestic animals and humans. „Zootaxa”. 3816, s. 1–144, 2014.
- ↑ Lars Lindquist, Olli Vapalahti. Seminar Tick-borne encephalitis. „The Lancet”. 371 (9627), s. 1861–1871, 2008. DOI: 10.1016/S0140-6736(08)60800-4.
- ↑ Richard Klasco. Colorado tick fever. „Medical Clinics of North America”. 86 (2), s. 435–440, 2002. DOI: 10.1016/S0025-7125(03)00096-8.
- ↑ J.A.W. Coetzer: Infectious diseases of livestock with special reference to southern Africa. Cape Town: Oxford University Press, 1994. ISBN 0-19-570506-8.
- ↑ H. Hoogstraal. Ticks and spirochetes. „Acta Tropica”. 36 (2), s. 133–136, 1979.
- ↑ K.J. Ryan, C.G. Ray: Sherris Medical Microbiology. McGraw Hill., 2004, s. 488–490. ISBN 0-8385-8529-9.
- ↑ D. Martinez. Epidemiological studies of dermatophilosis in the Caribbean. „Revue d’Elevage et de Medicine Veterinaire des Pays Tropicaux”. 10, s. 323–327, 1993.
- ↑ G. Uilenberg. Heartwater in the Caribbean. „Preventive Veterinary Medicine”. 2, s. 255–267, 1984. DOI: 10.1016/0167-5877(84)90068-0.
- ↑ R.A.I. Norval: The epidemiology of theileriosis in Africa. London: Academic Press, 1992. ISBN 0-12-521740-4.
- ↑ F. Katzer. Genotypic diversity: a survival strategy for the apicomplexan parasite Theileria parva. „Veterinary Parasitology”. 2–4167 (2–4), s. 236–243, 2010. DOI: 10.1016/j.vetpar.2009.09.025.
- ↑ Łukasz Adaszek, Romana Wernicka-Furmaga, Jacek Kutrzuba, Stanisław Winiarczyk. Cytaukszoonoza – potencjalne zagrożenie dla kotów w Europie. „Życie Weterynaryjne”. 87 (4), 2012.
- ↑ Wojciech Zygner. Borelioza u psów. „Życie Weterynaryjne”. 83 (10), s. 816-817, 2008.
- ↑ a b c d e f Matthew Gammons, Gohar Salam. Tick Removal. „American Family Physican”. 66 (4), 2002.
- ↑ a b c d D.W. Pitches. Removal of ticks: a review of the literature. „Eurosurveillance”. 11 (33), 2006.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Daktaridudu, Licencja: CC BY-SA 4.0
Dermacentor andersoni ixodid ticks, female and male, dorsal.
Autor: Commonsource, Licencja: CC BY 3.0
Removal of the tick. By compressing the mouthparts (and not the body of the tick) one avoids squeezing more allergens, toxins and infectious micro-organisms into the host.
Autor:
- File:Ixodesfemale.gif: Sonenshine, DE: Biology of Ticks, 2 volumes: Oxford University Press, New York, Oxford, 1991
- derivate work: Carabus
Morfologia samicy Ixodes
Autor: Richard Bartz, Munich Makro Freak, Licencja: CC BY-SA 2.5
Description: Makroshot of the upper Torso and Head of a Tick
Autor:
André Karwath aka Aka
, Licencja: CC BY-SA 2.5This image shows an only 0.16 inch (4 mm) small, living tick of the species Ixodes hexagonus from the top.
Autor: Daktaridudu, Licencja: CC BY-SA 4.0
Hyalomma rufipes ixodid ticks, female and male, dorsal.
Autor: Daktaridudu, Licencja: CC BY-SA 4.0
Amblyomma variegatum ixodid ticks, female and male, dorsal.
Autor: Alan R Walker, Licencja: CC BY-SA 3.0
The hard tick, family Ixodidae, Rhipicephalus appendiculatus. Adult females and males feeding at favorite site of the ear pinna.