Korozja chemiczna
Korozja chemiczna − korozja spowodowana działaniem substancji chemicznych w warunkach, w których reakcjom chemicznym nie towarzyszy przepływ prądu (elektrony są wymieniane bezpośrednio między utlenianym metalem i utleniaczem)[a]. Korozją chemiczną jest np. powierzchniowe utlenianie metali w wysokich temperaturach (w suchych gazach) zawierających utleniacze, np. tlen, dwutlenek siarki, fluorowce, siarka.
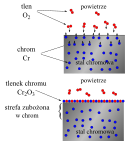
Korozja gazowa w powietrzu prowadzi do powstawania warstewek tlenków. W hutnictwie żelaza jest przyczyną powstawania zgorzeliny, łatwo odpadającej od metalu np. po ochłodzeniu walcowanej stali, piaskowaniu lub młotkowaniu. Powstawanie szczelnych warstewek tlenków na powierzchni stopów aluminium lub stali nierdzewnej (chromowo-niklowej) jest przyczyną ich chemicznej odporności (pasywacja). Warstwy tlenków spełniają funkcje ochronne, jeżeli dobrze przylegają do powierzchni metalu (korzystna jest koherencja sieci krystalicznej metalu i tlenku) oraz hamują procesy transportu tlenu i jonów metalu do strefy reakcji (mała prędkość dyfuzji przez pęknięcia, zdefektowane przestrzenie między ziarnami lub przez sieć krystaliczną)[1][2][3][4][5].
Mechanizm i kinetyka korozji gazowej
Korozja chemiczna zachodzi pod wpływem takich czynników agresywnych, jak np. tlen, dwutlenek siarki, fluorowce, chlorowodór, siarkowodór, siarka, wodór. Produktami większości reakcji są ciała stałe. Są to najczęściej tlenki, powstające pod działaniem powietrza w wysokich temperaturach – w warunkach, gdy nie ma możliwości kondensacji pary wodnej na powierzchni korodującego metalu. Niekiedy poza substancjami stałymi powstają produkty ciekłe i gazowe (np. korozja chlorowa[6]).
W bardzo rzadkich przypadkach reakcja nie przebiega na powierzchni metalu, lecz wewnątrz jego struktury. Charakterystycznym przykładem jest korozja wodorowa (choroba wodorowa stali lub miedzi, wodorowe zużycie metalu). Zachodzi ona z udziałem wodoru atomowego, którego mały promień atomowy umożliwia niemal swobodną dyfuzję przez sieć krystaliczną metalu. Rekombinacja cząsteczek dwuatomowych w zdefektowanych fragmentach struktury, gdzie zostają uwięzione (pułapkowanie), powoduje wzrost naprężeń w otoczeniu. Dodatkowo zachodzą reakcje chemiczne, np. powierzchniowe odwęglanie ziaren stopów żelaza z węglem z utworzeniem metanu uwięzionego w „pułapkach” sieciowych, lub powstawanie pary wodnej wewnątrz struktury stopów miedzi, zawierających tlenki miedzi[7].
| Metal | Tlenek | Vp/Vm |
| K | K2O | 0,21 |
| Na | Na2O | 0,57 |
| Ca | CaO | 0,64 |
| Mg | MgO | 0,79 |
| Al. | Al2O3 | 1,21 |
| Zn | ZnO | 1,57 |
| Ni | NiO | 1,6 |
| Cr | Cr2O3 | 2,03 |
| Fe | Fe2O3 | 2,16 |


Przykłady: łuszcząca się zgorzeliny na stali i warstwy tlenków wolframu (dół)[3]
Utlenianie powierzchni metali w wysokich temperaturach rozpoczynają procesy:
- — adsorpcja tlenu na powierzchni
- — jonizacja zaadsorbowanych cząsteczek
- — reakcja z atomami metalu, znajdującymi się na jego powierzchni
- — jonizacja zaadsorbowanych cząsteczek
Pierwsza warstewka produktu utleniania (nalot, grubość < 100 nm) może być całkowicie szczelna lub porowata, od czego zależy możliwość jej narastania, szybkość tego procesu oraz struktura warstwy.
Warstwy szczelne mogą powstawać, jeżeli objętość molowa tlenku nie jest mniejsza od objętości molowej metalu (reguły Pillinga i Bedwortha). Zgodnie z tą zasadą metale I i II grupy nie mogą być chronione warstwą tlenku (utleniają się gwałtownie), a tlenki powstające na aluminium, chromie lub niklu tworzą warstwy ochronne. Nie mają tych właściwości np. tlenki żelaza, ponieważ wspomniany warunek jest niezbędny, ale nie jest wystarczający. Reagenty reakcji utleniania mogą przenikać przez szczelne warstwy tlenków, np. wzdłuż zdefektowanych granic ich ziaren lub przez sieć krystaliczną. W przypadkach zbyt dużych objętości molowych tlenków lub dużych różnic między rozszerzalnością cieplną tlenku i metalu, warstwy tlenków pękają, co otwiera drogi szybkiego transportu tlenu do powierzchni metalu[2][3].
Utlenianie metali grup I i II jest opisywana liniowym równaniem kinetycznym:
- Δx / Δτ = kL · cO2
gdzie: Δx/Δτ – szybkość przyrostu grubości warstwy (x) w czasie (τ), kL – stała szybkości procesu, cO2 – stężenie tlenu nad korodującą powierzchnią (często uznawane za stałe)
Jeżeli na metalu powstaje zwarta warstwa tlenku, o szybkości korozji zwykle decyduje szybkość dyfuzji tlenu od granicy tlenek–powietrze do granicy tlenek–metal. Przyjmując, że stężenie tlenu w powietrzu jest niezmienne, a przy granicy tlenek–metal jest równe zeru, otrzymuje się, w oparciu o prawo Ficka, paraboliczne równanie kinetyczne:
- Δx / Δτ = D · (cO2 / x)

gdzie: (cO2 / x) – gradient stężenia tlenu w warstwie tlenku (zmienna w czasie siła napędowa dyfuzji – tym mniejsza, im grubsza jest warstwa), D – współczynnik dyfuzji tlenu przez warstwę
Wymienione równania są uproszczone, np. przez założenie, że struktura warstwy nie zmienia się w czasie jej narastania. W warunkach rzeczywistych zmieniają się nie tylko morfologiczne cechy struktury, ale również chemiczny skład tlenków. W przypadku utleniania wolframu warstwa przylegająca do metalu jest zbudowana z WO2 lub W18O49 i zwarta, a porowatą warstwę zewnętrzną stanowi trójtlenek WO3. Na powierzchni żelaza powstaje zgorzelina wielofazowa, zawierająca kolejno (od warstwy wewnętrznej) tlenki: FeO (wustyt lub wüstyt), Fe3O4 (magnetyt) i Fe2O3 (hematyt)[3].
Elementy termodynamiki korozji gazowej

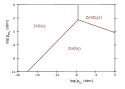
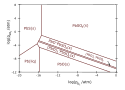
Liczbę i kolejność warstw produktów korozji chemicznej, powstających na powierzchni metali, przewiduje się w oparciu o wykresy równowag fazowych. Są one sporządzane z uwzględnieniem równowag wszystkich reakcji chemicznych, zachodzących w układzie, np. zachodzących w stałej temperaturze reakcji z tlenem i dwutlenkiem siarki, równocześnie atakującymi powierzchnię metalu. Wykresy są stosowane m.in. w czasie projektowania procesów obróbki cieplno-chemicznej stali i innych stopów, prowadzonych w celu wytworzenia szczelnych powłok ochronnych, np. ustalanie zakresu, w którym powinny być utrzymywane prężności gazów aktywnych.
Problemy dotyczące równowag oraz kinetyki przemian fazowych i reakcji chemicznych w układach metal–środowisko są szczególnie złożone w przypadkach, gdy:
- środowisko korozji zawiera wiele substancji agresywnych, atakujących metal lub wcześniej wytworzone warstwy ochronne (np. korozja metali w atmosferze zawierającej tlen, dwutlenek siarki, tlenki azotu, dwutlenek węgla)
- stop jest wieloskładnikowy i wielofazowy, np. stal zawierająca liczne dodatki stopowe, poddawana umocnieniu
Uwagi
- ↑ W warunkach atmosferycznych, w obecności wilgoci, zachodzi przede wszystkim korozja elektrochemiczna – reakcjom chemicznym towarzyszy przepływ prądu między obszarami utleniania metalu i redukcji utleniacza (depolaryzatora), czyli anodami i katodami ogniw korozyjnych
Przypisy
- ↑ Barbara Surowska: Wybrane zagadnienia z korozji i ochrony przed korozją. Lublin: Politechnika Lubelska, 2002, s. 1-143.
- ↑ a b c Korozja gazowa. W: Skrypt ZUT: Korozja i ochrona przed korozją [on-line]. www.zmio.zut.edu.pl. [dostęp 2015-07-11].
- ↑ a b c d e Korozja gazowa. W: Skrypt UMCS [on-line]. www.ztch.umcs.lublin.pl. [dostęp 2016-05-15].
- ↑ Encyklopedia techniki; Metalurgia. T. Metalurgia. Katowice: Wydawnictwo "Śląsk", 1978, s. 256. (pol.)
- ↑ Encyklopedia techniki, Materiałoznawstwo. T. Materiałoznawstwo. Warszawa: PWN, 1969, s. 392. (pol.)
- ↑ Hadj Latreche; Sébastien Doublet; Michael Schütze. Development of Corrosion Assessment Diagrams for High Temperature Chlorine Corrosion. „Oxidation of Metals”. 72, s. 1-30, 31-65, 2009. Springer. DOI: 10.1007/s11085-009-9147-0 (ang.).
- ↑ Encyklopedia techniki; Metalurgia, op. cit.. s. 268.
- ↑ Zakład Metaloznawstwa i Odlewnictwa: Struktury stopów żelaza o specjalnych właściwościach. W: Skrypt ZUT: Tworzywa metaliczne [on-line]. www.zmio.zut.edu.pl/. [dostęp 2015-07-11]. [zarchiwizowane z tego adresu (2012-10-30)].
Bibliografia
- Bob Cottis: The electronic journal for all aspects of corrosion (ang.). W: The Journal of Corrosion Science and Engineering [on-line]. Linki do artykułów dot. różnych aspektów korozji. [dostęp 2011-05-12].
Media użyte na tej stronie
Powstawanie warstewek tlenków na metalach. Kinetyka wzrostu grubości warstw
Autor: Metallos, Licencja: CC BY-SA 3.0
Predominance diagram (or Kellogg diagram) for zinc in equilibrium with SO2–O2 gases at 950°C.
Korozja gazowa stali; udział tlenków żelaza w warstwie
Łuszcząca się warstwa tlenków Me na wyrobach walcowanych na gorąco (zendra, zgorzelina)
Autor:
- Mecanisme_passivation_inox.svg: Cdang
- derivative work: Joanna Kośmider (talk)
Mechanism of passivation of stainless steel: the chromium atoms in the steel react with the dioxygen of the air to form a protective chromia layer.
Autor: Metallos, Licencja: CC BY-SA 3.0
Lead predominance diagram (Kellogg diagram) at 600°C (typical PbS roasting temperature).