Korozja elektrochemiczna
Stal (anoda) utlenia się wokół bardziej szlachetnych śrub (katody, redukcja tlenu). Rdza powstaje w wyniku wtórnej reakcji chemicznej między jonami powstającymi na obu elektrodach.
Korozja elektrochemiczna – korozja metali spowodowana procesami elektrochemicznymi, zachodząca wskutek występowania różnych potencjałów na powierzchni korodującego obiektu znajdującego się w środowisku elektrolitu. W takiej sytuacji powstają ogniwa korozyjne, w których fragmenty powierzchni metalu o niższym potencjale są anodami – zachodzi na nich utlenianie metalu, przechodzącego do roztworu. Na katodach ogniw korozyjnych zachodzą reakcje redukcji tak zwanego depolaryzatora, którym jest często cząsteczkowy tlen z powietrza (depolaryzacja tlenowa) lub jony wodorowe (depolaryzacja wodorowa) ulegające redukcji do wodoru gazowego[1][2][3][4].
Różnice między potencjałami poszczególnych fragmentów korodującej powierzchni mogą być związane z różnicami[4][5][6]:
- chemicznego składu stopu
- zagęszczenia i rodzaju defektów sieci krystalicznej stopu (naprężenia wewnętrzne)
- wielkości i rodzaju naprężeń spowodowanych zewnętrznym obciążeniem
- chemicznego składu elektrolitu (np. stopnia napowietrzenia i zasolenia wody gruntowej).
W wielu przypadkach kierunek przemian i ich szybkość zależą również od innych czynników, na przykład oddziaływań fizycznych (m.in. zewnętrznego pola elektrycznego, promieniowania) lub mikrobiologicznych.
Mechanizm korozji elektrochemicznej
Mechanizm korozji elektrochemicznej wynika z podstawowych cech dwóch kontaktujących się ośrodków[1][2][3][4][5][6]:
- korodujący metal jest przewodnikiem elektryczności, przy czym jego powierzchnia nigdy nie jest całkowicie jednorodna (zróżnicowane potencjały standardowe)
- woda, w której metal koroduje (w tym wilgoć gleby i gazów, np. w powietrza atmosferycznego), nie jest chemicznie czysta – jest roztworem różnych elektrolitów, czyli wykazuje przewodnictwo jonowe, zależne od stężenia i ruchliwości zawartych w nim jonów
W przypadku wystąpienia różnicy między potencjałami fragmentów powierzchni metalu powstają ogniwa galwaniczne, nazywane ogniwami korozyjnymi, w których:
- na fragmentach o niższym potencjale (anodach) zachodzą reakcje utleniania, na przykład:
- Me = Me+ + e−
- na fragmentach o wyższym potencjale (katodach) zachodzą reakcje redukcji, na przykład:
- H2O + ½ O2 + 2e– = 2 OH−
- 2 H+ + 2 e− = H2↑
- H2O + ½ O2 + 2e– = 2 OH−
- elektrony przemieszczają się od anody w kierunku katody przez korodujący metal (przewodnictwo elektronowe, I rodzaju)
- aniony przenoszą odpowiednią ilość ujemnych ładunków w kierunku od katody do anody (przewodnictwo jonowe, elektrolityczne, II rodzaju)
- produkty reakcji elektrodowych mogą wchodzić w roztworze w reakcje wtórne, w których mogą powstawać nierozpuszczalne związki, tworzące warstwy o różnej szczelności, jak rdza na stopach żelaza lub patyna (śniedź) na stopach miedzi, na przykład:
- Fe + ½ O2 = FeO
- Fe2+ + 2 H2O = Fe(OH)2 + 2 H+
- Fe3+ + 3 OH− = Fe(OH)3
- Fe(OH)3 = FeO(OH) + H2O
- 2 FeO(OH) = Fe2O3 + H2O
- 4 Cu2+ + SO42− + 6 OH− = CuSO4*3 Cu(OH)2
- Fe2+ + 2 H2O = Fe(OH)2 + 2 H+
- Fe + ½ O2 = FeO
Elementy termodynamiki
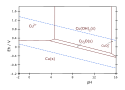
Stopień potencjalnej odporności metalu na korozję elektrochemiczną wyraża jego pozycja w szeregu napięciowym, zależna od potencjału standardowego, E0. Więcej informacji uzyskuje się, obliczając wartości równowagowych potencjałów elektrod ogniw korozyjnych, w oparciu o równanie Nernsta. W uproszczeniu (dla T = 298 K i roztworów rozcieńczonych) jest ono stosowane w formie[7][8][9][10]:
gdzie: E0 – potencjał standardowy, z – liczba elektronów wymienianych w reakcji połówkowej, [red] i [ox] – stężenia molowe formy zredukowanej i utlenionej.
Środowisko umowne: brak innych anionów poza OH−, stężenie jonów 0,001 mol/kg wody,
temperatura 25 °C[11]
W ogniwach korozyjnych zachodzą lub mogą zachodzić różne reakcje utleniania i redukcji każdego z metali. Każdą z tych reakcji charakteryzuje inne równanie Nernsta lub odpowiedni wykres: prostoliniowa zależność potencjału od logarytmu ze stężenia określonego jonu (np. powstającego w reakcji utleniania).
Na wykresach Pourbaix, dotyczących elektrochemicznej korozji różnych czystych metali, są przedstawiane zależności potencjałów wszystkich prawdopodobnych reakcji utleniania tych metali od pH roztworu. Najbardziej popularne są wykresy, na których proste odpowiadają stężeniom 10−6 gramoatomu/litr. To stężenie uznano za umowną granicę między obszarem korozji metalu i obszarem odporności (termodynamicznie trwały metal) lub potencjalnej pasywacji (termodynamicznie trwały stały produkt reakcji)[8][11][12].
Możliwość zajścia odpowiedniej reakcji anodowej w ogniwie korozyjnym zależy od położenia odpowiadającej jej linii względem dwóch prostych, które opisują katodowe reakcje redukcji jonów wodorowych (depolaryzacja wodorowa) i cząsteczkowego tlenu (depolaryzacja tlenowa). Są one często oznaczane literowymi symbolami, odpowiednio: a i b. Pomiędzy nimi mieści się tak zwany obszar termodynamicznej trwałości wody, powyżej obszar trwałości cząsteczkowego tlenu, a poniżej obszar trwałości gazowego wodoru[8][11].
Elementy kinetyki
Wykresy Pourbaix dotyczą stanu równowagi termodynamicznej (ogniwo otwarte) – pozwalają przewidywać kierunki reakcji, które mogą zachodzić na powierzchni korodującego metalu. W rzeczywistych warunkach ogniwa pracują w obwodzie zamkniętym. Im większa jest szybkość reakcji i odpowiadająca jej gęstość prądu na elektrodzie (natężenie odniesione do jednostko powierzchni), tym bardziej jej potencjał różni się od równowagowego. Przyczyną różnic jest ograniczona szybkość reakcji chemicznych, przemian fazowych oraz dyfuzji, dzięki której substraty docierają do strefy reakcji, a produkty ją opuszczają[7][8][9][10].
Wskutek polaryzacji elektrod występuje nadnapięcie, nazywane aktywacyjnym, stężeniowym lub oporowym (zależnie od wywołującej je przyczyny). Wpływ polaryzacji elektrod na szybkość korozji jest przedstawiany na wykresach Evansa. Wykresy sporządza się w układzie współrzędnych: potencjał elektrody – logarytm z gęstości prądu (log i)[13].
Wykres Evansa. Szybkość korozji kontrolowana przez rezystancję
Wykres Evansa. Szybkość korozji cynku – wpływ dodatków stopowych na nadnapięcie H2[13]
Wykres Evansa. Szybkość korozji żelaza – wpływ stężenia tlenu na katodach[13]
Nachylenie krzywych potencjału elektrody jest tym większe, im silniejsza jest jej polaryzacja. Linie potencjałów obu elektrod (katody i anody) przecinają się w punkcie, którego położenie wskazuje „potencjał mieszany” korodującego metalu (po wyrównaniu wartości prądu anodowego i katodowego) oraz maksymalną wartość natężenia prądu, która jest miarą szybkości korozji (niemierzalny „prąd korozyjny”). Obie linie nie osiągają punktu przecięcia w tych przypadkach, gdy o szybkości korozji decyduje rezystancja elementów obwodu elektrycznego (np. oporność styku między katodą i anodą)[5][6][4][13].
W przypadkach korozji w naturalnym środowisku największą rolę odgrywa polaryzacja stężeniowa elektrody tlenowej. W bezpośrednim otoczeniu konstrukcji (znajdującej się, na przykład, w wodzie morskiej lub w gruncie) tlen jest szybko wyczerpywany w katodowej reakcji depolaryzacji tlenowej, po czym o szybkości korozji decyduje szybkość dyfuzji tlenu z atmosfery do powierzchni metalu (potencjał anody jest niemal nieistotny).
Makroogniwa korozyjne
Korozja kontaktowa (stykowa)

Makroogniwami korozyjnymi mogą być wieloelementowe urządzenia przemysłowe, na przykład instalacja wodna, most, instalacja okrętowa, sieć trakcyjna. Jeżeli poszczególne stykające się elementy instalacji znajdującej się w wodzie, wilgotnym gruncie lub powietrzu są wykonane z różnych metali, powstaje ogniwo stykowe (kontaktowe). Zniszczeniu ulega metal mniej szlachetny, zwłaszcza w pobliżu styku. Charakterystycznymi makroogniwami korozyjnymi są miejsca połączeń elementów konstrukcji wytworzonych z jednakowych materiałów (np. połączenia odcinków rurociągów lub blach poszycia statków). Spawy, nity lub śruby wykonane ze stopu mniej szlachetnego niż łączone elementy mogą stać się anodami ogniwa. Ze względu na ich małą powierzchnię w stosunku do powierzchni katod natężenie prądu anodowego jest wtedy bardzo duże, co oznacza dużą szybkość rozpuszczania złącza. Jeżeli są wykonane z metalu bardziej szlachetnego, stają się katodami ogniwa. Łączone blachy są anodami o dużej powierzchni, dzięki czemu szybkość rozpuszczania się metalu, odniesiona do jednostki powierzchni, jest niewielka[5][6][4].
Ogniwa różnego napowietrzenia

Różnice potencjałów na powierzchni metali umieszczonych w wodzie lub w gruncie są często skutkiem różnego napowietrzenia. Na fragmentach powierzchni, do których dostęp tlenu jest swobodny, zachodzą reakcje depolaryzacji tlenowej (katodowe), a korozyjne ubytki metalu pojawiają się w ich pobliżu (anodowe utlenianie metalu). Charakterystycznym przykładem jest korozja linii wodnej statków morskich, wzdłuż której przebiega granica między strefą zbryzgiwania natlenioną wodą morską, a strefą całkowicie zanurzoną w wodzie (miejsca anodowe). Analogicznie jest tłumaczone zjawisko korozji rurociągów, które są ułożone w gruncie o różnej wilgotności i porowatości. Odcinki rurociągu znajdujące się w piaszczystych warstwach profilu glebowego są napowietrzone lepiej od tych, które są w warstwie gliniastej[4][5][6].
Zróżnicowanie dostępu tlenu do różnych fragmentów powierzchni metalu odgrywa również rolę w procesie korozji podpowierzchniowej. Są to procesy zróżnicowane i złożone. W przypadku gdy powierzchniowa warstwa metalu jest uszlachetniona w stosunku do warstw głębszych (np. powłoka galwaniczna, pokrycie malarskie), jej uszkodzenia odsłaniają fragmenty, które stają się małymi anodami kontaktującymi się z dużymi katodowymi powierzchniami powłoki. Może to być przyczyną powstawania głębokich wżerów lub rozprzestrzeniania się korozji pod warstwą powłoki. Utrudniony dostęp tlenu do wnętrza wżeru lub szczeliny pod powłoką zwiększa szybkość anodowego utleniania metalu w tych miejscach. Czynnikiem dodatkowym jest powstawanie stałych produktów reakcji wtórnych u wylotu ze szczelin i wżerów (dodatkowe ograniczenie dostępu tlenu).
Korozja naprężeniowa
W skali pracującej konstrukcji rolę odgrywa rozkład naprężeń:
- roboczych, związanych z charakterem obciążeń (miejsca wystąpienia naprężeń rozciągających są mniej szlachetne – stają się anodami ogniw korozyjnych)
- pozostałych po procesach wytwarzania wyrobów (np. obróbka plastyczna, tj. cięcie, gięcie, tłoczenie, walcowanie).
Korozja linii wodnej statków – skutki różnic napowietrzenia wody
Specyficzne rodzaje makroogniw korozyjnych

Powstawanie ogniw korozyjnych w naturalnym środowisku jest procesem złożonym, w którym ważną rolę odgrywają specyficzne czynniki biologiczne i fizyczne.
Zjawiskiem dobrze zbadanym jest korozja zachodząca w warunkach beztlenowych z udziałem bakterii redukujących siarczany (BRS). Jest to jedna z głównych przyczyn niszczenia kadłubów statków, platform wiertniczych, rurociągów podziemnych, instalacji hydrotechnicznych[14][15].
BRS odgrywają ważną rolę w biogeochemicznym obiegu siarki. Są odpowiedzialne za czarną barwę i dużą zawartość siarkowodoru w warstwie dennej Morza Czarnego. Metabolizują ponad 50% organicznego detrytusu. Są wykorzystywane do usuwania czarnego nalotu siarczanów z powierzchni z prehistorycznych naskalnych malowideł. Rozważa się możliwości ich wykorzystywania w procesach likwidacji odpadów wprowadzanych do środowiska. Udział BRS w procesach korozji jest dokładnie zbadany. W obecności siarczanów BRS wytwarzają jony siarczkowe (S2−). W ich reakcji z jonami Fe2+, powstającymi w reakcjach anodowego utleniania stali, powstaje siarczek żelaza(II)[14][15]. Nie dochodzi do zahamowania korozji wskutek polaryzacji stężeniowej.
Do przyspieszenia korozji metali w środowisku naturalnym przyczyniają się również inne mikroorganizmy oraz inne organizmy edafonu, zmieniające na przykład przepuszczalność gruntu dla powietrza i wody lub powodujące lokalne zakwaszenie.
Przykładem korozji zachodzącej pod wpływem czynników fizycznych jest korozja elektrolityczna, zachodząca w gruncie, w którym występują prądy błądzące (np. korozja rurociągów ciepłowniczych układanych pod trakcją elektryczną). Prądy błądzące mogą mieć również pochodzenie naturalne. Mogą też być spowodowane działaniem systemów aktywnej katodowej ochrony przed korozją sąsiednich instalacji podziemnych[16].
Wśród innych rodzajów korozji elektrochemicznej, której przebieg jest uzależniony od czynników fizycznych, jest wymieniana na przykład[1]:
- korozja cierna – współdziałanie środowiska korozyjnego i tarcia
- korozja zmęczeniowa – współdziałanie korozji elektrochemicznej i naprężeń szybkozmiennych
- korozja kawitacyjna – współdziałanie środowiska korozyjnego i sił kawitacji.

Mikroogniwa korozyjne
Mikroogniwa korozyjne powstają wskutek występowania różnic chemicznego składu faz w wielofazowych stopach metali oraz zróżnicowania naprężeń w skali mikroskopowej (pomiędzy ziarnami tworzącymi strukturę metalu oraz w ramach ziaren).
Struktura stopów jest kształtowana w procesach obróbki cieplnej i plastycznej. Zabiegi są prowadzone w celu zwiększenia wytrzymałości (zmniejszenia plastyczności, wmocnienia). Ich istotą jest otrzymywanie struktur drobnoziarnistych, w których występują liczne defekty sieci krystalicznej. Powoduje to zwykle zmniejszenie odporności na korozję elektrochemiczną.
Miejscem kumulacji defektów sieci i związanych z nimi naprężeń są granice ziaren, które mają w związku z tym niższe potencjały standardowe od wnętrza ziaren. Jest to przyczyną groźnej korozji międzykrystalicznej, która pojawia się bez ostrzegawczych objawów (warstwa rdzy, spadek masy).
W stopach wielofazowych katodami i anodami mikroogniw korozyjnych są ziarna faz o różnym składzie chemicznym, typie sieci i liczbie defektów. W przypadku stopów żelaza z węglem (stal, staliwo, żeliwo) mogą to być na przykład ziarna austenitu, ferrytu, cementytu (Fe3C), martenzytu.
W czasie chłodzenia austenitu zawierającego mniej niż 0,77% C w jego strukturze powstają początkowo stosunkowo duże ziarna ferrytu (primer A), które w temperaturze eutektoidalnej przemiany perlitycznej otaczają się drobnoziarnistą mieszaniną ferrytu i cementytu (Fe3C). Przemiana, zachodząca w czasie chłodzenia austenitu zawierającego więcej niż 0,77% węgla, zaczyna się od powstawania stosunkowo dużych ziaren cementytu (primer B), które następnie otaczają się perlitem.
Struktury obu uzyskiwanych stopów (stali pod– i nadeutektoidalnej) różnią się rozmieszczeniem i wielkością ziaren węgliku, które są potencjalnymi katodami mikroogniw korozyjnych. Te opisane, jak i inne otrzymywane w różnych przemianach fazowych, stopy wielofazowe ulegają korozji selektywnej, polegającej na wymywaniu mniej szlachetnych składników struktury.
Jeżeli przed osiągnięciem temperatury przemiany eutektycznej stopu A+B krystalizują roztwory stałe B w A i A w B [symbole A(B) i B(A)], zróżnicowanie chemicznego składu faz może wystąpić już w ramach pojedynczych ziaren. Wnętrze ziarna roztworu stałego, np. A(B), które krystalizowało w wyższej temperaturze, zawiera więcej B niż warstwy zewnętrzne, kolejno dobudowywane w czasie chłodzenia (zgodnie z wykresem równowagi). Stężenie nie wyrównuje się ze względu na małą szybkość dyfuzji w fazie stałej. Analogicznie wnętrze ziaren B(A) w stopach nadeutektycznych jest bogatsze w składnik A. W efekcie w polu przekroju ziarna obu rodzajów stopów mogą występować strefy o różnym składzie i naprężeniach wewnętrznych, a więc o różnym potencjale standardowym.
Zróżnicowanie potencjałów elektrycznych w skali mikroskopowej jest powodowane również kumulowaniem się naprężeń spowodowanych obciążeniem zewnętrznym (korozja naprężeniowa) lub powstawaniem defektów sieci pod wpływem promieniowania (korozja radiacyjna lub jądrowa – korozyjne oddziaływanie produktów radiolizy lub oddziaływanie strumieni neutronów w reaktorach jądrowych).
Ochrona metali przed korozją elektrochemiczną
Zmniejszanie strat spowodowanych elektrochemiczną korozją metali polega na zmniejszaniu prawdopodobieństwa powstawania ogniw korozyjnych (w skali makro- i mikroskopowej) oraz na stosowaniu:
- powłok ochronnych (metalicznych i niemetalicznych)
- metod ochrony galwanicznej lub elektrolitycznej (katodowej i anodowej)
- inhibitorów korozji.
Przypisy
- ↑ a b c Encyklopedia techniki; Metalurgia. Katowice: Wydawnictwo „Śląsk”, s. 255–261, seria: 1978.
- ↑ a b Leksykon naukowo-techniczny z suplementem. T. A-O. Warszawa: WNT, 1989, s. 392–393. ISBN 83-204-0969-1.
- ↑ a b Encyklopedia techniki, Materiałoznawstwo. Warszawa: Państwowe Wydawnictwo Naukowe, 1969, s. 269–271.
- ↑ a b c d e f Barbara Surowska: Wybrane zagadnienia z korozji i ochrony przed korozją. Lublin: Politechnika Lubelska, 2002, s. 1–143.
- ↑ a b c d e I.J. Klinow: Korozja i tworzywa konstrukcyjne. Warszawa: Wydawnictwo Naukowo-Techniczne, 1963.
- ↑ a b c d e G. G. Wranglen: Podstawy korozji i ochrony metali. Warszawa: Wydawnictwo Naukowo-Techniczne, 1969.
- ↑ a b Gustaw Kortüm: Elektrochemia. Warszawa: Państwowe Wydawnictwo Naukowe, 1970.
- ↑ a b c d Marcel Pourbaix: Wykłady z korozji elektrochemicznej. Warszawa: Państwowe Wydawnictwo Naukowe, 1978.
- ↑ a b Antoni Basiński, Adam Bielański, Kazimierz Gumiński, i inni: Chemie fizyczna. Wyd. Wyd. 3. Warszawa: Państwowe Wydawnictwo Naukowe, 1966, s. 756–816. (pol.)
- ↑ a b Stanisław Bursa: Chemia fizyczna. Wyd. 2. Warszawa: Państwowe Wydawnictwo Naukowe, 1979, s. 734–787. ISBN 83-01-00152-6. (pol.)
- ↑ a b c Corrosion Thermodynamics: Potential-pH-diagram: iron. www.corrosion-doctors.org. [dostęp 2011-04-29].
- ↑ a b Corrosion Thermodynamics; Potential-pH-diagram: aluminum (ang.). www.corrosion-doctors.org. [dostęp 2011-04-29].
- ↑ a b c d Bogusław Mazurkiewicz: Chemia fizyczna; ćwiczenie IV: Korozja i pasywacja metali. W: skrypt AGH [on-line]. [dostęp 2017-03-08]. [zarchiwizowane z tego adresu (2011-03-02)].
- ↑ a b Joanna Szczerba, Zofia Dzierżewicz. Implikacje kliniczne związane z obecnością bakterii redukujących siarczany (BRS). „Postępy mikrobiologii”. 47 (2), s. 97–110, 2008 (pol.).
- ↑ a b Dinh H.T., Kuever J., Mussmann M., Hassel A.W., Stratmann M., Widdel F. Iron corrosion by novel anaerobic microorganisms. „Nature”. 427, s. 829–832, 2004 (ang.).
- ↑ Marek Żebrowski, Józef Dąbrowski. Ochrona rurociągów ciepłowniczych przed korozją elektrolityczną powodowaną oddziaływaniem prądów błądzących. „Ciepłownictwo”, s. 31–34, 2010. www.informacjainstal.com.pl (pol.).
Bibliografia
- Bob Cottis: The electronic journal for all aspects of corrosion (ang.). W: The Journal of Corrosion Science and Engineering [on-line]. Linki do artykułów dot. różnych aspektów korozji. [dostęp 2011-05-12].
Media użyte na tej stronie
Opis
A bronze coin (5 Shu, 五銖) of the en:Han Dynasty (China) - circa 1st century BCE. The most mass circulated coin in Han China.
From the private collection of Randy BenzieAutor: Avenue, Licencja: CC BY-SA 3.0
Corroding iron machinery at the White Island sulphur mine, abandoned after a lahar killed all the workers in 1914.
I drew it with Medusa
Korozja linii wodnej
Autor: Antkyr, Licencja: CC-BY-SA-3.0
Intergranular corrosion attack in austenitic cold rolled stainless steel sheet
Gefügeschliffbild einer eutektikumsnahen Legierung mit „Primär-A“-Kristallen
Autor: Metallos, Licencja: CC BY-SA 4.0
Pourbaix diagram for copper in uncomplexed media (anions not other than OH- considered). Ion concentration 0.001 m (mol/kg water). Temperature 25°C.
(c) D3j4vu z angielskiej Wikipedii, CC BY-SA 3.0
Galvanic corrosion due to differing anodic index between the bolts and the plate
BRISBANE, Australia (July 3, 2007) - Sailors from amphibious command ship USS Blue Ridge (LCC 19) help restore the side of 62-year-old ship HMAS Diamantina at the Queensland Maritime Museum's dry dock during a community relations project. U.S. Navy photo by Mass Communication Specialist 2nd Class David Hewitt (RELEASED)
Autor:
- Galvanska_vrsta-morska_voda.png: Cl Cu111
- derivative work: Joanna Kośmider (talk)
Galvanic series of selected metals in marine environment
Podstawy korozji elektrochemicznej_2
Autor: Sillyputtyenemies, Licencja: CC BY-SA 3.0
A patch of rusted metal, showing through cracked and flaking paint; a metal wall, near railway tracks.
Nadnapięcie; Wykres Evansa (1)
Autor:
- Corrosion_galvanique_principe.svg: Cdang
- derivative work: Joanna Kośmider (talk)
Principle of galvanic corrosion: * anode (less noble metal): dissolution of metal, reaction with water, acidification; * cathode (noblest metal): reaction of water and dissolved dioxygen, alcalinisation; * migration of ions due to the difference of electric potential, accumulation of anions around the anode.
Nadnapięcie; Krzywe Evansa (zasada)
Nadnapięcie; Krzywe Evansa (zasada 2)
Korozja żelaza z udziałem bakterii beztlenowych BRS
Primery A i B w mieszaninie eutektycznej
Korozja elektrolityczna - schemat
Gefügeschliffbild einer eutektikumsnahen Legierung mit „Primär-B“-Kristallen
Nadnapięcie; Wykres Evansa (2)
Autor: Metallos, Licencja: CC BY-SA 3.0
Pourbaix diagram of iron in uncomplexed media (anions other than OH- not considered). Ion concentration 0.001 m (mol/kg water). Temperature 25°C.
Eglinton stables, Ornate lamp, Irvine, Scotland.
Autor: Metallos, Licencja: CC BY-SA 3.0
Pourbaix diagram for gold in simple non-complexing aqueous solutions (anions other than OH- not considered). Ion concentration 0.001 m (mol/kg water). Temperature 25°C.