Korozja metali




Korozja metali (łac. corrosio – zżeranie) – procesy stopniowego niszczenia (korozji) struktury metalu w wyniku jego chemicznych reakcji ze składnikami otoczenia lub procesów elektrochemicznych. W wielu przypadkach kierunek przemian i ich szybkość zależą również od czynników fizycznych (np. naprężenia w elementach obciążonej konstrukcji, zewnętrzne pole elektryczne, promieniowanie) lub mikrobiologicznych[1][2][3][4][5][6].
Podstawy fizykochemiczne
Teoretyczny opis procesu korozji opiera się na podstawach termodynamicznych i kinetycznych. Z punktu widzenia termodynamiki chemicznej korozja metali jest nieuchronnym procesem samorzutnym. W naturalnym środowisku termodynamicznie trwałe są tylko nieliczne metale szlachetne, np. platyna, złoto – występują w stanie niezwiązanym, jako samorodki (pierwiastki rodzime). Pozostałe metale–pierwiastki, stosowane od wieków jako metaliczne materiały konstrukcyjne, są uzyskiwane przez wydobycie rud i przetwarzanie w procesach metalurgicznych, z dużym nakładem energii. W czasie tych procesów układ termodynamiczny metal–otoczenie oddala się od stanu równowagi (obniżenie entropii, wzrost potencjałów termodynamicznych).
Wśród przemian, jakim ulegają metale powracające do stanu równowagi z otoczeniem, wyodrębnia się dwie podstawowe grupy:
Są to zwykle procesy wieloetapowe. Szybkość korozji jest zależna od szybkości najwolniejszego z etapów, np. od szybkości dyfuzji tlenu przez zwartą warstwę tlenków, powstających na powierzchni metalu w czasie korozji gazowej.
Korozja elektrochemiczna
Procesy korozji elektrochemicznej są najbardziej powszechne. Zachodzą w wodzie słodkiej i morskiej, w innych wodnych roztworach elektrolitów, w powietrzu atmosferycznym lub w gruncie (np. w glebie). Istotą procesu jest powstawanie ogniw korozyjnych, w których elektrodami są fragmenty powierzchni korodującego obiektu, o różnych potencjałach standardowych, a obwód elektryczny zamyka ciecz wykazująca przewodnictwo jonowe (warstewka, krople na powierzchni albo ciecz, w której konstrukcja jest zanurzona). W przypadku stali na anodach takich ogniw zachodzi utlenianie żelaza i dodatków stopowych do jonów (kationów), przechodzących do roztworu. Na katodach redukuje się depolaryzator. W naturalnym środowisku jest nim najczęściej rozpuszczony w wodzie tlen, który ulega redukcji do jonów wodorotlenkowych. Rdza (tlenki i wodorotlenki żelaza i innych metali), najczęściej obserwowany objaw korozji metali, jest produktem wtórnych chemicznych reakcji między jonami – produktami reakcji pierwotnych na elektrodach, które są od siebie oddalone[7].
Korozja chemiczna
Procesy korozji chemicznej zachodzą w specyficznym środowisku nie przewodzącym prądu elektrycznego:
- suche gazy, warunki wykluczające możliwość kondensacji par na powierzchni metalu
- ciecze nie przewodzące prądu elektrycznego (dielektryki, np. tłuszcze)
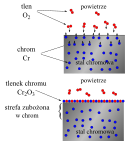
Utlenianie korodującego metalu zachodzi w czasie bezpośredniego kontaktu z cząsteczkami utleniacza (reakcja chemiczna). W przypadku oddziaływania tlenu powietrza na powierzchnię stali w wysokiej temperaturze tworzy się zgorzelina – warstwa produktów reakcji utleniania. Warstwy tlenków żelaza, powstających na gorących powierzchniach stali niskostopowych w walcowniach i w kuźniach, są zwykle luźno związane z metalem. Samoistnie odpadają po ochłodzeniu wyrobu, albo są usuwane metodami mechanicznymi (np. ciągnienie i przeginanie drutów, piaskowanie lub śrutowanie blach). Wolniej narastające warstwy tlenków mogą być bardzo mocno związane z powierzchnią metalu. W przypadku stali zawierających takie dodatki stopowe jak np. Cr, Cu, Zn, warstwy tlenków są bardzo zwarte. Jeżeli sieci krystaliczne tlenków nie tworzą roztworów stałych z tlenem i składnikami stopu, to kontakt tych reagentów zostaje zablokowany już po wytworzeniu bardzo cienkiej warstewki (zahamowanie reakcji, pasywacja). Jeżeli przynajmniej jeden z reagentów jest rozpuszczalny w sieci tlenku, korozja zachodzi z szybkością malejącą wraz ze wzrostem grubości warstewki (spada szybkość dyfuzji, która decyduje o szybkości całego procesu)[9][10].
Umowna skala odporności na korozję
W oparciu o zasady termodynamiki chemicznej przyjmuje się, zgodnie z kryterium zdefiniowanym przez Pourbaix[7], że metal jest odporny na korozję, jeżeli jest w stanie równowagi termodynamicznej z roztworem o aktywności jonów Mz+ ≥ 10−6 gramojonów/litr.
W praktyce są stosowane skale umowne, takie jak skala dziesięciostopniowa przedstawiona w tabeli[1]. Klasyfikacja dotyczy wyłącznie korozji równomiernej (ogólnej).
| Stopień odporności | Grupa odporności | Szybkość korozji [mm/rok] |
| 1 | I. Całkowicie odporna | poniżej 0,001 |
| 2 3 | II. Bardzo odporne | 0,001–0,005 0,005–0,01 |
| 4 5 | III. Odporne | 0,01–0,05 0,05–0,1 |
| 6 7 | IV. Mniej odporne | 0,1–0,5 0,5–1,0 |
| 8 9 | V. Mało odporne | 1,0–5,0 5,0–10 |
| 10 | VI. Nieodporne | powyżej 10 |
Przypisy
- ↑ a b Encyklopedia techniki. Metalurgia. Katowice: Wydawnictwo „Śląsk”, s. 255–261, seria: 1978.
- ↑ Encyklopedia techniki. Chemia. Warszawa: Wydawnictwa Naukowo-Techniczne, 1993, s. 361–365, 488. ISBN 83-204-1312-5.
- ↑ Leksykon naukowo-techniczny z suplementem. T. A-O. Warszawa: WNT, 1989, s. 392–393. ISBN 83-204-0969-1.
- ↑ Encyklopedia techniki, Materiałoznawstwo. Warszawa: Państwowe Wydawnictwo Naukowe, 1969, s. 269–271.
- ↑ Barbara Surowska: Wybrane zagadnienia z korozji i ochrony przed korozją. Lublin: Politechnika Lubelska, 2002, s. 1–143.
- ↑ G. G. Wranglen: Podstawy korozji i ochrony metali. Warszawa: Wydawnictwa Naukowo-Techniczne, 1969.
- ↑ a b c Marcel Pourbaix: Wykłady z korozji elektrochemicznej. Warszawa: Państwowe Wydawnictwo Naukowe, 1978.
- ↑ Gustaw Kortüm: Elektrochemia. Warszawa: Państwowe Wydawnictwo Naukowe, 1970.
- ↑ a b ćwiczenie: Korozja gazowa. [w:] Skrypt ZUT: Korozja i ochrona przed korozją [on-line]. www.zmio.zut.edu.pl. [dostęp 2015-07-11]. [zarchiwizowane z tego adresu (2012-10-30)].
- ↑ a b Ćwiczenie: Korozja gazowa. [w:] Skrypt UCS [on-line]. www.ztch.umcs.lublin.pl. [dostęp 2011-04-20].
Media użyte na tej stronie
Autor:
- Corrosion_galvanique_principe.svg: Cdang
- derivative work: Joanna Kośmider (talk)
Principle of galvanic corrosion: * anode (less noble metal): dissolution of metal, reaction with water, acidification; * cathode (noblest metal): reaction of water and dissolved dioxygen, alcalinisation; * migration of ions due to the difference of electric potential, accumulation of anions around the anode.
Autor:
- Mecanisme_passivation_inox.svg: Cdang
- derivative work: Joanna Kośmider (talk)
Mechanism of passivation of stainless steel: the chromium atoms in the steel react with the dioxygen of the air to form a protective chromia layer.
Autor: User:Ytrottier, cropped by user:XcepticZP, rotated by user:Michał Sobkowski, Licencja: CC-BY-SA-3.0
Partial weld around a pipe joint with clear heat affected zone