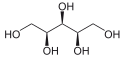
Ksylitol
| |||||||||||||||||||||||||||
 kryształy ksylitolu | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny | C5H12O5 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 152,15 g/mol | ||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
Ksylitol[a], zwycz. cukier brzozowy, E967 – organiczny związek chemiczny, pięciowęglowy alkohol polihydroksylowy o słodkim smaku (cukrol), zredukowana pochodna ksylozy.
Stosowany w przemyśle spożywczym do słodzenia jako zamiennik cukru (słodzik), głównie gum do żucia i cukierków ze względu na brak działania próchnicotwórczego. Zalecany również dla diabetyków, ponieważ jest metabolizowany z niewielkim udziałem insuliny. Ma wielokrotnie niższy indeks glikemiczny (IG:8) niż glukoza (IG:100) czy sacharoza (IG:70). FDA uznało ksylitol za substancję, która nie wywołuje próchnicy[4]. W roku 1996 JEFCA (organ doradczy WHO i FAO) nie określiło górnej granicy spożycia (ADI – dopuszczalna dzienna dawka) i jednocześnie stwierdziło, że wcześniejsze niekorzystne wyniki badań na zwierzętach przeprowadzone w latach 70. XX w. nie mają zastosowania dla ludzi[4]. Ksylitol wytwarza się naturalnie w organizmie człowieka w ilości ok. 15 g dziennie w procesach trawienia. Jego spożycie może sprzyjać likwidacji płytki nazębnej[5], jak również np. pomagać w leczeniu zakażenia jamy ustnej drożdżakowcami z rodzaju Candida (w przeciwieństwie do cukrów takich jak sacharoza, glukoza czy galaktoza)[6].
Natomiast u psów ksylitol może powodować poważne uszkodzenie wątroby, a nawet śmierć. Spożycie ksylitolu w ilości powyżej 100 mg/kg masy ciała wywołuje u psa wydzielanie dużych ilości insuliny, prowadząc w konsekwencji do znacznego obniżenia poziomu cukru we krwi (hipoglikemii)[7].
Otrzymywanie
Proces otrzymywania ksylitolu przeprowadza się w reaktorach pod ciśnieniem wodoru 6–10 MPa, z użyciem katalizatorów. Katalizator otrzymuje się przez stopienie niklu z glinem z dodatkiem innych promotorów. Ochłodzony i rozbity stop ładuje się do autoklawu, a następnie katalizator zadaje się wodnym roztworem NaOH. Wodorotlenek sodu rozpuszcza glin, uwalniając nikiel w aktywnej formie (Nikiel Raneya). W reaktorze β-D-ksylopiranoza zostaje uwodorniona do ksylitolu. Taki hydrolizat oczyszcza się węglanem i po odsączeniu roztworu ksylitolu usuwa się kationy i aniony przez dodatkową obróbkę odpowiednimi jonami. Ksylitowy roztwór zagęszcza się w wyparce próżniowej do 75% suchej substancji i poddaje krystalizacji[8].
Uwagi
Przypisy
- ↑ a b c CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 3-550, ISBN 978-1-4987-5429-3 (ang.).
- ↑ a b c d Xylitol, karta charakterystyki produktu Sigma-Aldrich, Merck KGaA, 26 lutego 2021, numer katalogowy: X3375 [dostęp 2022-06-09]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c Xylitol, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2022-07-24] (ang.).
- ↑ a b Xylitol, Calorie Control Council [zarchiwizowane z adresu 2010-12-06] (ang.).
- ↑ D-Xylitol, [w:] Human Metabolome Database [online], Genome Canada, HMDB02917 (ang.).
- ↑ Khaled H. Abu-Elteen, The influence of dietary carbohydrates on in vitro adherence of four Candida species to human buccal epithelial cells, „Microbial Ecology in Health and Disease”, 17 (3), 2005, s. 156–162, DOI: 10.3402/mehd.v17i3.7787 (ang.).
- ↑ Eric K. Dunayer, Sharon M. Gwaltney-Brant, Acute hepatic failure and coagulopathy associated with xylitol ingestion in eight dogs, „Journal of the American Veterinary Medical Association”, 229 (7), 2006, s. 1113–1117, DOI: 10.2460/javma.229.7.1113 (ang.).
- ↑ Zygmunt Kin, Hemicelulozy. Chemia i wykorzystanie, 1980.
Media użyte na tej stronie
Xylitol, structural formula
Autor: Anders Østergaard Madsen, Denmark, Licencja: CC-BY-SA-3.0
Xylitol crystals, sometimes used in chewing gum. Photo taken using a microscope.