Kwas akrylowy
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C3H4O2 | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | CH 2=CHCOOH | ||||||||||||||||||||||||||||||||||||||
| Masa molowa | 72,06 g/mol | ||||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwna ciecz o nieprzyjemnym, gryzącym zapachu[1] | ||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||
| Numer CAS | 79-10-7 | ||||||||||||||||||||||||||||||||||||||
| PubChem | 6581 | ||||||||||||||||||||||||||||||||||||||
| DrugBank | DB02579 | ||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||
| Podobne związki | alkohol allilowy, kwas krotonowy, kwas cynamonowy, akroleina, akrylamid | ||||||||||||||||||||||||||||||||||||||
| Pochodne | akrylany (np. akrylan metylu) | ||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||
Kwas akrylowy – organiczny związek chemiczny, najprostszy nienasycony kwas karboksylowy. Jego sole i estry to akrylany.
Otrzymywanie
Współcześnie otrzymywany jest głównie przez utlenianie propylenu. W zależności od warunków utlenianie przebiega jednoetapowo[8]:
- 2CH
2=CH−CH
3 + 3O
2 → 2CH
2=CH−COOH + 2H
2O
lub dwuetapowo[8]:
- 2CH
2=CH−CH
3 + 2O
2 → 2CH
2=CH−CHO + 2H
2O - 2CH
2=CH−CHO + O
2 → 2CH
2=CH−COOH
Badane są też możliwości jego produkcji z tańszego propanu[9].
Dawniej stosowano szereg innych metod, np.[8]:
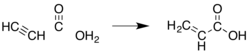
- z acetylenu:
- niskotemperaturowy (40 °C) proces opracowany przez Waltera Reppego:
- wersja wysokotemperaturowa (200 °C, 140 atm, w obecności katalizatora NiBr
2 − CuBr
2):
- hydroliza akrylonitrylu CH
2=CH
2−C≡N - piroliza kwasu octowego do ketenu
- CH
3COOH → CH
2=C=O + H
2O- Keten w reakcji z formaldehydem daje β-propiolakton:
- CH
2=C=O + CH
2=O →
- Związek ten za pomocą hydrolizy kwasowej przeprowadza się w kwas akrylowy
- Keten w reakcji z formaldehydem daje β-propiolakton:
- HCN +
 → HO−CH
→ HO−CH
2CH
2−CN- Powstałą cyjanohydrynę etylenu hydrolizuje się w warunkach kwasowych do hydroksykwasu a następnie poddaje się dehydratacji (eleminacji -OH) otrzymując rzeczony kwas.
- HO-CH2-CH2-CN + H2O -> NH3 + HO-CH2-CH2-COOH -> CH2=CH−COOH + H2O
- Powstałą cyjanohydrynę etylenu hydrolizuje się w warunkach kwasowych do hydroksykwasu a następnie poddaje się dehydratacji (eleminacji -OH) otrzymując rzeczony kwas.
Metody te są stopniowo wycofywane z użycia[8].
Właściwości chemiczne
Kwas akrylowy ulega reakcjom typowym dla alifatycznych kwasów karboksylowych, jak i związków nienasyconych. Jego reaktywność jest podwyższona z powodu występowania układu wiązań sprzężonych C=C−C=O. Atom węgla β ma silny charakter elektrofilowy, dzięki czemu kwas akrylowy łatwo ulega reakcji addycji nukleofilowej. Bardzo łatwo ulega polimeryzacji, która jest silnie egzotermiczna i ma gwałtowny przebieg[8].
Przypisy
- ↑ a b c d e f g h i j Acrylic acid (ZVG: 014360) (ang. • niem.) w bazie GESTIS, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA). [dostęp 2017-10-18].
- ↑ a b Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b c d e f Haynes 2016 ↓, s. 3-8.
- ↑ Haynes 2016 ↓, s. 5-88.
- ↑ Haynes 2016 ↓, s. 15-13.
- ↑ Kwas akrylowy (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2017-10-18].
- ↑ a b Kwas akrylowy (nr 147230) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2017-10-18]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e Acrylic Acid and Derivatives, Takashi Ohara, Takahisa Sato, Noboru Shimizu, Günter Prescher Helmut Schwind, Otto Weiberg, Klaus Marten, Helmut Greim, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, DOI: 10.1002/14356007.a01_161.pub2 (ang.).
- ↑ Michael Hävecker i inni, Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid, „Journal of Catalysis”, 285 (1), 2012, s. 48–60, DOI: 10.1016/j.jcat.2011.09.012 (ang.).
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Ball-and-stick model of the acrylic acid molecule, C3H4O2.
X-ray crystallographic data from Acta Cryst. (1999). C55, IUC9900006.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Acetylene, carbon monoxide, and water add together to give acrylic acid.
Chemical structure of Oxirane (ethylene oxide)
Propiolactone picture was previously made by en-user Edgar181 Chemical structure of propiolactone created with ChemDraw
Structure of Acrylic acid
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances