Kwas askorbinowy
| |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C6H8O6 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 176,13 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd | biały lub prawie biały, krystaliczny proszek lub bezbarwne kryształy, ciemniejące na świetle i powietrzu[1] | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Pochodne sole | askorbinian sodu | ||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||
Kwas askorbinowy, witamina C, E300 (łac. acidum ascorbicum) – organiczny związek chemiczny z grupy nienasyconych alkoholi polihydroksylowych. Jest niezbędny do funkcjonowania organizmów żywych. Dla niektórych zwierząt, w tym ludzi, jest witaminą, czyli musi być dostarczany w pożywieniu. Jest także przeciwutleniaczem stosowanym jako dodatek do żywności[7].
Budowa i właściwości chemiczne
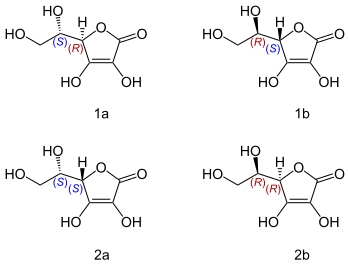
Występuje naturalnie jako związek o konfiguracji L w łańcuchu bocznym i konfiguracji D układu furanowego. Pod wpływem metanolowego roztworu NaOH ulega epimeryzacji do kwasu erytrobowego (kwasu D-izoaskorbinowego, E315), różniącego się konfiguracją łańcucha bocznego[8].
Kwas L-askorbinowy bywa niepoprawnie nazywany „lewoskrętną witaminą C” ze względu na mylenie konfiguracji względnej z aktywnością optyczną[9][10]. W rzeczywistości kwas L-askorbinowy skręca płaszczyznę światła spolaryzowanego w prawą stronę ([α]20D ≃ +20°). Natomiast kwas D-askorbinowy jest przeciwutleniaczem, ale oprócz tego nie ma znaczenia biologicznego – nie działa jako kofaktor, więc nie jest witaminą[11][12][13].
Charakter kwasowy mają grupy hydroksylowe w pozycjach 3 i 4, zwłaszcza grupa 4-OH, której pKa wynosi 4,17[8]. Anion powstały po dysocjacji protonu z grupy 4-OH jest stabilizowany przez rezonans chemiczny:
Jest bardzo nietrwała, łatwo ulega rozpadowi pod wpływem tlenu i wysokiej temperatury[14].
Występowanie i synteza
Biosynteza
Kwas L-askorbinowy występuje naturalnie w wielu organizmach roślinnych i zwierzęcych[7]. W obu królestwach substratem do biosyntezy tego związku jest D-glukoza, jednak przebiega ona w różny sposób. U roślin glukoza jest utleniana w pozycji C-2, po czym następuje epimeryzacja atomu C-5 i kolejne utlenianie, w pozycji C-1. U zwierząt szlak metaboliczny przebiega przez kwas glukuronowy, po czym następuje inwersja szkieletu węglowego, w efekcie czego atomy C-1 i C-6 glukozy stają się odpowiednio atomami C-6 i C-1 kwasu askorbinowego[8].
Niezdolność do syntezy
U szeregu zwierząt, między innymi naczelnych, a także odległych gatunkowo świnek morskich[7][15][16] lub ryb doskonałokostnych (należą do nich pstrąg tęczowy i karp), kwas askorbinowy musi być dostarczany w pożywieniu, gdyż ich organizmy go nie wytwarzają. U naczelnych jest to efektem mutacji w genie odpowiedzialnym za wytwarzanie oksydazy L-gulono-γ-laktonowej (GLO), która w wątrobie katalizuje ostatni etap biosyntezy kwasu askorbinowego z D-glukozy, tj. utleniania L-gulonolaktonu[15][16]. Szacuje się, że unieczynnienie tego genu nastąpiło około 60–75 mln lat temu, wkrótce po rozdzieleniu się małp właściwych i małpiatek[16]. Natomiast u ryb doskonałokostnych oprócz mutacji w GLO obecne są też inne mutacje uniemożliwiające syntezę witaminy C; niezdolność do wytwarzania tego związku pojawiła się u nich ok. 200 mln lat temu[16][17][18].
Produkcja
Większość kwasu askorbinowego produkowanego przemysłowo jest wytwarzana metodą opracowaną w 1934 przez Reichsteina i Grüssnera[19], w której substratem jest także naturalna D-glukoza[8].
Źródła w pożywieniu
Witamina C zawarta w pożywieniu należy do najbardziej wrażliwych na działanie czynników zewnętrznych witamin, niszczy ją (utlenianie) wysoka temperatura, wystawienie na dostęp światła oraz na bezpośredni kontakt z powietrzem[20].
| Produkt | Zawartość (mg/100 g) |
|---|---|
| Acerola | 1600[22] |
| Owoce róży | 426 |
| Papryczka chili zielona | 244 |
| Nać pietruszki | 178 |
| Czarna porzeczka | 177 |
| Papryka | 107 |
| Koperek | 75 |
| Brukselka | 71 |
| Jarmuż | 65 |
| Truskawki | 63 |
| Pomelo | 61[23] |
| Poziomki | 60 |
| Szczypiorek | 60 |
| Szpinak | 54 |
| Pomarańcza | 53[24] |
| Cytryna | 53[25] |
| Kompot z czarnej porzeczki | 46 |
| Biała porzeczka | 45 |
| Kalarepa | 45 |
| Czerwona porzeczka | 44 |
| Kapusta czerwona | 42 |
| Kapusta biała | 40 |
| Koncentrat pomidorowy 30% | 38 |
| Kalafior | 37 |
| Czosnek | 31 |
| Maliny | 31 |
| Boćwina | 27 |
| Szczaw | 27 |
| Agrest | 26 |
| Grejpfrut | 26 |
| Żurawina | 23 |
| Fasola strączkowa | 22 |
| Pomidory | 22 |
| Jeżyny | 21 |
| Rzepa | 21 |
| Korzeń pietruszki | 19 |
| Kapusta kiszona | 16 |
| Czarne jagody | 15 |
| Groszek zielony | 15 |
| Rzodkiewka | 13 |
| Brzoskwinia | 12 |
| Pieczarka | 12 |
| Ziemniaki | 12 |
| Pory | 10 |
| Buraki | 8 |
| Maślak | 8 |
| Banany | 7 |
| Jabłko | 7 |
| Rabarbar | 7 |
| Wiśnie | 7 |
| Cykoria | 6 |
| Morele | 6 |
| Ogórek | 6 |
| Powidła śliwkowe | 6 |
| Rydz mleczaj | 6 |
| Sok pomidorowy | 6 |
| Cebula | 5 |
| Renklody | 5 |
| Sałata | 5 |
| Seler | 5 |
| Śliwki | 5 |
| Winogrona | 5 |
| Czereśnie | 4 |
| Groszek konserwowy | 4 |
| Gruszki | 4 |
| Kurka | 4 |
| Ogórki kiszone | 4 |
| Arbuz | 3 |
| Fasola konserwowa | 3 |
| Orzechy włoskie | 3 |
| Fasola biała | 2 |
| Groch | 2 |
| Marchew | 2 |
| Orzechy laskowe | 2 |
| Produkt | Zawartość (mg/100 g) |
|---|---|
| Wątroba wołowa | 30[a] |
| Wątroba wieprzowa | 22[a] |
| Dorsz | 2[a] |
| Pstrąg | 1[a] |
| Mleko krowie | 1[a] |
Rola w organizmie człowieka
Jest przeciwutleniaczem[30][31]. Aktywuje wiele enzymów[7], ułatwia asymilację żelaza[14][30][32], wpływa na syntezę kortykosteroidów[30][31] oraz niektórych neuroprzekaźników[31]. Utrzymuje prawidłowy stan tkanki łącznej[30][33] (jest niezbędny w syntezie kolagenu[14][31][32][33]), wzmacnia dziąsła i zęby, zabija bakterie wywołujące próchnicę zębów[32]. Wzmacnia odporność organizmu na infekcje[14][31][32][33]. Ułatwia gojenie się ran[33]. Stabilizuje psychikę[32]. Bierze udział w przemianach tyrozyny. Ma również wpływ na zachowanie prawidłowego potencjału oksydacyjnego w komórce.
Badania wskazują brak wpływu zażywania witaminy C na ryzyko pojawienia się przeziębienia oraz mały wpływ na czas jego trwania (skrócenie czasu o 14% dla dzieci i 8% dla dorosłych). Wyjątkiem była grupa uczestników maratonów, narciarzy i żołnierzy przebywających w bardzo niskich temperaturach lub poddanych intensywnemu wysiłkowi fizycznemu, u których zaobserwowano 50% zmniejszenie występowania przeziębienia przy zażywaniu 2 g witaminy C dziennie[34].
Rekomendowane spożycie witaminy C dla dorosłego człowieka wynosi od 45 do 90 mg na dobę[35][36]. Organizmy większości zwierząt i roślin wytwarzają ten związek. Wyjątkiem są organizmy ssaków naczelnych (w tym człowieka), świnki morskiej i niektórych gatunków nietoperzy (ze względu na mutację i utratę enzymu: oksydazy L-gulonolaktonowej), którym musi być ona dostarczona z zewnątrz[37].
Skutki niedoboru
Szkorbut[7][14][30][31][32][33] (krwawienie i owrzodzenie dziąseł, wypadanie zębów)[30][33], kruchość i pękanie naczyń krwionośnych[30][31][32], osłabienie odporności organizmu[30][32][33], obrzmiałe i bolesne stawy[30], nieprawidłowe zrastanie się kości, powolne gojenie się ran[31][33].
Zachodnie społeczeństwa spożywają znacznie więcej witaminy C w diecie, niż jest to niezbędne do zapobiegania rozwoju szkorbutu[38].
Na jej niedobór często cierpią palacze tytoniu, stąd charakterystyczne na ich skórze liczne drobne zmarszczki[32].
Skutki nadmiaru
Kwas askorbinowy nie jest toksyczny, ale przyjmowany w nadmiarze (dawki powyżej 2 g na dobę) może wywoływać dolegliwości żołądka, nudności, biegunkę, wymioty, wysypkę skórną, obniżać odporność po radykalnym zmniejszeniu dawki. Zazwyczaj jednak jego nadmiar wydalany jest z organizmu wraz z moczem.
Ze względu na metaboliczny wpływ witaminy C zaleca się unikanie spożywania większych jej dawek (tj. powyżej 500 mg na dobę) w przypadku występowania lub skłonności do powstawania kamieni nerkowych, w skład których wchodzi szczawian wapnia lub kwas moczowy. Takie samo zalecenie odnosi się też do osób chorujących na takie schorzenia jak hemochromatoza, talasemia i niedokrwistość syderoblastyczna[39][40][41][42][43]. Szacuje się, że ograniczone w czasie dożylne przyjmowanie wysokich dawek witaminy C nie powinno zwiększać ryzyka kamicy[44]. Prospektywna analiza kohortowa z roku 2015 wykazała, że suplementacja witaminy C zwiększa ryzyko wystąpienia kamieni nerkowych u mężczyzn, ale nie u kobiet[45].
Stosowanie wyższych niż zalecane dawek witaminy C w czasie ciąży może być szkodliwe dla płodu. Wysokie dawki tej witaminy, według klasyfikacji FDA ryzyka stosowania leków w czasie ciąży, należą do kategorii C. Oznacza to, że w badaniach na zwierzętach wykazano działanie niepożądane na płód, jednak jej wpływ na ciążę człowieka nie jest potwierdzony w badaniach klinicznych[46].
Suplementacja
Badania naukowe nad potencjalnymi pozytywnymi skutkami zdrowotnymi suplementacji witaminą C dostarczają sprzecznych wyników. Badanie przeprowadzone przez U.S. Preventive Disease Task Force nie wykazało dowodów na ochronny wpływ suplementacji witaminą C przeciwko rozwojowi chorób układu krążenia i nowotworów[47]. Nie udało się także klinicznie udowodnić wpływu witaminy C na długość życia[48].
Zapobieganie rozwojowi nowotworów
Badanie z 2013 roku nie wykazało, że suplementacja witaminą C zmniejsza ryzyko rozwoju raka płuc u pacjentów zdrowych oraz znajdujących się w grupie wysokiego ryzyka (palaczy i narażonych na wdychanie włókien azbestu)[49]. Metaanaliza z roku 2014 wykazała słabą zależność pomiędzy suplementacją witaminą C a zmniejszoną zachorowalnością na raka płuc[50]. Kolejna metaanaliza nie wykazała związku witaminy C z ryzykiem zachorowania na raka prostaty[47].
W celu oszacowania wpływu suplementacji witaminą C na zapadalność na nowotwór jelita grubego przeprowadzono dwie metaanalizy. Jedno z badań wykazało słabą zależność pomiędzy konsumpcją witaminy C a zmniejszoną zapadalnością na tę chorobę. Drugie nie wykazało takich zależności[51][52].
Analiza metadanych z 2011 nie potwierdziła, że witamina C zapobiega rozwojowi nowotworów piersi[53], ale kolejne badanie wykazało, że witamina C może mieć związek ze zwiększoną przeżywalnością u pacjentek już chorych[54].
Terapia nowotworów
Witamina C, podawana dożylnie w formie askorbinianu sodu, wykazuje działanie cytotoksyczne wobec nowotworów i jest wskazywana jako potencjalny lek przeciwnowotworowy. Autorzy uznali wyniki za obiecujące i uzasadniające kontynuowanie badań klinicznych[55][56][57].
Choroby układu krążenia
Metaanaliza z 2013 roku nie wykazała wpływu suplementacji witaminą C na zmniejszenie ryzyka zawału, wylewu, śmierci w wyniku choroby układu krążenia ani śmierci ogółem[58]. Kolejna analiza wykazała jednak odwrotną zależność pomiędzy witaminą C a ryzykiem wylewu[59].
Metaanaliza 44 badań klinicznych wykazała istotny pozytywny wpływ suplementacji dobowymi dawkami witaminy C powyżej 500 mg na funkcje śródbłonka. Wykazano, że efekt ten był silniejszy u osób o zwiększonym ryzyku zapadania na choroby układu krążenia[60].
Choroby przewlekłe
Nie wykazano wpływu suplementacji witaminą C na leczenie reumatoidalnego zapalenia stawów[61].
Badania badające wpływ witaminy C na rozwój choroby Alzheimera osiągnęły sprzeczne wyniki[62][63]. Utrzymywanie zdrowego spożycia witaminy C w diecie jest prawdopodobnie istotniejsze niż suplementacja[64].
Badanie efektu spożywania dawek witaminy C przekraczających RDA nie wykazało jej istotnego wpływu na zapobieganie i hamowanie rozwoju zaćmy starczej[65].
Przeziębienie
Wpływ witaminy C na leczenie przeziębienia był obiektem wielu badań naukowych. Wykazano, że nie jest ona skuteczna w zapobieganiu, czy leczeniu przeziębienia poza szczególnymi przypadkami (zwłaszcza u osób uprawiających intensywnie sport w zimnym otoczeniu)[66][67]. Rutynowa suplementacja witaminą C nie redukuje prawdopodobieństwa zachorowania ani nasilenia przeziębienia w ogólnej populacji, ale może zredukować długość trwania choroby[66][68][69].
COVID-19
Podanie dużych dawek askrobinianu sodu dożylnie wpływa pozytywnie na przebieg COVID-19 u osób zakażonych SARS-CoV-2. Zauważono lżejszy przebieg choroby i poprawę saturacji, kwestia wpływu na śmiertelność nie jest jasna i wymaga dalszych analiz[70][71][72].
Zastosowanie w przemyśle spożywczym
Kwas askorbinowy jest przeciwutleniaczem i jako taki jest stosowany w przemyśle spożywczym, podobnie jak jego sole i estry. Symbole stosowane do oznaczenia tych związków:
- E300 – kwas askorbinowy
- E301 – askorbinian sodu
- E302 – askorbinian wapnia
- E303 – askorbinian potasu
- E304 – estry kwasów tłuszczowych i kwasu askorbinowego
- E304(i) – palmitynian askorbylu
- E304(ii) – stearynian askorbylu
- E315 – kwas izoaskorbinowy (erytrobowy).
Historia
Symptomy szkorbutu opisane zostały po raz pierwszy w relacjach z wypraw krzyżowych. W czasach wielkich odkryć geograficznych (XV–XVI w.) stał się on główną przyczyną śmierci i kalectwa żeglarzy w długich rejsach. Dopiero w roku 1753 szkocki lekarz James Lind odkrył, że chorobie zapobiega i leczy spożywanie soku z owoców cytrusowych[73]. Na początku XX w. odkryto, że świnka morska jest także podatna na tę chorobę i może stanowić model zwierzęcy do jej badań. Umożliwiło to udowodnienie, że rzeczywiście podłożem szkorbutu jest niewłaściwa dieta[74].
Witaminę C wyizolował w 1928 roku węgierski biochemik Albert Szent-Györgyi z bydlęcej kory nadnerczy oraz z soku pomarańczowego i z soku z kapusty, a następnie z papryki. Wykazał, że wyodrębniony związek ma właściwości przeciwszkorbutowe i nadał mu nazwę „kwas heksauronowy” (hexuronic acid). W roku 1933 W.N. Haworth i E.L. Hirst ustalili jego strukturę, a ponadto Haworth oraz niezależnie T. Reichstein i współpracownicy opisali syntezę obu jego enancjomerów. W tym samym roku Szent-Györgyi i Haworth zaproponowali zmianę nazwy związku na „kwas askorbinowy”, aby zobrazować jego właściwości przeciwszkorbutowe[74]. W 1937 obu naukowcom za badania nad witaminą C przyznano Nagrody Nobla[74] – Szent-Györgyi otrzymał ją w dziedzinie fizjologii lub medycyny, a Haworth w dziedzinie chemii.
Uwagi
Przypisy
- ↑ a b c d Farmakopea Polska IX, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2011, s. 4574, ISBN 978-83-88157-77-6.
- ↑ Farmakopea Polska VI, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2002, s. 1176, ISBN 83-88157-18-3.
- ↑ Ascorbic acid, [w:] PubChem [online], United States National Library of Medicine, CID: 54670067 (ang.).
- ↑ a b c d e L-Kwas askorbinowy (nr A5960) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2011-06-22]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Kwas askorbinowy, międzynarodowa karta bezpieczeństwa chemicznego, Międzynarodowa Organizacja Pracy (pol. • ang.).
- ↑ Kwas askorbinowy (nr A5960) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2011-06-22]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e Słownik tematyczny. Biologia, cz. 1, Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 21, ISBN 978-83-01-16529-1.
- ↑ a b c d Manfred Eggersdorfer i współpr.: Vitamins. 10. Vitamin C (l-Ascorbic Acid). W: Ullmann’s Encyclopedia of Industrial Chemistry. Veinheim: Wiley-VCH Verlag, 2005, s. 110–123. DOI: 10.1002/14356007.a27_443. (ang.).
- ↑ Piotr Król, Witamina C Lewoskrętna – Właściwości – Czy różni się od Prawoskrętnej?, Medicover, 21 czerwca 2018 [dostęp 2020-03-01].
- ↑ Damian Parol, Lewoskrętna witamina C, 19 czerwca 2016 [dostęp 2020-03-01].
- ↑ Łukasz Sakowski: Czy lewoskrętna witamina C wyleczy raka, czyli jak szarlatani nabierają ludzi. CrazyNauka, 2016-10-23. [dostęp 2018-01-31]. [zarchiwizowane z tego adresu (2017-08-21)]. (pol.).
- ↑ Damian Parol: Lewoskrętna witamina C. 2016-06-19. [dostęp 2018-01-31]. [zarchiwizowane z tego adresu (2017-06-16)]. (pol.).
- ↑ John Henry Gaddum: Gaddum’s Pharmacology. A.S.V. Burgen, James Fabian Mitchell (redaktorzy). Wyd. 9. Oxford University Press, 1985, s. 136, seria: Oxford Medical Publications. ISBN 978-0-19-261423-0.
- ↑ a b c d e Barbara Bukała: Biologia. Fizjologia zwierząt z elementami fizjologii człowieka. Kraków: Wydawnictwo Szkolne Omega, 2005, s. 149–150. ISBN 83-7267-192-3.
- ↑ a b J.J. Burns. Missing step in man, monkey and guinea pig required for the biosynthesis of L-ascorbic acid. „Nature”. 180 (4585), s. 553, 1957. DOI: 10.1038/180553a0. PMID: 13477232. (ang.).
- ↑ a b c d M.Y. Lachapelle, G. Drouin. Inactivation dates of the human and guinea pig vitamin C genes. „Genetica”. 139 (2), s. 199–207, 2011. DOI: 10.1007/s10709-010-9537-x. PMID: 21140195. (ang.).
- ↑ K. Dabrowski. Gulonolactone oxidase is missing in teleost fish. The direct spectrophotometric assay. „Biol Chem Hoppe Seyler”. 371 (3), s. 207–214, 1990. DOI: 10.1515/bchm3.1990.371.1.207. PMID: 2340104. (ang.).
- ↑ K. Dabrowski. Primitive actimoterigian fishes can synthesize ascorbic acid. „Experientia”. 50 (8), s. 745–748, 1994. DOI: 10.1007/BF01919376. (ang.).
- ↑ T. Reichstein, A. Grüssner. Eine ergiebige Synthese der l-Ascorbinsäure (C-Vitamin). „Helvetica Chimica Acta”. 17 (1), s. 311–328, 1934. DOI: 10.1002/hlca.19340170136. (niem.).
- ↑ Vitamin C. W: P. E. Norris: About Vitamins: Nature’s Keys to Radiant Health. Richard Clay (The Chaucer Press), Ltd., 1982, s. 25. ISBN 0-7225-0803-4. (ang.).
- ↑ a b Anna Szczepańska, Anna Ners, Zofia Zawistowska: Kuchnia i zdrowie. Warszawa: Państwowy Zakład Wydawnictw Lekarskich, 1988. ISBN 83-200-1072-1.
- ↑ Acerola (Malpighia glabra L., M. punicifolia M. emarginata DC.) Agriculture, Production, and Nutrition. W: Paul D. Johnson: Plants in Human Health and Nutrition Policy. T. 91. Karger Publishers, 2003, s. 63–74. ISBN 978-3-8055-7554-6. (ang.).
- ↑ Pummelo, raw. [w:] National Nutrient Database for Standard Reference Release 28 [on-line]. United States Department of Agriculture. [dostęp 2016-04-17]. [zarchiwizowane z tego adresu (2016-04-06)]. (ang.).
- ↑ Oranges, raw, all commercial varieties. [w:] National Nutrient Database for Standard Reference Release 28 [on-line]. United States Department of Agriculture. [dostęp 2016-04-17]. [zarchiwizowane z tego adresu (2016-04-06)]. (ang.).
- ↑ Lemons, raw, without peel. [w:] National Nutrient Database for Standard Reference Release 28 [on-line]. United States Department of Agriculture. [dostęp 2016-04-17]. [zarchiwizowane z tego adresu (2016-04-06)]. (ang.).
- ↑ Nutrients: Vitamin C, total ascorbic acid(mg). Food Groups: Beef Products. [w:] USDA Food Composition Databases [on-line]. United States Department of Agriculture, Agricultural Research Service. [dostęp 2018-08-23]. [zarchiwizowane z tego adresu (2018-08-23)]. (ang.).
- ↑ Nutrients: Vitamin C, total ascorbic acid(mg). Food Groups: Pork Products. [w:] USDA Food Composition Databases [on-line]. United States Department of Agriculture, Agricultural Research Service. [dostęp 2018-08-23]. [zarchiwizowane z tego adresu (2018-08-23)]. (ang.).
- ↑ a b Nutrients: Vitamin C, total ascorbic acid(mg). Food Groups: Finfish and Shellfish Products. [w:] USDA Food Composition Databases [on-line]. United States Department of Agriculture, Agricultural Research Service. [dostęp 2018-08-23]. [zarchiwizowane z tego adresu (2018-08-23)]. (ang.).
- ↑ Nutrients: Vitamin C, total ascorbic acid(mg). Food Groups: Dairy and Egg Products. [w:] USDA Food Composition Databases [on-line]. United States Department of Agriculture, Agricultural Research Service. [dostęp 2018-08-23]. [zarchiwizowane z tego adresu (2018-08-23)]. (ang.).
- ↑ a b c d e f g h i Tablice biologiczne. Witold Mizerski (red.). Wyd. IV. Warszawa: Wydawnictwo Adamantan, 2004, s. 30–31. ISBN 83-7350-059-6.
- ↑ a b c d e f g h Biologia. Czesław Jura, Jacek Godula (redaktorzy). Wyd. VII (przekład). Warszawa: Multico Oficyna Wydawnicza, 2007, s. 889. ISBN 978-83-7073-412-1.
- ↑ a b c d e f g h i Biologia. Vademecum maturalne 2011. Monika Balcerowicz (red.). Gdynia: Operon, 2010, s. 219–221. ISBN 978-83-7680-166-7.
- ↑ a b c d e f g h Encyklopedia Biologia. Agnieszka Nawrot (red.). Kraków: Wydawnictwo GREG, s. 600. ISBN 978-83-7327-756-4.
- ↑ Harri Hemilä, Robert M. Douglas. Vitamin C for Preventing and Treating the Common Cold. „PLoS Medicine”. 2 (6), s. 168, 2005. PLoS Med. DOI: 10.1371/journal.pmed.0020168. (ang.).
- ↑ Vitamin and mineral requirements in human nutrition, 2nd edition. Światowa Organizacja Zdrowia, 2004. [dostęp 2010-02-08]. (ang.).
- ↑ Health Canada: Vitamin C: Recommended Dietary Allowances. 2007-09-13. [dostęp 2010-02-08]. [zarchiwizowane z tego adresu (2008-05-16)]. (ang.).
- ↑ Biochemia stresu oksydacyjnego. Uniwersytet Jagielloński, Zakład Biotechnologii Medycznej. s. 39. [dostęp 2014-11-07].
- ↑ Table 3.2 Vitamin C intakes (expressed as mg/d) from food sources. [w:] Canadian Community Health Survey Cycle 2.2, Nutrition [on-line]. Statistics Canada, 2004. [dostęp 2016-04-17]. [zarchiwizowane z tego adresu]. (ang.).
- ↑ L.K. Massey, M. Liebman, S. A. Kynast-Gales. Ascorbate increases human oxaluria and kidney stone risk. „Journal of Nutrition”. 135 (7), s. 1673–1677, 2005. PMID: 15987848. (ang.).
- ↑ C.S. Johnston. Biomarkers for establishing a tolerable upper intake level for vitamin C. „Nutrition Reviews”. 57 (3), s. 71–77, 1999. PMID: 10101920. (ang.).
- ↑ C.S. Tsao, S.L. Salimi. Effect of large intake of ascorbic acid on urinary and plasma oxalic acid levels. „International Journal of Vitamin and Nutrition Research”. 54 (2–3), s. 245–249, 1984. PMID: 6500850. (ang.).
- ↑ K.H. Schmidt, V. Hagmaier, D.H. Hornig, J.P. Vuilleumier i inni. Urinary oxalate excretion after large intakes of ascorbic acid in man. „American Journal of Clinical Nutrition”. 34 (3), s. 305–311, 1981. PMID: 7211731. (ang.).
- ↑ M. Urivetzky, D. Kessaris, A.D. Smith. Ascorbic acid overdosing: A risk factor for calcium oxalate nephrolithiasis. „Journal of Urology”. 147 (5), s. 1215–1218, 1992. PMID: 1569652. (ang.).
- ↑ L. Robitaille, O.A. Mamer, W.H. Miller, M. Levine i inni. Oxalic acid excretion after intravenous ascorbic acid administration. „Metabolism”. 58 (2), s. 263–269, 2009. DOI: 10.1016/j.metabol.2008.09.023. PMID: 19154961. PMCID: PMC3482487. (ang.).
- ↑ Pietro Manuel Ferraro, Gary C. Curhan, Giovanni Gambaro, Eric N. Taylor. Total, Dietary, and Supplemental Vitamin C Intake and Risk of Incident Kidney Stones. „American Journal of Kidney Diseases”, 2015. DOI: 10.1053/j.ajkd.2015.09.005. PMID: 26463139. (ang.).
- ↑ Ascorbic acid Use During Pregnancy. Drugs.com. [dostęp 2016-04-17]. (ang.).
- ↑ a b
 J. Stratton, M. Godwin. The effect of supplemental vitamins and minerals on the development of prostate cancer: a systematic review and meta-analysis. „Family Practice”. 28 (3), s. 243–252, 2011. DOI: 10.1093/fampra/cmq115. PMID: 21273283. (ang.).
J. Stratton, M. Godwin. The effect of supplemental vitamins and minerals on the development of prostate cancer: a systematic review and meta-analysis. „Family Practice”. 28 (3), s. 243–252, 2011. DOI: 10.1093/fampra/cmq115. PMID: 21273283. (ang.). - ↑ G. Bjelakovic, D. Nikolova, L.L. Gluud, R.G. Simonetti i inni. Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases. „Cochrane Database of Systematic Reviews”. 3, s. CD007176, 2012. DOI: 10.1002/14651858.CD007176.pub2. PMID: 22419320. (ang.).
- ↑ M. Cortés-Jofré, J.R. Rueda, G. Corsini-Muñoz, C. Fonseca-Cortés i inni. Drugs for preventing lung cancer in healthy people. „Cochrane Database of Systematic Reviews”. 10, s. CD002141, 2012. DOI: 10.1002/14651858.CD002141.pub2. PMID: 23076895. (ang.).
- ↑ J. Luo, L. Shen, D. Zheng. Association between vitamin C intake and lung cancer: A dose-response meta-analysis. „Scientific Reports”. 4, s. 6161, 2014. DOI: 10.1038/srep06161. PMID: 25145261. (ang.).
- ↑ X. Xu, E. Yu, L. Liu, W. Zhang i inni. Dietary intake of vitamins A, C, and E and the risk of colorectal adenoma: A meta-analysis of observational studies. „European Journal of Cancer Prevention”. 22 (6), s. 529–539, 2013. DOI: 10.1097/CEJ.0b013e328364f1eb. PMID: 24064545. (ang.).
- ↑ D. Papaioannou, K.L. Cooper, C. Carroll, D. Hind i inni. Antioxidants in the chemoprevention of colorectal cancer and colorectal adenomas in the general population: A systematic review and meta-analysis. „Colorectal Disease”. 13 (10), s. 1085–1099, 2011. DOI: 10.1111/j.1463-1318.2010.02289.x. PMID: 20412095. (ang.).
- ↑ H. Fulan, J. Changxing, W.Y. Baina, Z. Wencui i inni. Retinol, vitamins A, C, and E and breast cancer risk: A meta-analysis and meta-regression. „Cancer Causes Control”. 22 (10), s. 1383–1396, 2011. DOI: 10.1007/s10552-011-9811-y. PMID: 21761132. (ang.).
- ↑ H.R. Harris, N. Orsini, A. Wolk. Vitamin C and survival among women with breast cancer: A meta-analysis. „European Journal of Cancer”. 50 (7), s. 1223–1231, 2014. DOI: 10.1016/j.ejca.2014.02.013. PMID: 24613622. (ang.).
- ↑ N.H. Riordan i inni, Intravenous ascorbate as a tumor cytotoxic chemotherapeutic agent, „Medical Hypotheses”, 44 (3), 1995, s. 207–213, DOI: 10.1016/0306-9877(95)90137-x, PMID: 7609676 (ang.).
- ↑ B.V. Sunil Kumar, Satparkash Singh, Ramneek Verma, Anticancer potential of dietary vitamin D and ascorbic acid: A review, „Critical Reviews in Food Science and Nutrition”, 57 (12), 2017, s. 2623–2635, DOI: 10.1080/10408398.2015.1064086, PMID: 26479551 (ang.).
- ↑ Gina Nauman i inni, Systematic Review of Intravenous Ascorbate in Cancer Clinical Trials, „Antioxidants”, 7 (7), 2018, DOI: 10.3390/antiox7070089, PMID: 30002308, PMCID: PMC6071214 (ang.).
- ↑
 Y. Ye, J. Li, Z. Yuan. Effect of antioxidant vitamin supplementation on cardiovascular outcomes: A meta-analysis of randomized controlled trials. „PLoS One”. 8 (2), s. e56803, 2013. DOI: 10.1371/journal.pone.0056803. PMID: 23437244. PMCID: PMC3577664. (ang.).
Y. Ye, J. Li, Z. Yuan. Effect of antioxidant vitamin supplementation on cardiovascular outcomes: A meta-analysis of randomized controlled trials. „PLoS One”. 8 (2), s. e56803, 2013. DOI: 10.1371/journal.pone.0056803. PMID: 23437244. PMCID: PMC3577664. (ang.). - ↑
 G.C. Chen, D.B. Lu, Z. Pang, Q.F. Liu. Vitamin C intake, circulating vitamin C and risk of stroke: A meta-analysis of prospective studies.. „Journal of the American Heart Association”. 2 (6), s. e000329, 2013. DOI: 10.1161/JAHA.113.000329. PMID: 24284213. PMCID: PMC3886767. (ang.).
G.C. Chen, D.B. Lu, Z. Pang, Q.F. Liu. Vitamin C intake, circulating vitamin C and risk of stroke: A meta-analysis of prospective studies.. „Journal of the American Heart Association”. 2 (6), s. e000329, 2013. DOI: 10.1161/JAHA.113.000329. PMID: 24284213. PMCID: PMC3886767. (ang.). - ↑ A.W. Ashor, J. Lara, J.C. Mathers, M. Siervo. Effect of vitamin C on endothelial function in health and disease: A systematic review and meta-analysis of randomised controlled trials. „Atherosclerosis”. 235 (1), s. 9–20, 2014. DOI: 10.1016/j.atherosclerosis.2014.04.004. PMID: 24792921. (ang.).
- ↑
 C.C. Rosenbaum, D.P. O’Mathúna, M. Chavez, K. Shields. Antioxidants and antiinflammatory dietary supplements for osteoarthritis and rheumatoid arthritis. „Alternative Therapies in Health and Medicine”. 16 (2). s. 32–40. PMID: 20232616. (ang.).
C.C. Rosenbaum, D.P. O’Mathúna, M. Chavez, K. Shields. Antioxidants and antiinflammatory dietary supplements for osteoarthritis and rheumatoid arthritis. „Alternative Therapies in Health and Medicine”. 16 (2). s. 32–40. PMID: 20232616. (ang.). - ↑ G.E. Crichton, J. Bryan, K.J. Murphy. Dietary antioxidants, cognitive function and dementia – A systematic review. „Plant Foods for Human Nutrition”. 68 (3), s. 279–292, 2013. DOI: 10.1007/s11130-013-0370-0. PMID: 23881465. (ang.).
- ↑ F.J. Li, L. Shen, H.F. Ji. Dietary intakes of vitamin E, vitamin C, and β-carotene and risk of Alzheimer’s disease: A meta-analysis. „Journal of Alzheimer’s Disease”. 31 (2), s. 253–258, 2012. DOI: 10.3233/JAD-2012-120349. PMID: 22543848. (ang.).
- ↑
 F.E. Harrison. A critical review of vitamin C for the prevention of age-related cognitive decline and Alzheimer’s disease. „Journal of Alzheimer’s Disease”. 29 (4), s. 711–726, 2012. DOI: 10.3233/JAD-2012-111853. PMID: 22366772. PMCID: PMC3727637. (ang.).
F.E. Harrison. A critical review of vitamin C for the prevention of age-related cognitive decline and Alzheimer’s disease. „Journal of Alzheimer’s Disease”. 29 (4), s. 711–726, 2012. DOI: 10.3233/JAD-2012-111853. PMID: 22366772. PMCID: PMC3727637. (ang.). - ↑
 M.C. Mathew, A.M. Ervin, J. Tao, R.M. Davis. Antioxidant vitamin supplementation for preventing and slowing the progression of age-related cataract. „Cochrane Database of Systematic Reviews”. 6, s. CD004567, 2012. DOI: 10.1002/14651858.CD004567.pub2. PMID: 22696344. PMCID: PMC4410744. (ang.).
M.C. Mathew, A.M. Ervin, J. Tao, R.M. Davis. Antioxidant vitamin supplementation for preventing and slowing the progression of age-related cataract. „Cochrane Database of Systematic Reviews”. 6, s. CD004567, 2012. DOI: 10.1002/14651858.CD004567.pub2. PMID: 22696344. PMCID: PMC4410744. (ang.). - ↑ a b R.M. Douglas, H. Hemilä, E. Chalker, B. Treacy. Vitamin C for preventing and treating the common cold. „Cochrane Database of Systematic Reviews”, s. CD000980, 2007. DOI: 10.1002/14651858.CD000980.pub3. PMID: 17636648. (ang.).
- ↑ K.A. Heimer, A.M. Hart, L.G. Martin, S. Rubio-Wallace. Examining the evidence for the use of vitamin C in the prophylaxis and treatment of the common cold. „Journal of the American Association of Nurse Practitioners”. 21 (5), s. 295–300, 2009. DOI: 10.1111/j.1745-7599.2009.00409.x. PMID: 19432914. (ang.).
- ↑ Harri Hemilä, E. Chalker. Vitamin C for preventing and treating the common cold. „Cochrane Database of Systematic Reviews”. 1, s. CD000980, 2013. DOI: 10.1002/14651858.CD000980.pub4. PMID: 23440782. (ang.).
- ↑ Harri Hemilä, Vitamin C and Infections, „Nutrients”, 9 (4), 2017, DOI: 10.3390/nu9040339, ISSN 2072-6643, PMID: 28353648, PMCID: PMC5409678 [dostęp 2017-09-27].
- ↑ Harri Hemilä, Anitra Carr, Elizabeth Chalker, Vitamin C May Increase the Recovery Rate of Outpatient Cases of SARS-CoV-2 Infection by 70%: Reanalysis of the COVID A to Z Randomized Clinical Trial, „Frontiers in Immunology”, 12, 2021, DOI: 10.3389/fimmu.2021.674681, PMID: 34040614, PMCID: PMC8141621 [dostęp 2021-09-02] (ang.).
- ↑ Dengfeng Gao i inni, The efficiency and safety of high-dose vitamin C in patients with COVID-19: a retrospective cohort study, „Aging”, 13 (5), 2021, s. 7020–7034, DOI: 10.18632/aging.202557, PMID: 33638944, PMCID: PMC7993712 [dostęp 2021-09-02] (ang.).
- ↑ Jing Zhang i inni, Pilot trial of high-dose vitamin C in critically ill COVID-19 patients, „Annals of Intensive Care”, 11 (1), 2021, s. 5, DOI: 10.1186/s13613-020-00792-3, PMID: 33420963, PMCID: PMC7794643 [dostęp 2021-09-02] (ang.).
- ↑ scurvy, [w:] Encyclopædia Britannica [online] [dostęp 2018-02-16] (ang.).
- ↑ a b c Bernd Oster, Ulrich Fechtel: Vitamins. Vitamin C. History. W: Ullmann’s Encyclopedia of Chemical Industrial Chemistry. Weinheim: Wiley-VCH Verlag, 2005, s. 111. DOI: 10.1002/14356007.a27_443. ISBN 978-3-527-30673-2.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.L-ascorbic acid
Autor: MarekMiś, Licencja: CC BY 4.0
Kryształy kwasu askorbinowego (witamina C) sfotografowane przy pomocy mikroskopu optycznego. Technika oświetleniowa łączona - ciemne pole oraz polaryzacja. Powiększenie 100X
Autor: MarekMiś, Licencja: CC BY 4.0
Kryształy kwasu askorbinowego (witamina C) sfotografowane przy pomocy mikroskopu optycznego z zastosowaniem specjalnej techniki oświetleniowej - polaryzacji. Powiększenie 100X
stereo isomers of ascorbic acid: L-ascorbic acid [Vitamin C] (1a); D-ascorbic acid (1b); L-isoascorbic acid (2a); D-isoascorbic acid or D-erythorbic acid (2b). Isoascorbic acid by definition has D chirality on the carbon in its hydroxyl chain, the L and D in its name therefore referring to the chirality of the carbon atom in the pentacycle. Conversly the L and D in ascorbic acids name refers to the chirality on the carbon in the hydroxyl chain.
Diagram illustrating how the resonance stabilization of the conjugate base of ascorbic acid makes the hydroxyl proton more acidic than a typical hydroxyl group.
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.