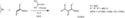Kwas borowy
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | H3BO3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | B(OH)3, BH3O3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molowa | 61,83 g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Kwas borowy, pot. kwas borny, (łac. Acidum boricum), H
3BO
3 – nieorganiczny związek chemiczny, słaby kwas występujący w przyrodzie jako minerał sassolin. Sole i estry kwasu borowego to borany[a].
Kwas borowy został po raz pierwszy otrzymany z boraksu przez Wilhelma Homberga (1652-1715), stąd znany był później jako sal sedativum Hombergi („sól uspokajająca Homberga”). Obecność kwasu borowego lub jego soli stwierdzono w soli morskiej i roślinach (szczególnie w owocach).
Właściwości chemiczne i fizyczne
Kwas borowy można otrzymać w reakcji gorącego roztworu boraksu z mocnymi kwasami; po ochłodzeniu wytrąca się z roztworu. Jest nietrwały termicznie, w temperaturze powyżej 100 °C oddaje część wody i przechodzi w kwas metaborowy[7]:
- H
3BO
3 ⇌ HBO
2 + H
2O
Stosunkowo słabo rozpuszcza się w wodzie (w temp. 20 °C stęż. maks. wynosi 4,7%). Rozpuszczalność rośnie wraz z temperaturą, do 27,5% w 100 °C. W roztworach wodnych ulega dysocjacji, będąc równocześnie akceptorem jonów wodorotlenowych[3]:
- B(OH)
3 + 2H
2O ⇌ B(OH)−
4 + H
3O+
Jest bardzo słabym kwasem (pKa = 9,23 w 25 °C). Odczyn jego roztworów zmienia się znacząco ze stężeniem, od pH = 6,1 dla c = 0,1% do 3,7 dla roztworu nasyconego, tj. 4,7% (20 °C). Jest to wynikiem powstawania tri- i tetramerów przy większych stężeniach (jony H
4B
3O−
7 i H
4B
4O−
9)[3].
Rozpuszcza się w polarnych rozpuszczalnikach organicznych, takich jak alkohole, pirydyna i dioksan[3].
Podobnie jak inne związki boru, barwi płomień na kolor zielony.
Jest substancją umiarkowanie toksyczną[8][9].
Zastosowania
Kwas borowy jest stosowany m.in. jako składnik nawozów, środek do impregnacji drewna, składnik do produkcji szkła borowego i farb, a także w garbarstwie[10][11]. Jest wykorzystywany również jako konserwant (E284).
Kwas borowy jest związkiem dostępnym, niedrogim i stosunkowo mało toksycznym, przez co znalazł zastosowanie jako „zielony” katalizator szeregu reakcji chemicznych (patrz: zielona chemia).
Np. w obecności 10% mol kwasu borowego aminy w roztworach wodnych ulegają addycji do aktywnych związków nienasyconych (reakcja aza-Michaela) z wydajnościami 70 – 95%[12]:
Z kolei acetylooctan etylu w obecności 10%mol kwasu borowego ulega wydajnej transestryfikacji z szeregiem alkoholi o zróżnicowanych strukturach, np. z alkoholem benzylowym[13]:
Opisano także zastosowanie kwasu borowego jako katalizatora w reakcjach kwasów karboksylowych z aminami i alkoholami z utworzeniem odpowiednio amidów[14]:
Przypuszcza się, że pierwszym etapem reakcji jest utworzenie przez kwas borowy i kwas organiczny mieszanego bezwodnika, który następnie działa jako czynnik acylujący[14]:
Zastosowania medyczne
Rozcieńczony roztwór kwasu borowego jest środkiem dezynfekującym. W laboratoriach jest stosowany jako środek neutralizujący do przemywania skóry po oblaniu ługami. Środek złuszczający i ściągający. W mieszaninie z talkiem jest składnikiem zasypki do stóp zwalczającej przykry zapach i nadmierne pocenie (nazwa handlowa Antypot). Jest również składnikiem farmakopealnej maści bornej.
Kwas borny stosunkowo łatwo wchłania się z uszkodzonego naskórka lub błony śluzowej, podczas gdy wydalanie z organizmu jest bardzo wolne. Skutkiem tego jest gromadzenie się preparatu w wątrobie oraz układzie nerwowym. Długotrwałe stosowanie kwasu borowego może prowadzić także do uszkodzenia nerek.
Uwagi
- ↑ Wg polskiej nomenklatury opartej o zalecenia IUPAC z 1990 r., nazwa „borany” (ang. boranes) jest nazwą systematyczną borowodorów (BH
3, B
2H
6 itd.) oraz akceptowaną nazwą zwyczajową pochodnych kwasu borowego (ang. borates), których polska nazwa systematyczna brzmiała wówczas „oksoborany”[5] (ang. oxoborates). Wg nowszej nomenklatury IUPAC z 2005 r., która nie ma oficjalnego polskiego odpowiednika, ang. nazwa zwyczajowa borates (pol. „borany”) jest nadal akceptowana, natomiast nazwa systematyczna brzmi trioxidoborates[6] (pol. „trioksydoborany”).
Przypisy
- ↑ a b Farmakopea Polska IX, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2011, s. 4574, ISBN 978-83-88157-77-6.
- ↑ Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 209, ISBN 83-7183-240-0.
- ↑ a b c d e f Robert A. Smith, Boric Oxide, Boric Acid, and Borates, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 4–7, DOI: 10.1002/14356007.a04_263 (ang.).
- ↑ David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-53, ISBN 978-1-4200-9084-0 (ang.).
- ↑ Nomenklatura chemii nieorganicznej – zalecenia 1990, Polskie Towarzystwo Chemiczne, 1998 (seria Wiadomości Chemiczne. Biblioteka), ISBN 83-229-1873-9 [dostęp 2019-06-16].
- ↑ Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, ISBN 978-0-85404-438-2 (ang.).
- ↑ Philip John Durrant, Bryl Durrant: Zarys współczesnej chemii nieorganicznej. Warszawa: PWN, 1965, s. 561–565.
- ↑ MSDS kwasu borowego (ang.). Merck Chemicals. [dostęp 2010-05-11].
- ↑ kwas borowy, [w:] GESTIS-Stoffdatenbank [online], Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 3640 [dostęp 2010-05-11] (niem. • ang.).
- ↑ borowy kwas, [w:] Encyklopedia techniki. Chemia, Władysław Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, s. 93–94, OCLC 33835352.
- ↑ kwas borowy, [w:] Jerzy Chodkowski (red.), Mały słownik chemiczny, wyd. V, Warszawa: Wiedza Powszechna, 1976, s. 281.
- ↑ Mihir K. Chaudhuri, Sahid Hussain, M. Lakshmi Kantam, B. Neelimab. Boric acid: a novel and safe catalyst for aza-Michael reactions in water. „Tetrahedron Letters”, s. 8329–8331, 2005. DOI: 10.1016/j.tetlet.2005.09.167.
- ↑ G.C.M. Kondaiah, L. Amarnath Reddy, K. Srihari Babu, V.M. Gurav, K.G. Huge, R. Bandichhor, P. Pratap Reddy, A. Bhattacharya, R. Vijaya Anand. Boric acid: an efficient and environmentally benign catalyst for transesterification of ethyl acetoacetate. „Tetrahedron Letters”, s. 106–109, 2008. DOI: 10.1016/j.tetlet.2007.11.008.
- ↑ a b Pingwah Tang, Boric acid catalyzed amide formation from carboxylic acids and amines: N-benzyl-4-phenylbutyramide, „Organic Syntheses”, 81, 2005, s. 262, DOI: 10.15227/orgsyn.081.0262.
- ↑ Todd Houston. Boric Acid Catalyzed Chemoselective Esterification of α-Hydroxycarboxylic Acids. „Org. Lett.”. 6, s. 679–681, 2004. DOI: 10.1021/ol036123g.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Structural formula of the boric acid molecule
Autor: Filips Filip Stefaniak, Licencja: CC0
transestryfikacja katalizowana kwasem borowym
Autor: Filip Stefaniak, Licencja: CC0
Reakcja kwasu 4-fenylomasłowego z banzyloaminą katalizowana kwasem borowym
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Autor: Filips Filip Stefaniak, Licencja: CC0
Reakcja aza-Michaela katalizowana B(OH)3
Autor: Filips Filip Stefaniak, Licencja: CC0
Reakcja esteryfikacji kwasu migdałowego izopropanolem, katalizowana kwasem borowym, z utworzeniem migdalanu izopropylu
Autor: Filips Filip Stefaniak, Licencja: CC0
Mechanizm amidowania katalizowanego kwasem borowym