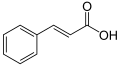
Kwas cynamonowy
| |||||||||||||||||||||||||||||||||||||
(c) Aleksander Sobolewski via Wikimedia Commons, CC BY-SA 4.0 Próbka związku (izomer trans) | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C9H8O2 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | C6H5-CH=CH-COOH | ||||||||||||||||||||||||||||||||||||
| Masa molowa | 148,17 g/mol | ||||||||||||||||||||||||||||||||||||
| Wygląd | bezbarwne kryształy[1] | ||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Podobne związki | stylben | ||||||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||
Kwas cynamonowy – organiczny związek chemiczny, kwas karboksylowy zawierający pierścień benzenowy oraz wiązanie podwójne. Jest stosowany w kosmetyce i medycynie jako środek przeciwbakteryjny.
Występowanie
Występuje w balsamie peruwiańskim.
Otrzymywanie
Otrzymywany syntetycznie z aldehydu benzoesowego w reakcji Perkina przez ogrzewanie benzaldehydu w obecności bezwodnika octowego:
Biochemia
Kwas cynamonowy jest związkiem pośrednim w biosyntezie fenylopropanoidów z kwasu szikimowego[3][4]. Kwas szikimowy jest prekursorem wielu alkaloidów, kwasów aromatycznych i pochodnych indolowych. Fenylopropanoidy to klasa metabolitów pochodzących od fenyloalaniny. Są szeroko rozpowszechnione w roślinach pełniąc wiele funkcji w mechanizmach obronnych, pigmentyzacyjnych, czy przekazywania sygnałów. Fenyloalanina zostaje najpierw przekształcona w cynamoniany, a następnie w kumaryniany, kawowiany, feruliany, synapiniany. Kwas cynamonowy jest więc prekursorem tych kwasów.
Zastosowanie
Estry metylowe, etylowe i benzylowe kwasu cynamonowego wykorzystuje się komercyjnie w przemyśle perfumeryjnym. Kwas cynamonowy i jego pochodne zawierające ugrupowania estrowe, bądź karboksylowe są wykorzystywane jako istotne składniki substancji aromatycznych, perfum, wyrobu syntetycznego indygo i farmaceutyków oraz barwników.
Kwas cynamonowy może działać jako filtr optyczny lub dezaktywować cząsteczki, które zostały wzbudzone przez światło w celu ochrony polimerów i substancji organicznych. W kosmetyce cynamoniany są używane jako środki przeciwsłoneczne do ochrony skóry przeciw promieniowaniem UV (UV-A i UV-B).

Zobacz też
- stilben
- kwas fumarowy
- kwas fenylooctowy
- alkohol cynamonowy
Przypisy
- ↑ a b c d Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ Kwas cynamonowy (nr C80857) w katalogu produktów Sigma-Aldrich (Merck KGaA). [dostęp 2017-01-07].
- ↑ Takayoshi Higuchi: Biochemistry of Lignification (ang.). Wood Research No. 66, Kwiecień 1979. s. 1-16. [dostęp 2008-09-16].
- ↑ CINNAMIC ACID (ang.). [dostęp 2008-09-16].
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Cinnamic acid photochemical isomerization
Structure of Cinnamic acid
Cinnamic acid molecule model
Zimtsäuresynthese nach Perkin