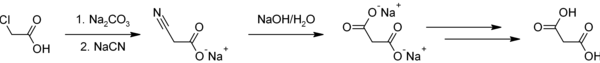Kwas malonowy
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny | C3H4O4 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | HOOC−CH | ||||||||||||||||||||||||||||
| Masa molowa | 104,06 g/mol | ||||||||||||||||||||||||||||
| Wygląd | bezbarwny[1] | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki | bezwodnik octowy, propanon, propanal, propanodial | ||||||||||||||||||||||||||||
| Pochodne | maloniany, Kwas metylomalonowy | ||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
Kwas malonowy, kwas propanodiowy, HOOC−CH
2−COOH – organiczny związek chemiczny z grupy kwasów dikarboksylowych. Jego sole i estry są nazywane malonianami. Jego nazwa pochodzi od łacińskiego słowa malum oznaczającego „jabłko”. Posiada własności silnie drażniące skórę i błony śluzowe. Jego moc jest zbliżona do mocy kwasu octowego.
Po podgrzaniu do 150 °C następuje jego dekarboksylacja do kwasu octowego i dwutlenku węgla[1].
Odwadniając kwas malonowy otrzymuje się podtlenek węgla.
Otrzymywanie
Kwas malonowy można otrzymać z kwasu octowego[5]:
Kwas octowy chloruje się do kwasu chlorooctowego. Tworzy się sól sodową za pomocą węglanu sodu, która następnie reaguje z cyjankiem sodu tworząc sól sodową kwasu cyjanooctowego w reakcji substytucji nukleofilowej. Grupą nitrylową hydrolizuje się za pomocą wodorotlenku sodu do malonianu sodu, który po zakwaszeniu tworzy kwas malonowy.
Patologia
Kwas malonowy występuje naturalnie w organizmie człowieka i bierze udział w biosyntezie lipidów[6]. Jeśli podwyższonemu stężeniu kwasu malonowego towarzyszy podwyższone stężenie kwasu metylomalonowego, może to świadczyć o chorobie genetycznej spowodowanej mutacją w genie ACSF3 – złożonej kwasicy malonowej i metylomalonowej (CMAMMA, z ang. combined malonic and methylmalonic aciduria). Obliczając stosunek kwasu malonowego do metylomalonowego w osoczu krwi, CMAMMA można odróżnić od klasycznej kwasicy metylomalonowej[7].
Zastosowania
Kwas malonowy i jego pochodne mają szerokie zastosowanie w przemyśle do produkcji leków, witamin, barwników, klejów, substancji zapachowych, a także w agrochemii[8]. Może być użyty do wprowadzania fragmentu kwasu octowego w łagodnych warunkach w drodze kondensacji Knoevenagela, po której następuje dekarboksylacja. Jako przykład można podać preparatykę kwasu cynamonowego wykorzystywanego do produkcji niesteroidowego leku przeciwzapalnego – acemetacyny. Substancję aromatyczną γ-nonanolakton można także wytworzyć w kondensacji Knoevenagela z kwasu malonowego i heptanalu (heptanaldehyd), a następnie domknięcia pierścienia[8].
Jego ester dietylowy jest wykorzystywany w syntezie organicznej[1].
Warto wspomnieć, że kwas malonowy jest jednym ze składników służących do przeprowadzenia widowiskowej reakcji chemicznej z oscylacjami stężenia składników (reakcja Biełousowa-Żabotyńskiego)[9]
Przypisy
- ↑ a b c d Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 212, ISBN 83-7183-240-0.
- ↑ a b c d e CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 3-340, 5-93, ISBN 978-1-4987-5429-3 (ang.).
- ↑ Malonic acid, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2021-04-14] (ang.).
- ↑ a b c Kwas malonowy, karta charakterystyki produktu Sigma-Aldrich, Merck KGaA, numer katalogowy: M1296 [dostęp 2021-04-14]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Nathan Weiner, Malonic Acid, „Organic Syntheses”, 18 (50), 1938, s. 376, DOI: 10.15227/orgsyn.018.0050 (ang.).
- ↑ Andrzej Witkowski, Jennifer Thweatt, Stuart Smith, Mammalian ACSF3 Protein Is a Malonyl-CoA Synthetase That Supplies the Chain Extender Units for Mitochondrial Fatty Acid Synthesis, „Journal of Biological Chemistry”, 286 (39), 2011, s. 33729–33736, DOI: 10.1074/jbc.M111.291591, PMID: 21846720, PMCID: PMC3190830 (ang.).
- ↑ Monique G.M. de Sain-van der Velden i inni, A New Approach for Fast Metabolic Diagnostics in CMAMMA, t. 30, Berlin, Heidelberg: Springer Berlin Heidelberg, 2016, s. 15–22, DOI: 10.1007/8904_2016_531, ISBN 978-3-662-53680-3, PMID: 26915364, PMCID: PMC5110436 (ang.).
- ↑ a b Harald Strittmatter, Stefan Hildbrand, Peter Pollak, Malonic Acid and Derivatives, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2007, DOI: 10.1002/14356007.a16_063.pub2 (ang.).[potrzebny numer strony]
- ↑ Marek Orlik, Reakcje oscylacyjne. Porządek i chaos, Wydawnictwa Naukowo-Techniczne, 1996.[potrzebny numer strony]
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Structure of Malonic acid
Synthesis of en:malonic acid. Nathan Weiner. "Malonic acid". Org. Synth.; Coll. Vol. 2: 376.