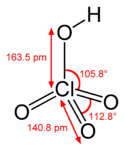
Kwas nadchlorowy
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||
| Wzór sumaryczny | HClO4 | ||||||||||||||||||||||
| Inne wzory | HOClO3 | ||||||||||||||||||||||
| Masa molowa | 100,46 g/mol | ||||||||||||||||||||||
| Wygląd | przezroczysta, bezbarwna ciecz[1] | ||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||
| Numer CAS | 7601-90-3 | ||||||||||||||||||||||
| PubChem | 24247 | ||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| |||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||
| Inne aniony | kwas nadbromowy, kwas nadjodowy | ||||||||||||||||||||||
| Podobne związki | kwas podchlorawy, kwas chlorawy, kwas chlorowy | ||||||||||||||||||||||
| Pochodne sole | nadchloran amonu, nadchloran potasu, nadchloran sodu | ||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||
Kwas nadchlorowy, nazwa Stocka: kwas chlorowy(VII), HClO
4 – nieorganiczny związek chemiczny, jeden z najsilniejszych kwasów tlenowych. Chlor znajduje się w nim na VII stopniu utlenienia; jest to najtrwalszy kwas tlenowy tego pierwiastka[2]. Jego bezwodnikiem jest tlenek chloru(VII), Cl
2O
7.
Otrzymywanie
Rozcieńczony kwas nadchlorowy można otrzymać przez działanie stężonym kwasem siarkowym na nadchlorany[2], na przykład nadchloran sodu:
- NaClO
4 + H
2SO
4 → NaHSO
4 + HClO
4
Właściwości
Kwas nadchlorowy to oleista, bezbarwna i bezwonna ciecz, której gęstość w warunkach normalnych wynosi 1,76 g/cm³. Miesza się on z wodą bez ograniczeń tworząc z nią azeotrop o temperaturze topnienia −18 °C i temperaturze wrzenia 200 °C (zawartość HClO
4 w azeotropie to ok. 72,5%). Czysty kwas topi się w −112 °C i rozkłada się w 150 °C przed osiągnięciem temperatury wrzenia. Łatwo ulega wybuchowemu rozkładowi już w niższych temperaturach w obecności śladów substancji organicznych i większości metali. Stężony kwas nadchlorowy jest silnie higroskopijny.
Kwas nadchlorowy jest silnym utleniaczem. Należy on do najsilniejszych znanych kwasów (jest zaliczany do tzw. superkwasów) i jako taki jest substancją silnie żrącą. Jego pKa szacuje się jako −7.
Sole kwasu nadchlorowego to nadchlorany. Z wyjątkiem nadchloranów potasu, rubidu, cezu i amonu są one bardzo dobrze rozpuszczalne w wodzie.
Zastosowanie
Niewielką rozpuszczalność nadchloranu potasu wykorzystuje się w chemii analitycznej, wytrącając potas kwasem nadchlorowym w postaci trudno rozpuszczalnego związku. Ponadto kwas nadchlorowy jest używany w analizie chemicznej do usuwania materiałów pochodzenia organicznego np. z próbek przeznaczonych do analizy zawartości metali ciężkich. Spośród soli tego kwasu największe zastosowanie mają nadchloran amonu i nadchloran magnezu.
Handlowo dostępny kwas nadchlorowy ma stężenie 60–70%.
Przypisy
- ↑ a b c Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b c d Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 210, ISBN 83-7183-240-0.
Bibliografia
- Adam Bielański, Podstawy chemii nieorganicznej, t. 2, Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 574–578, ISBN 83-01-13817-3.
| ||||||||||||||||||||||||||||||||
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances