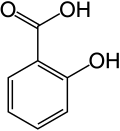
Kwas salicylowy
| |||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C7H6O3 | ||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | C | ||||||||||||||||||||||||||||||||||||||
| Masa molowa | 138,12 g/mol | ||||||||||||||||||||||||||||||||||||||
| Wygląd | biały lub prawie biały, krystaliczny proszek albo białe lub bezbarwne, igiełkowate kryształy[1] | ||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||
| Pochodne | kwas acetylosalicylowy, kwas p-aminosalicylowy, kwas gentyzynowy, sulfasalazyna | ||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
Kwas salicylowy (łac. acidum salicylicum) – organiczny związek chemiczny z grupy aromatycznych hydroksykwasów karboksylowych. Zawiera jedną grupę hydroksylową i jedną grupę karboksylową przyłączone do pierścienia benzenowego w układzie orto.
Otrzymywanie

Kwas salicylowy po raz pierwszy został otrzymany przez wyodrębnienie go z kory wierzby (łac. Salix, stąd nazwa). Metoda syntezy chemicznej została wynaleziona przypadkowo przez niemieckiego chemika, Hermanna Kolbego[10]. W 1859 roku rozpoczął on poszukiwania sposobu taniej, chemicznej syntezy indyga (barwnika). Otrzymany ze smoły pogazowej fenol umieścił w zamkniętym naczyniu z dwutlenkiem węgla i mieszaninę tę ogrzewał. W wyniku tej reakcji, zamiast oczekiwanego granatowego barwnika otrzymał kwas salicylowy:
Doświadczenie to było jednym z pierwszych dowodów obalających hipotezę istnienia siły życiowej, dowodziło bowiem możliwości otrzymania ze składników mineralnych (za takie był wtedy uważany fenol i CO
2) związku organicznego. Odkrycie Kolbego uważa się również za początek chemicznego przemysłu farmaceutycznego, gdyż kwas salicylowy był pierwszym lekiem wytwarzanym na skalę przemysłową na drodze syntezy chemicznej.
Dziś reakcję tę nazywa się reakcją Kolbego. Przebiega ona pod zwiększonym ciśnieniem w temperaturze 130 °C[11].
Właściwości
Występuje w postaci białego, krystalicznego proszku lub bezbarwnych igiełek o gęstości 1,443 g/cm³. Słabo rozpuszcza się w wodzie (w temp. 20 °C – 0,18 g na 100 cm³ H
2O, w 100 °C – 7 g na 100 cm³; roztwór ma umiarkowanie kwasowy odczyn), bardzo dobrze w etanolu. Działa drażniąco na skórę i oczy. W dużych ilościach może być toksyczny (dawka śmiertelna dla szczura wynosi ok. 1 g/kg masy ciała). Kwas salicylowy ma również zdolność do tworzenia wewnątrzcząsteczkowych wiązań wodorowych, co zwiększa jego lotność z parą wodną i łatwość sublimacji.
Zastosowanie
Najistotniejszym zastosowaniem kwasu salicylowego jest produkcja kwasu acetylosalicylowego (aspiryny) i kwasu p-aminosalicylowego[11]. Samego kwasu salicylowego używa się w medycynie jako środka dezynfekującego (np. w postaci spirytusu salicylowego[11]) i keratolicznego (np. w lekach na trądzik). Mieszanina kwasu mlekowego (10%) i kwasu salicylowego (90%) jest używana do wypalania brodawek. Istotne znaczenie w medycynie mają też sole kwasu salicylowego – salicylany. Kwas ten był używany dawniej jako konserwant żywności[11], jednak ze względu na toksyczne działanie w większych stężeniach zastąpiony został obecnie przez benzoesan sodu i azotan potasu.
Z jonami żelaza tworzy fioletowo zabarwiony kompleks, co wykorzystać można jako atrament sympatyczny.
Hormon roślinny
Kwas salicylowy jest naturalnym regulatorem wzrostu i rozwoju roślin wpływającym na proces fotosyntezy, transpirację, pobieranie i transport jonów. Indukuje zmiany w anatomii liści i strukturze chloroplastów. Bierze udział w endogennym przenoszeniu sygnałów, pośrednicząc w obronie przed patogenami[12]. Odgrywa ważną rolę w reakcji odpornościowej roślin przejawiającą się produkcją białek związanych z patogenezą. Kwas salicylowy jest elementem nabytej odporności systemicznej, który umożliwia reakcję odpornościową w części rośliny innej niż ta zaatakowana przez patogen[13]. Sygnał może być przesyłany także poza organizmem roślinnym w postaci lotnego estru, salicylanu metylu[14].
Przypisy
- ↑ a b c d Farmakopea Polska IX, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2011, s. 4574, ISBN 978-83-88157-77-6.
- ↑ Henri A. Favre, Warren H. Powell, Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Names 2013 (Blue Book), Royal Society of Chemistry, International Union of Pure and Applied Chemistry, 2014, s. 64, DOI: 10.1039/9781849733069, ISBN 978-0-85404-182-4 (ang.).
- ↑ Farmakopea Polska VI, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2002, s. 1176, ISBN 83-88157-18-3.
- ↑ a b c d e f Haynes 2014 ↓, s. 3-306.
- ↑ Haynes 2014 ↓, s. 5-198.
- ↑ Jerzy Minczewski, Zygmunt Marczenko: Chemia analityczna. T. 1: Podstawy teoretyczne i analiza jakościowa. Warszawa: Wydawnictwo Naukowe PWN, 2001, s. 55. ISBN 83-01-13499-2.
- ↑ a b c Haynes 2014 ↓, s. 16-26.
- ↑ Kwas salicylowy (nr 247588) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2016-03-31]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Kwas salicylowy (nr 247588) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2016-03-31]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Hermann Kolbe. Ueber Synthese der Salicylsäure. „Annalen der Chemie und Pharmacie”. 113 (1), s. 125–127, 1860. DOI: 10.1002/jlac.18601130120.
- ↑ a b c d Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 214–215, ISBN 83-7183-240-0.
- ↑ S. Hayat, A. Ahmad: Salicylic acid – A Plant Hormone. 2007. ISBN 1-4020-5183-2.
- ↑ R.A.M.H. van Huijsduijnen, S.W. Alblas, R.H. de Rijk, J.F. Bol. Induction by Salicylic Acid of Pathogenesis-related Proteins and Resistance to Alfalfa Mosaic Virus Infection in Various Plant Species. „Journal of General Virology”. 67 (10), s. 2135–2143, 1986. DOI: 10.1099/0022-1317-67-10-2135.
- ↑ Lincoln Taiz, Eduardo Zeiger: Plant Physiology. 2002, s. 306. ISBN 0-87893-823-0.
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, ISBN 978-1-4822-0867-2 (ang.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Reaktionsgleichung
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Ball-and-stick model of the salicylic acid molecule.
Structure calculated in Spartan '04 Student Edition. Image generated in Accelrys DS Visualizer.
Calculated structure is essentially the same as the one found experimentally in Acta Cryst. (1965). 18, 1053-1058.