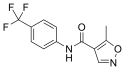
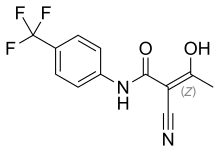Leflunomid
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny | C12H9F3N2O3 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 270,207 g/mol | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | |||||||||||||||||||
| PubChem | |||||||||||||||||||
| DrugBank | |||||||||||||||||||
| |||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||
| ATC | |||||||||||||||||||
| Stosowanie w ciąży | kategoria X (przeciwwskazane) | ||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
Leflunomid (łac. Leflunomidum) – wielofunkcyjny organiczny związek chemiczny. Jest prolekiem o działaniu immunosupresyjnym (jego aktywnym metabolitem jest teryflunomid[1]). Wykazuje właściwości antyproliferacyjne względem limfocytów T i przeciwzapalne. Jest stosowany w reumatoidalnym zapaleniu stawów oraz łuszczycowym zapaleniu stawów u dorosłych[2], w celu spowolnienia postępu choroby. Należy do grupy wolno działających leków przeciwreumatycznych, modyfikujących przebieg choroby (DMARD, z ang. disease modifying antirheumatic drugs).
Leflunomid jest produkowany przez Sanofi-Aventis pod nazwą Arava. W handlu znajduje się od 1998; został zarejestrowany przez FDA, a także w Kanadzie. W Europie został dopuszczony do użytku we wszystkich krajach Unii Europejskiej 2 września 1999 przez Europejską Agencję Leków. W raporcie EMEA/H/C/235 oceniono, że korzyści dla pacjentów ze stosowania leflunomidu przewyższają ryzyko działań niepożądanych. Obecnie na rynku farmaceutycznym dostępne są także generyczne postacie leku[2][3], np. Leflunomide Winthrop (zarejestrowany 22 października 2009) i Leflunomide medac GmbH (dopuszczony do użytku 20 maja 2010).
Leflunomid jest lekiem do podawania doustnego. Dostępny w postaci tabletek powlekanych, które zawierają odpowiednio 10, 20 i 100 mg substancji czynnej w jednej tabletce. Leczenie leflunomidem rozpoczyna się, dopiero gdy inne leki przeciwreumatyczne nie przyniosły oczekiwanego rezultatu, lub ich dalszego podawania zaprzestano ze względu na wystąpienie ciężkich objawów niepożądanych oraz po dokonaniu analizy zysków i strat dla indywidualnego pacjenta. Leflunomid jest dostępny wyłącznie na receptę lekarską, a terapia nim powinna być zapoczątkowywana i później nadzorowana przez doświadczonego reumatologa[2].
Podczas stosowania leflunomidu należy regularnie wykonywać rozmaz krwi, kontrolować czynność wątroby – ALAT oraz dokonywać pomiaru ciśnienia krwi. Zalecana jest duża ostrożność w przypadku zmiany dotychczasowej terapii pacjenta na leflunomid oraz w przypadku odwrotnym, czyli zastępowania leflunomidu innym lekiem.
Mechanizm działania
Leflunomid należy do grupy prekursorów leków. Dopiero in vivo ulega przemianie do aktywnego terapeutycznie metabolitu A771726, którego mechanizm działania polega na inhibicji występującego u ludzi w mitochondriach enzymu – dehydrogenazy dihydroorotanowej (DHODH) – niezbędnego do proliferacji limfocytów T[4]. Metabolit leflunomidu posiada także zdolność blokowania kinazy białkowej – tyrozynowej oraz cyklooksygenazy-2 (COX-2), in vivo i in vitro[5]. A771726 oddziałuje głównie na limfocyty T poprzez zahamowanie reakcji biosyntezy pirymidyny i fosforylacji tyrozyny[6].
Zahamowanie podziałów komórkowych limfocytów T jest wykorzystywane w leczeniu chorób o podłożu autoimmunologicznym, np. reumatoidalnego zapalenia stawów, gdyż zmniejszenie ilości limfocytów T oznacza zmniejszenie stanu zapalnego, a tym samym złagodzenie przebiegu choroby[7] i[8]. Obok własności antyproliferacyjnych względem limfocytów T, leflunomid zmniejsza odporność immunologiczną organizmu i działa przeciwzapalnie.
Leflunomid nie wpływa bezpośrednio na zmniejszenie bólów reumatycznych, ani nie powoduje wyleczenia pacjenta z choroby reumatycznej, ale zmniejszając odporność oraz działając przeciwzapalnie, hamuje dalsze postępowanie choroby, sprawia że choroba ma łagodniejszy przebieg i po pewnym czasie dochodzi do zmniejszenia bólu, sztywności i obrzęku stawów.
Leflunomid, podobnie jak inne leki z grupy DMARD, nie działa natychmiast. Efekt terapeutyczny pojawia się dopiero po upływie 4 – 6 tygodni i wzrasta w przeciągu kolejnych 2 – 6 miesięcy.
W doświadczeniach przeprowadzonych na zwierzętach leflunomid wykazał także działanie przeciwko innym chorobom o podłożu autoimmunologicznym oraz w przypadkach transplantacji.
Farmakokinetyka
- Resorpcja z przewodu pokarmowego – dobra (82-95%), wartości absorpcji porównywalne na czczo i po posiłku
- Metabolizowanie – szybkie, w ścianie jelit oraz wątrobie do aktywnego metabolitu A771726 (w efekcie pierwszego przejścia) oraz innych, mniej ważnych metabolitów, m.in. TFMA (4-trifluoromethylaniline) pod wpływem wielu enzymów, w tym CYP
- Wiązanie z białkami osocza aktywnego metabolitu – praktycznie całkowite z albuminą; frakcja niezwiązana A771726 wynosi 0,62%; istnieje możliwość interakcji z innymi lekami silnie wiążącymi się z białkami osocza
- Tmax – bardzo zróżnicowany (od 1 – 24 godzin po jednorazowej dawce)
- Stan równowagi stężenia (steady state) – osiągany po 3 dniach przy podawaniu 100 mg/24 godziny; wynosi 35 μg A771726 na ml osocza przy dawkowaniu 20 mg/dobę
- Efekt terapeutyczny – wykazuje ścisłą zależność od stężenia aktywnego metabolitu w osoczu i dziennej dawki leflunomidu
- T½ el aktywnego metabolitu A771726 – około 2 tygodni
- Eliminacja – powolna, wraz z kałem (postać niezmieniona metabolitu A771726) i moczem (w postaci glukuronianów i połączeń z kwasem oksanylowym)
- Dane farmakokinetyczne dla osób poniżej 18 roku życia – nie ustalono, trwają badania kliniczne w tym kierunku[9]
- Dane farmakokinetyczne dla osób powyżej 65 roku życia – ograniczone, pokrywają się z danymi dla młodych dorosłych osób
Wskazania do stosowania
Leflunomid został zarejestrowany do użytku we wszystkich krajach Unii Europejskiej 2 września 1999 przez Europejską Agencję Leków, do leczenia osób dorosłych, u których stwierdzono:
- aktywne reumatoidalne zapalenie stawów
- aktywne łuszczycowe zapalenie stawów
w postaci od średnio do ciężko zaawansowanej.
Nie zaleca się stosowania leku u osób poniżej 18 roku życia cierpiących na młodzieńcze idiopatyczne zapalenie stawów[9].
2 września 2004 EMEA przedłużyła rejestrację leflunomidu dopuszczającą go do stosowania u ludzi.
Leflunomid powinien być zapisywany jedynie przez specjalistę – reumatologa. Zaleca się stosowanie Leflunomidu, dopiero gdy inne leki pierwszego wyboru z grupy DMARD (sulfasalazyna i metotreksat) nie przyniosły oczekiwanego rezultatu lub zaprzestano ich podawania ze względu na silne objawy niepożądane. Przy podejmowaniu decyzji o podjęciu leczenia Leflunomidem należy wziąć pod rozwagę długi okres półtrwania, ryzyko niebezpiecznych działań ubocznych oraz konieczność usunięcia z organizmu pacjenta poprzedniego leku z grupy DMARD i ewentualnie innych leków o działaniu hepatotoksycznym (szkodliwym dla komórek wątroby) i hemotoksycznym (szkodliwym dla krwinek), tzw. procedura wash out. Zobacz też: Interakcje.
Przeciwwskazania
Leflunomidu nie wolno podawać pacjentom, u których wystąpiła reakcja alergiczna na składnik czynny (w szczególności jedna z postaci rumienia wielopostaciowego) lub jakikolwiek składnik pomocniczy występujący w tabletkach.
Nie zaleca się jednoczesnego stosowania innych leków hepatotoksycznych (mających działanie trujące na komórki miąższu wątroby) lub hemotoksycznych (wywołujących nieprawidłowości w obrazie krwi), np. metotreksatu.
Podczas kuracji leflunomidem pacjenci powinni unikać spożywania napojów alkoholowych ze względu na zwiększenie działania toksycznego na wątrobę.
Przeciwwskazania do podawania leflunomidu obejmują:
- zaburzenia czynności i niewydolność wątroby
- ciężką hipoproteinemię (znaczne obniżenie stężenia białka we krwi, np. z powodu chorób nerek)
- W obu powyższych przypadkach dochodzi do zwiększenia stężenia aktywnego metabolitu A771726 w osoczu pacjenta.
- współistnienie chorób zmniejszających odporność organizmu, np. AIDS
- zmniejszenie czynności szpiku
- występowanie znacznej anemii, leukopenii, neutropenii i trombocytopenii
- umiarkowane do ciężkie zaburzenia czynności nerek
- zakażenia bakteryjne, grzybicze, wirusowe, np. zapalenie płuc, aktywna gruźlica
- ciążę i okres karmienia piersią (Zobacz też: Ciąża i karmienie)
- niestosowanie skutecznych środków antykoncepcyjnych przez kobiety w wieku rozrodczym
- niestosowanie skutecznych metod antykoncepcji przez mężczyzn współżyjących z partnerkami w wieku rozrodczym
- wiek poniżej 18 lat ze względu na niewystarczającą ilość danych dotyczących efektywności oraz bezpieczeństwa dla tej grupy wiekowej
Działania niepożądane
Często występujące działania niepożądane leflunomidu, czyli dotyczące 1-10% pacjentów, obejmują m.in.
- zmniejszenie liczby białych krwinek – leukopenię – ilość leukocytów > 2 g/l
- łagodne reakcje alergiczne, np. wysypka, rumień i świąd skóry
- utratę łaknienia i zmniejszenie masy ciała – zwykle nieznaczne
- bóle i zawroty głowy, astenię, nietypowe wrażenia czuciowe, tj. mrowienie – parestezje
- podwyższenie ciśnienia tętniczego, z reguły łagodne
- biegunkę, nudności, wymioty, anoreksję, bóle jamy brzusznej, choroby śluzówki jamy ustnej, np. zapalenie jamy ustnej, owrzodzenie jamy ustnej
- wzrost niektórych parametrów czynności wątroby (szczególnie ALATu, a także w mniejszym stopniu alkalicznej fosfatazy i bilirubiny) w badaniu laboratoryjnym krwi
- zwiększone wypadanie włosów, egzemę i suchość skóry
- tenosynovitis – zapalenie pochewek ścięgien
- osłabienie
- astma oskrzelowa, duszność, krwawienie z nosa (u 1 do < 3% pacjentów)
Czasami obserwuje się u 0,1-1% pacjentów przyjmujących leflunomid następujące objawy niepożądane:
- hipokaliemię – obniżenie stężenia jonów potasu we krwi
- zaburzenia smaku
- lęk
- pokrzywkę
- anemię
- łagodną trombocytopenię.
Rzadko, czyli u 0,01-0,1% pacjentów, zanotowano objawy uboczne tj. zapalenie wątroby, żółtaczkę, rozerwane ścięgna, eozynofilię, leukopenię (leukocyty < 2 g/l), pancytopenię oraz śródmiąższowe choroby płuc (obejmujące także śródmiąższowe zapalenie płuc i zwłóknienie płuc), które czasami mogą prowadzić do zejścia śmiertelnego.
Bardzo rzadko, czyli u 0,01% pacjentów lub mniej, zarejestrowano przypadki poważnego uszkodzenia wątroby z możliwością zejścia śmiertelnego, rumień wielopostaciowy, reakcje anafilaktyczne i agranulocytozę.
Aktywny metabolit leflunomidu charakteryzuje się bardzo długim okresem półtrwania, który wynosi od 1 do 4 tygodni, w związku z tym działania niepożądane, np. uszkodzenie wątroby, reakcje alergiczne, zmiany w obrazie krwi, mogą pojawić się nawet po zakończeniu kuracji.
Hepatotoksyczne działania niepożądane
Rzadkie przypadki uszkodzenia wątroby obejmowały stan zapalny wątroby i żółtaczkę oraz bardzo rzadko niewydolność wątroby i martwicę wątroby z możliwością zejścia śmiertelnego. Większość przypadków uszkodzenia wątroby wystąpiła w pierwszych 6 miesiącach kuracji leflunomidem. W wielu przypadkach rolę odegrały także dodatkowe czynniki, tj. jednoczesne stosowanie innych leków hepatotoksycznych, np. metotreksatu oraz występowanie innych jednostek chorobowych, tym niemniej związek przyczynowy z leflunomidem nie został wykluczony. W porozumieniu z Europejską Agencją Leków został odpowiednio rozszerzony tekst w ulotce informacyjnej oraz wprowadzono zalecenie kontrolowania enzymów wątrobowych (ALAT), a także poinformowano o przeciwwskazaniu do stosowania leflunomidu w przypadku współistniejącej niewydolności wątroby oraz przeciwwskazaniu do jednoczesnego stosowania leflunomidu razem z innymi lekami hepatotoksycznymi, w tym z metotreksatem.
Enzymy wątrobowe należy skontrolować przed rozpoczęciem leczenia leflunomidem, a następnie badanie kontrolne należy wykonywać raz na miesiąc lub częściej przez pierwsze 6 miesięcy, później co 8 tygodni. W przypadku dwu- do trzykrotnie podniesionych wartości ALAT w stosunku do wartości prawidłowych, zalecane jest zmniejszenie dawki do 10 mg/dobę i cotygodniowe kontrolowanie enzymów wątrobowych. Jeżeli dwukrotnie wyższe wartości ALAT utrzymują się lub wystąpią wartości trzykrotnie wyższe w porównaniu do wartości prawidłowych, to należy zaprzestać podawania leflunomidu i rozpocząć procedurę wash out[10].
Hemotoksyczne działania niepożądane
Przed rozpoczęciem leczenia leflunomidem wykonuje się kontrolne badanie laboratoryjne całkowitego obrazu krwi (w tym leukocytów, ich różnicowania oraz trombocytów). Badanie powtarza się co 2 tygodnie przez pierwsze 6 miesięcy, a następnie co 8 tygodni. U pacjentów, u których wcześniej wystąpiła anemia, leukopenia, trombocytopenia lub osłabienie funkcji szpiku, występuje zwiększone ryzyko pojawienia się niepożądanych działań hemotoksycznych podczas zażywania leflunomidu. Również wcześniejsze, jednoczesne lub późniejsze podawanie pacjentowi innych leków działających toksycznie na szpik kostny, zwiększa ryzyko wystąpienia niepożądanych działań hemotoksycznych. W przypadku poważnych zmian hematologicznych, np. pancytopenii, leczenie leflunomidem oraz ewentualnie innymi lekami osłabiającymi funkcję szpiku kostnego, przerywa się i stosuje procedurę wash out w celu szybkiego wyeliminowania aktywnego metabolitu z organizmu.
Skórne działania niepożądane
W przypadku niepożądanych reakcji dotyczących skóry lub śluzówki, które mogą wskazywać na rozwój wrzodziejącego zapalenia jamy ustnej lub rumienia wielopostaciowego, leczenie leflunomidem oraz ewentualnie innymi lekami, które mogą dawać podobne objawy uboczne, natychmiast przerywa się i stosuje procedurę wash out. Pacjentom, u których podczas stosowania leflunomidu wystąpiło wrzodziejące zapalenie jamy ustnej lub jedna z postaci rumienia wielopostaciowego, nie wolno ponownie podawać leflunomidu.
Obniżenie odporności
Ze względu na działanie antyproliferacyjne pacjenci leczeni leflunomidem mają zmniejszoną odporność immunologiczną, są bardziej podatni na infekcje bakteryjne, grzybicze oraz wirusowe, a jeżeli dojdzie do zakażenia, to ma ono cięższy przebieg. W przypadku poważnych zakażeń, trudnych do opanowania, może okazać się konieczne zaprzestanie podawania leflunomidu i wszczęcie procedury wash out. Należy zwrócić uwagę na możliwość reaktywowania tuberkulozy.
Śródmiąższowe choroby płuc
Na całym świecie zanotowano u pacjentów przyjmujących tabletki leflunomidu rzadkie przypadki (< 0,1%) nagłego pojawienia się śródmiąższowej choroby płuc z możliwością zejścia śmiertelnego, np. 29 przypadków w Japonii na 3658 osób, z czego 11 zakończonych zgonem. W powstaniu śródmiąższowej choroby płuc często rolę odegrały także inne czynniki, tj. uprzednio istniejące choroby płuc oraz wcześniejsze lub jednoczesne podawanie innego leku z grupy DMARD (np. metotreksatu), który również może być odpowiedzialny za wywołanie śródmiąższowej choroby płuc. Należy zaznaczyć, że u około 40 – 50% pacjentów z reumatoidalnym zapaleniem stawów rozwija się śródmiąższowa choroba płuc, bez względu na zastosowany lek[11]. Śródmiąższowa choroba płuc (w tym także śródmiąższowe zapalenie płuc i zwłóknienie płuc) może rozwinąć się w dowolnym momencie terapii leflunomidem, charakteryzuje się zróżnicowaną etiologią i postacią kliniczną, często fatalnym rokowaniem dla pacjenta, lecz według badań epidemiologicznych nie dotyczy częściej pacjentów leczonych leflunomidem w porównaniu z pacjentami leczonymi innym lekiem z grupy DMARD. Pacjenci, u których wystąpiły trudności z oddychaniem, duszność lub kaszel z towarzyszącą gorączką lub bez podniesienia temperatury ciała, albo uległy pogorszeniu dotychczasowe dolegliwości ze strony układu oddechowego, powinni jak najszybciej skontaktować się z lekarzem. Jeżeli zachodzi konieczność przerwania terapii leflunomidem z powodu niepokojących objawów płucnych, to stosuje się procedurę wash out.
Ze względu na możliwość wystąpienia tego rzadkiego objawu niepożądanego, pacjenci z aktualnie lub w przeszłości współistniejącą chorobą układu oddechowego, a także pacjenci leczeni niedawno innymi lekami, które mogą wywoływać śródmiąższowe choroby płuc, muszą zostać poddani kontrolnemu badaniu układu oddechowego przed rozpoczęciem kuracji leflunomidem oraz powinni pozostawać pod ścisłą kontrolą pulmonologiczną podczas jej kontynuowania[12].
Nadciśnienie
U 1-10% pacjentów przyjmujących tabletki leflunomidu obserwuje się podwyższenie ciśnienia tętniczego krwi, z reguły łagodne. W związku z tym, przed rozpoczęciem leczenia oraz regularnie podczas stosowania leflunomidu należy dokonywać pomiaru ciśnienia krwi.
Wpływ na prowadzenie pojazdów
Pacjent powinien wziąć pod rozwagę, że pojawienie się niektórych działań ubocznych leflunomidu, np. zawrotów głowy i osłabienia, może wywierać negatywny wpływ na zdolność do prowadzenia pojazdów mechanicznych i obsługiwania maszyn, itp. W przypadku zmniejszenia koncentracji i szybkości reagowania nie należy prowadzić samochodu, ani obsługiwać maszyn, itp.
Ciąża i karmienie piersią
Kobietom w ciąży nie wolno przyjmować leflunomidu. Przed rozpoczęciem leczenia kobieta musi być pewna, że nie jest w ciąży, a lekarz powinien potwierdzić to wynikiem badania laboratoryjnego.
Kobiety w wieku rozrodczym oraz mężczyźni współżyjący z partnerkami w wieku rozrodczym nie mogą przyjmować leflunomidu bez stosowania skutecznej metody antykoncepcji, np. hormonalnych tabletek antykoncepcyjnych w przypadku kobiet oraz prezerwatyw w przypadku mężczyzn, lub lepiej obu metod jednocześnie, podczas całego okresu terapii leflunomidem i do 2 lat po jej zakończeniu.
Aktywny metabolit leflunomidu okazał się teratogenny i embriotoksyczny w doświadczeniach przeprowadzonych na zwierzętach (szczurach i królikach) i może prowadzić u płodu ludzkiego do wystąpienia ciężkich deformacji i wad rozwojowych. Leflunomid uszkadza także ludzkie plemniki.
Kobiety w wieku rozrodczym oraz mężczyźni pragnący zostać ojcami muszą zostać poinformowani przez lekarza, że po zakończeniu leczenia leflunomidem konieczne jest odczekanie 2 lat. Po tym okresie, a przed podjęciem koncepcji, należy jeszcze potwierdzić dwukrotnym oznaczeniem, w odstępie przynajmniej 14 dni, stężenie aktywnego metabolitu w osoczu poniżej 0,02 mg/l, które przyjmuje się za bezpieczne. Czas oczekiwania można skrócić pod pewnymi warunkami, poprzez zastosowanie procedury wash out przy użyciu cholestyraminy lub węgla aktywnego. Jeżeli po przeprowadzeniu procedury wash out oraz przynajmniej w 14 dni po jej zakończeniu, stężenie aktywnego metabolitu w osoczu jest niższe od 0,02 mg/l oraz po odczekaniu przynajmniej 3 miesięcy od drugiego badania laboratoryjnego, przyjmuje się, że ryzyko toksycznego uszkodzenia płodu w przypadku ciąży lub ojcostwa jest bardzo niskie.
Nie wolno stosować leflunomidu w czasie karmienia piersią, albowiem leflunomid i jego metabolity przenikają do mleka matki.
Interakcje
- U pacjentów, którzy byli leczeni, niedługi okres przed zastosowaniem leflunomidu, innymi lekami o niepożądanych działaniach hepatotoksycznych lub hemotoksycznych, występuje zwiększone ryzyko pojawienia się działań ubocznych.
- Jednoczesne podawanie leflunomidu i innego leku wykazującego niepożądane działanie toksyczne na miąższ wątroby lub szpik kostny zwiększa ryzyko wystąpienia działań ubocznych.
- Zastosowanie u pacjenta po zakończeniu terapii leflunomidem, ale bez przeprowadzenia procedury wash out, innych leków toksycznych dla wątroby lub szpiku, zwiększa ryzyko wystąpienia objawów niepożądanych. W związku z powyższym przy zmianie terapii na inny DMARD, np. metotreksat, należy najpierw usunąć aktywny metabolit leflunomidu z organizmu pacjenta, poprzez zastosowanie procedury wash out.
- Nie zaleca się podawania innego leku z grupy DMARD, np. metotreksatu, w kombinacji z leflunomidem, ze względu na dodawanie się i wzajemne potęgowanie ubocznych efektów hemotoksycznych i hepatotoksycznych.
- Nie zaleca się łączenia leflunomidu z lekami przeciwmalarycznymi tj. chlorochina i hydroksychlorochina, stosowanymi w leczeniu chorób reumatycznych.
- Nie zaleca się stosowania leflunomidu z doustnymi lub domięśniowymi preparatami złota.
- Nie zaleca się łączenia leflunomidu z D-penicylaminą, azatiopryną i innymi lekami immunosupresyjnymi. Kombinacja leflunomidu z powyższymi lekami nie została jeszcze dokładnie przestudiowana w badaniach klinicznych. Nie określono możliwych efektów długoterminowych.
- Podczas kuracji leflunomidem nie należy podawać preparatów cholestyraminy i węgla aktywnego ze względu na znaczne zmniejszenie efektu terapeutycznego leflunomidu poprzez obniżenie stężenia aktywnego metabolitu A771726 w osoczu pacjenta. Ta interakcja została wykorzystana w procedurze wash out.
- Pacjent przyjmujący lek z grupy niesteroidowych leków przeciwzapalnych, tzw. NSAIDs lub niskie dawki kortykosteroidów, może kontynuować ich przyjmowanie, także po rozpoczęciu kuracji leflunomidem.
- Bardzo ostrożnie postępuje się w przypadku jednoczesnego stosowania leflunomidu z fenytoiną, warfaryną, tolbutamidem, ze względu na ich metabolizowanie przez CYP2C9, albowiem A771726 hamował in vitro aktywność CYP2C9 (interakcja nie dotyczyła NSAIDs). W praktyce lekarz najczęściej zmniejszy dotychczasową dawkę wymienionego leku i będzie uważnie obserwował pacjenta.
- Podanie jednorazowej dawki leflunomidu pacjentom przyjmującym ryfampicynę wywołało około 40% wzrost stężenia A771726 w osoczu. Mechanizm interakcji nie został wyjaśniony.
- Nie zaobserwowano interakcji pomiędzy leflunomidem i hormonalną tabletką antykoncepcyjną.
- Nie wolno podawać pacjentom szczepionek wykonanych z osłabionych, żywych mikroorganizmów podczas stosowania leflunomidu, a także po zakończeniu kuracji, dopóki w osoczu utrzymuje się wysokie stężenie aktywnego metabolitu. Efektywność i bezpieczeństwo stosowania szczepionek podczas kuracji leflunomidem nie zostały ustalone w badaniach klinicznych.
Pacjenci leczeni leflunomidem powinni zawsze informować o tym innych lekarzy ze względu na ryzyko wystąpienia groźnej interakcji pomiędzy leflunomidem a innym lekiem, zaś prowadzącego ich przypadek reumatologa informować o lekach przepisanych przez lekarza domowego lub innych specjalistów. Podczas zażywania tabletek leflunomidu oraz przez cały okres utrzymywania się w osoczu wysokiego stężenia aktywnego metabolitu A771726 (nawet do 2 lat od ostatniej dawki) pacjenci nie powinni stosować na własną rękę żadnych lekarstw, ostrzeżenie dotyczy także lekarstw dostępnych bez recepty.
Procedura wash out
Procedura wash out polega na podawaniu pacjentowi środka przyśpieszającego usunięcie leku z organizmu człowieka, po uprzednim zaprzestaniu leczenia. W przypadku leflunomidu można zastosować wash out przy użyciu cholestyraminy lub węgla aktywnego.
- Procedura wash out przy użyciu cholestyraminy – 3 x dziennie podaje się doustnie 8 g cholestyraminy, przez najczęściej 11 dni
- Procedura wash out przy użyciu węgla aktywnego – 4 x dziennie podaje się doustnie 50 g sproszkowanego węgla aktywnego w postaci zawiesiny, przez najczęściej 11 dni
Czas trwania procedury wash out dostosowuje się do wyników kontrolnych badań laboratoryjnych.
Mechanizm działania polega najprawdopodobniej na przerwaniu krążenia jelitowo-wątrobowego i dializie żołądkowo-jelitowej, w wyniku zaabsorbowania przez cholestyraminę/węgiel aktywny metabolitu leflunomidu i ostateczne usunięcie wraz z kałem. Efektywność przeprowadzonej procedury washout należy potwierdzić dwoma badaniami w odstępie przynajmniej 14 dni między jednym a drugim. Dąży się do otrzymania stężenia aktywnego metabolitu w osoczu mniejszego od 0,02 mg/l.
Kobiety w wieku rozrodczym muszą stosować podczas procedury wash out dodatkowe środki antykoncepcyjne, albowiem cholestyramina, jak i węgiel aktywny zmniejszają absorpcję żeńskich hormonów płciowych – estrogenów i progestagenów – zawartych w tabletkach antykoncepcyjnych, osłabiając ich skuteczność.
Wskazania do zastosowania procedury wash out:
- zamiana leflunomidu na inny lek z grupy DMARD
- wystąpienie poważnych działań niepożądanych (hepatotoksycznych, hemotoksycznych, infekcyjnych i skórnych)
- przedawkowanie leflunomidu
- zatrucie leflunomidem
- ciąża
- skrócenie dwuletniego okresu oczekiwania na samoistne usunięcie leflunomidu z organizmu w przypadku chęci zostania matką/ojcem.
Dawkowanie
Leflunomid jest podawany doustnie per os. Leczenie leflunomidem rozpoczyna się od 1 tabletki 100 mg raz na dobę, podawanej przez pierwsze trzy doby. Od czwartej doby podaje się dawki podtrzymujące:
- 10 lub 20 mg na dobę w leczeniu aktywnego reumatoidalnego zapalenia stawów, w zależności od ciężkości choroby
- 20 mg na dobę w leczeniu czynnej postaci łuszczycowego zapalenia stawów
Leflunomid można zażywać w czasie lub między posiłkami. Tabletkę należy połykać w całości, popijając dostateczną ilością płynu, najlepiej wody. Odczuwalna poprawa stanu zdrowia następuje po 4 – 6 tygodniach od rozpoczęcia leczenia. Przez następne miesiące terapii, do maksymalnie 6 miesięcy, następuje dalsze zmniejszanie się objawów chorobowych. Leflunomid przeznaczony jest do podawania przez długi czas (12 miesięcy i dłużej).
Przedawkowanie
Jeżeli pacjent zażył przez pomyłkę dwie tabletki, to najprawdopodobniej nie pociągnie to za sobą żadnych niepokojących konsekwencji. Pacjent, który zażył więcej tabletek musi skontaktować się z lekarzem i zasięgnąć porady medyczno-toksykologicznej. Przedawkowanie prowadzi, ogólnie rzecz biorąc, do wystąpienia objawów niepożądanych, charakterystycznych dla leflunomidu. W przypadku przedawkowania lekarz może rozważyć wszczęcie procedury wash out.
Zapomniana dawka
Zapomnianą dawkę leflunomidu pacjent powinien przyjąć, jak tylko zorientuje się o jej przeoczeniu, lecz nie powinien robić tego, gdy zbliża się już termin zażycia kolejnej dawki. Nie wolno w celu "wyrównania" przyjąć podwójnej dawki!
Postać leku
W handlu dostępny w postaci doustnych tabletek powlekanych, które zawierają odpowiednio 10, 20 lub 100 mg leflunomidu. Tabletki zawierające dawkę 10 mg leflunomidu są białe i okrągłe, podobnie jak tabletki 100 mg. Tabletki zawierające 20 mg leflunomidu są żółte i trójkątne.
Substancje pomocnicze zawarte w tabletkach obejmują: mąkę kukurydzianą, powidon, crospowidon, koloidalny dwutlenek krzemu, stearynian magnezu i uwodnioną laktozę. Składnikami otoczki tabletkowej są: talk, hypromeloza, dwutlenek tytanu i macrogol 8000.
Tabletki leflunomidu są pakowane w blistry lub flakony, zawierające po 30 lub 100 sztuk. Termin ważności wynosi 2 lata od daty produkcji podanej na opakowaniu.
Badania naukowe
- Ponad 50% pacjentów rezygnuje z terapii leflunomidem w ciągu roku od rozpoczęcia podawania leku głównie z powodu wystąpienia objawów niepożądanych[13]. Również wyniki badań uniwersytetu w Groningen z 2005 potwierdzają, że około 56% pacjentów rezygnuje z terapii leflunomidem przed upływem 12 miesięcy od jej rozpoczęcia, przede wszystkim ze względu na działania uboczne lub niską efektywność[14].
- Reasumując wyniki (obliczane według normy opracowanej przez American College of Rheumatology) 4 randomizowanych badań klinicznych, przeprowadzonych na ponad 2000 osób, w których porównano efektywność leflunomidu z placebo oraz sulfasalazyną i metotreksatem, Europejska Agencja Leków stwierdziła, że:
- leflunomid okazał się efektywniejszy niż placebo u chorych na reumatoidalne zapalenie stawów, ale tak samo efektywny jak sulfasalazyna; efektywność leflunomidu wynosiła 49 – 50% i utrzymywała się przez cały okres kontynuowania terapii; efektywność placebo wynosiła 26 – 28%, a sulfasalazyny 54%
- leflunomid był równie efektywny jak metotreksat (zażywany w połączeniu z kwasem foliowym), ale tylko w pierwszych 12 miesiącach stosowania, albowiem w przedłużonym okresie stosowania charakteryzował się mniejszą skutecznością niż metotreksat
- leflunomid wykazał większą efektywność niż placebo w przypadku chorych na łuszczycowe zapalenie stawów, albowiem 59% pacjentów zareagowało zmniejszeniem objawów chorobowych, w porównaniu do 30% pacjentów otrzymujących placebo (badanie dotyczyło 186 osób i trwało 6 miesięcy)[15].
Protest pacjentów
Public Citizen wystosował 28 marca 2002 petycję do FDA z żądaniem natychmiastowego usunięcia leflunomidu z lecznictwa. Od momentu pojawienia się Aravy® na rynku amerykańskim we wrześniu 1998 zanotowano 130 przypadków uszkodzenia wątroby, z których 56 wymagało leczenia szpitalnego, 12 osób zmarło, w tym 2 osoby dwudziestokilkuletnie. Producent leku Aventis w 2001 odnotował 225 milionów zysku ze światowej sprzedaży Aravy®. Według danych Public Citizen Arava® nie zmniejsza efektywniej objawów reumatoidalnego zapalenia stawów niż istniejące już leki, a jednocześnie wskaźnik zgonów w jej przypadku jest 33 razy wyższy w porównaniu do metotreksatu[16] i[17].
W listopadzie 2004 pracownik FDA David Graham podczas procesu sądowego związanego z lekiem o nazwie Vioxx domagał się dokładniejszej ewaluacji działań niepożądanych leków dopuszczanych do stosowania u ludzi; z 12 leków, które jego zdaniem powinny zostać usunięte z rynku, 2 w dalszym ciągu są stosowane, jednym z nich jest leflunomid[18].
Przypisy
- ↑ D. Magne, F. Mézin, G. Palmer, PA. Guerne. The active metabolite of leflunomide, A77 1726, increases proliferation of human synovial fibroblasts in presence of IL-1beta and TNF-alpha. „Inflamm Res”. 55 (11), s. 469-475, 2006. DOI: 10.1007/s00011-006-5196-x. PMID: 17122964.
- ↑ a b c emea.europa.eu Leflunomide medac (ang.)
- ↑ emea.europa.eu Leflunomide Winthrop (ang.)
- ↑ Purification of human dihydro-orotate dehydrogenase and its inhibition by A77 1726, the active metabolite of leflunomide
- ↑ Protein Synthesis, Modification & Degradation. [dostęp 2008-03-21]. [zarchiwizowane z tego adresu (2009-01-09)].
- ↑ The immunosuppressive metabolite of leflunomide, A77 1726, affects murine T cells through two biochemical mechanisms
- ↑ Dual Binding Mode of a Novel Series of DHODH Inhibitors
- ↑ DHODH dihydroorotate dehydrogenase
- ↑ a b emea.europa.eu Arava – Procedural steps taken and scientific information after the authorisation: The provided data do absolutely not support efficacy and safety in treatment of juvenile rheumatoid arthritis. Therefore Arava is not recommended for use in patients under 18 years (ang.)
- ↑ Brief aan reumatologen (nl). [dostęp 2008-03-16]. [zarchiwizowane z tego adresu (2008-10-19)].
- ↑ Zmiany śródmiąższowe w chorobach reumatycznych
- ↑ Arava® (leflunomide) and interstitial lung disease
- ↑ Therapeutic drug monitoring of A77 1726, the active metabolite of leflunomide: serum concentrations predict response to treatment in patients with rheumatoid arthritis (en)
- ↑ Succes leflunomide bij reuma deels te voorspellen (nl). [dostęp 2005-03-16]. [zarchiwizowane z tego adresu (2005-03-16)].
- ↑ Openbaar Beoordelingsrapport-Arava (nl). [dostęp 2008-03-24]. [zarchiwizowane z tego adresu (2007-07-30)].
- ↑ Public Citizen Petitions Ban of Arava. [dostęp 2008-03-24]. [zarchiwizowane z tego adresu (2008-02-23)].
- ↑ Public Citizen Calls on FDA to Ban Arthritis Drug
- ↑ Arava Safety News. [dostęp 2008-03-24]. [zarchiwizowane z tego adresu (2008-08-07)].
Bibliografia
- Farmacotherapeutisch Kompas dla lekarzy i farmaceutów (nl). fk.cvz.nl. [zarchiwizowane z tego adresu (2009-02-09)].
- College ter Beoordeling van Geneesmiddelen – Productinformacie Arava (nl). cbg-meb.nl. [zarchiwizowane z tego adresu (2008-04-05)].
- eFarma internetapotheek (nl)
Linki zewnętrzne
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Skeletal formula of leflunomide. Created using ACD/ChemSketch 12.0 and Inkscape. Optimized with vim.