Lewodopa
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
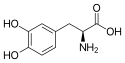
| Wzór sumaryczny | C9H11NO4 | ||||||||||||||||||||||||
| Masa molowa | 197,19 g/mol | ||||||||||||||||||||||||
| Wygląd | biały lub prawie biały, krystaliczny proszek[1] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | 59-92-7 | ||||||||||||||||||||||||
| PubChem | 6047 | ||||||||||||||||||||||||
| DrugBank | DB01235 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Podobne związki | dekstrodopa (D-DOPA), dopachinon, tyrozyna, dopamina | ||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||
| ATC | N04BA01, N04BA02, N04BA03 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Lewodopa (łac. levodopum), L-DOPA – organiczny związek chemiczny, naturalny aminokwas, enancjomer D o konfiguracji L (co odpowiada konfiguracji S w konwencji CIP), amina katecholowa. Powstaje w organizmie w wyniku hydroksylacji L-tyrozyny, podczas reakcji katalizowanej przez hydroksylazę tyrozynową. Będąc prekursorem dopaminy, jest metabolitem pośrednim w szlaku syntezy adrenaliny:
Podnosi poziom testosteronu oraz zwiększa syntezę i wydzielanie hormonu wzrostu. Występuje między innymi w świerzbcu właściwym[8] oraz bobie[9]. Jest metabolitem przejściowym melaniny w procesie melanogenezy.
Użycie medyczne
Lewodopa należy do najskuteczniejszych leków stosowanych w chorobie Parkinsona. Jako prekursor dopaminy przechodzi przez barierę krew–mózg, której ona sama nie jest w stanie przekroczyć. Następnie w ośrodkowym układzie nerwowym jest metabolizowana do dopaminy przy udziale dekarboksylazy aromatycznych L-aminokwasów, co skutkuje zwiększeniem stężenia tego neuroprzekaźnika w mózgu.
Dekarboksylacja DOP-y zachodzi również w obwodowym układzie nerwowym, co jest efektem niepożądanym, dlatego zwykle podaje się ją z inhibitorem dekarboksylazy obwodowej (karbidopą), który hamuje ten proces poza mózgiem[10].
Przypisy
- ↑ a b Farmakopea Polska VIII, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2008, s. 3491, ISBN 978-83-88157-53-0.
- ↑ a b c Haynes 2016 ↓, s. 3-338.
- ↑ Haynes 2016 ↓, s. 7-43.
- ↑ a b c Levodopa, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2012-08-03] (ang.).
- ↑ Haynes 2016 ↓, s. 5-93.
- ↑ Haynes 2016 ↓, s. 5-155.
- ↑ a b 3,4-Dihydroksy-L-fenyloalanina (nr 37830) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2020-06-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Mucuna pruriens, hort.purdue.edu [dostęp 2016-10-11].
- ↑ Oleh Hornykiewicz, A brief history of levodopa, „Journal of Neurology”, Suppl 2, 2010, S249–S252, DOI: 10.1007/s00415-010-5741-y, PMID: 21080185.c?
- ↑ Dopa decarboxylase inhibitors, „British Medical Journal”, 4 (5939), 1974, s. 250–251, DOI: 10.1136/bmj.4.5939.250, PMID: 4425849, PMCID: PMC1612227.c?
Bibliografia
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).
Linki zewnętrzne
- Biochemistry of Parkinson’s Disease. Viartis (ang.)
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Structure of 3,4-dihydroxy-L-phenylalanin (levodopa)