Lipidy
Lipidy (gr. λίπος, tłuszcz) – szeroka grupa występujących w naturze związków chemicznych. Zalicza się do nich tłuszcze, woski, sterole (w tym cholesterol[1]), rozpuszczalne w tłuszczach witaminy (A, D, E, K), monoacyloglicerole, diacyloglicerole, fosfolipidy i wiele innych substancji. Główne biologiczne funkcje lipidów to magazynowanie energii, tworzenie błon biologicznych i udział w przesyłaniu sygnałów. Chociaż człowiek i zwierzęta mają różnorodne szlaki metaboliczne zdolne do syntezy i rozkładu lipidów, niektóre kluczowe z nich nie mogą powstawać w ten sposób i muszą być dostarczane z dietą.
Związki te można szeroko zdefiniować jako niewielkie hydrofobowe lub amfifilowe cząsteczki, amfifilowość niektórych z nich pozwala im w środowisku wodnym tworzyć pęcherzyki, liposomy, czy błony. Biologiczne lipidy powstają w całości lub częściowo z dwóch odrębnych typów podjednostek („cegiełek”): grup ketoacylowych i izoprenowych[2]. Idąc tą drogą, lipidy podzielić można na osiem grup: kwasy tłuszczowe, glicerolipidy, glicerofosfolipidy, sfingolipidy, glikolipidy i związki poliketydowe (pochodne kondensacji podjednostek ketoacylowych), sterole i lipidy prenylowe (produkty kondensacji podjednostek izoprenoidowych).
Chociaż terminu „lipidy” używa się czasami jako synonimu tłuszczów, te ostatnie są w rzeczywistości ich podgrupą – triacyloglicerolami.
Grupy lipidów
Kwasy tłuszczowe
Kwasy tłuszczowe są to związki zbudowane z łańcucha węglowodorowego zakończonego polarną i hydrofilową grupą karboksylową, w przeciwieństwie do hydrofobowej i niepolarnej (a więc i nierozpuszczalnej w wodzie) pozostałej części cząsteczki. Struktura taka stanowi fundament w przypadku wielu lipidów, jest elementem budulcowym służącym do tworzenia bardziej skomplikowanych związków. Łańcuch zawiera zwykle od 4 (reszta kwasu masłowego) do 24 (reszta kwasu lignocerynowego) atomów węgla[3], może być nasycony lub nie. Może się także łączyć z grupą zawierającą tlen, chlorowiec, azot i siarkę. Obecność wiązania podwójnego pociąga za sobą występowanie izomerii geometrycznej cis-trans, co wpływa bardzo na strukturę i właściwości cząsteczki. Konfiguracja cis oznacza bowiem zgięcie łańcucha, czego efekt nasila się wraz ze wzrostem ilości takich wiązań w łańcuchu. Ma to zasadnicze znaczenie dla funkcji błony biologicznej[4]. Większość występujących w naturze nienasyconych kwasów tłuszczowych ma właśnie tę konfigurację, choć ich izomery trans spotyka się w niektórych naturalnych i częściowo uwodornionych tłuszczach i olejach[5].
Kwasy tłuszczowe i ich pochodne syntetyzowane są jako zwykle długie reszty acylowe dzięki stopniowemu wydłużeniu łańcucha węglowego przez przyłączanie jednostek dwuwęglowych. W procesie tym, zwanym lipogenezą, uczestniczą acetylo-CoA, malonylo-CoA, a także metylomalonylo-CoA[6][7].
Jako przykład kwasów tłuszczowych spełniających role ważne biologicznie podać można eikozanoidy (ikozanoidy) – pochodne kwasu arachidonowego i eikozapentaenowego. Zalicza się do nich prostaglandyny, tromboksany, leukotrieny i lipoksyny.
Dużą klasę pochodnych kwasów tłuszczowych stanowią ich estry i amidy. Do tych pierwszych zaliczamy woski, tioestry koenzymu A i ACP, a także pochodne karnityny. Amidy obejmują zaś połączenia z etanoloaminą, jak neurotransmiter kannabinoidowy anandamid[8].
Glicerolipidy
Glicerolipidy to zwykle mono-, di- i tri-podstawione glicerole[9]. Najbardziej znane z nich to triacyloglicerole (trójglicerydy). Są one zbudowane z glicerolu, którego wszystkie 3 grupy hydroksylowe zestryfikowane zostały przez reszty kwasów tłuszczowych, zazwyczaj nie różniących się od siebie. Funkcjonują zwykle jako magazyn energii i stanowią większość tłuszczu gromadzonego przez zwierzęta w tkance tłuszczowej. Mobilizacja tych rezerw polega między innymi na hydrolizie trójglicerydów do glicerolu i kwasów tłuszczowych[10].
Podgrupę glicerolipidów stanowią glikozyloglicerole mające jedną lub więcej grup monosacharydowych przyłączonych do glicerolu dzięki wiązaniu glikozydowemu. Jako przykład wymienić można digalaktozylodiacyloglicerole obecne w błonach roślinnych[11] i seminolipidy obecne w plemnikach ssaków[12].
Glicerofosfolipidy
Glicerofosfolipidy, zwane także po prostu fosfolipidami, to wszechobecne związki kluczowe dla istnienia dwuwarstwy lipidowej komórek, grające także rolę w metabolizmie i przesyłaniu sygnałów. Tkanka nerwowa, włączając w to mózg, zawiera względnie duże ilości glicerofosfolipidów, a zmiany w ich składzie wiążą się z różnorodnymi chorobami neurologicznymi[13]. Grupę tę można podzielić na kilka różnych klas na podstawie budowy polarnej części cząsteczki przyłączonej do węgla sn-3 w przypadku organizmów eukariotycznych i eubakterii, natomiast do węgla sn -1 u archeobakterii[14].

W błonie biologicznej znajdują się choćby fosfatydylocholina (PC, GPCho, szerzej znana jako lecytyna), fosfatydyloetanolamina (PE, GPEtn) i fosfatydyloseryna (PS, GPSer). Oprócz tworzenia błon biologicznych i miejsc wiązania białek wewnątrz-, jak i zewnątrzkomórkowych niektóre glicerofosfolipidy eukariotyczne, jak fosfatydyloinozytol i kwas fosfatydowy, są prekursorami przekaźników drugorzędowych lub samymi przekaźnikami pochodzącymi z błon[16]. Zazwyczaj jedna lub dwie z grup hydroksylowych glicerolu są zestryfikowanego grupami acylowymi pochodzącymi od długołańcuchowych kwasów tłuszczowych. Jednakże w cząsteczkach plazmalogenów uległy one połączeniu z grupami alkilowymi lub 1Z-nienasyconymi grupami alkenylowymi. Archeobakterie wytwarzają pochodne dialkilowe[17].
Sfingolipidy
Sfingolipidy to złożona rodzina związków[18], które łączy rdzeń (u zwierząt zazwyczaj sfingozyna) syntetyzowany de novo z aminokwasu seryny i długołańcuchowego acylo-CoA. Pochodne tego rodzaju obejmują ceramidy, fosfosfingolipidy, glikosfingolipidy i inne substancje. Ceramidy powstają poprzez przyłączenie reszty kwasu tłuszczowego do grupy aminowej rdzenia wiązaniem amidowym. Acyl ten liczy sobie zwykle od 16 do 26 atomów węgla i jest nasycony lub zawiera jedno wiązanie podwójne węgiel-węgiel[19]

Głównymi fosfosfingolipidami ssaków są sfingomieliny[20], podczas gdy u owadów spotyka się ceramidowe pochodne fosfoetanoloaminy[21]. Grzyby zaś mają fitoceramidowe połączenia fosfoinozytoli zawierające też grupy pochodzące od mannozy[22]. Glikosfingolipidy to zróżnicowana grupa cząsteczek, w których jedna lub więcej grup cukrowych przyłączają się do rdzenia dzięki wiązaniu glikozydowemu. Związki te mogą być proste lub złożone. Przykład stanowią cerebrozydy i gangliozydy.
Steroidy
Sterole, jak cholesterol i jego pochodne, stanowią ważny element błony lipidowej[23], podobnie jak glicerofosfolipidy i sfingomieliny. Steroidy, wszystkie oparte na czteropierścieniowej strukturze cyklopentanoperhydrofenantrenu, grają zróżnicowane biologiczne role hormonów i cząsteczek sygnałowych. Estrogeny to rodzina związków osiemnastowęglowych, podczas gdy androgeny, jak testosteron i androsteron, zawierają jeden atom węgla więcej. Z kolei progestageny (np. progesteron) oraz hormony kory nadnercza – glukokortyokidy i mineralokortykoidy – zawierają 21 atomów węgla[24]. Sekosteroidy, do których należą różne formy witaminy D, wyróżniają się rozerwaniem pierścienia B[25]. Do steroidów zaliczamy także kwasy żółciowe i ich koniugaty[26], które u ssaków stanowią utlenione pochodne cholesterolu i syntetyzowane są w wątrobie. Ich roślinne odpowiedniki to fitosterole, jak ß-sitosterol, stigmasterol czy brasikasterol; tego ostatniego używa się jako biomarkera wzrostu alg[27]. Natomiast w błonach komórkowych grzybów dominuje ergosterol[28].
Sacharolipidy
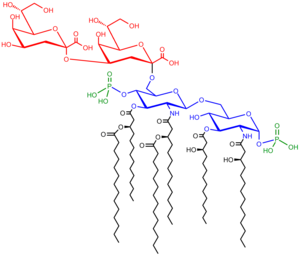
Sacharolipidy to związki, w których reszty kwasów tłuszczowych łączą się bezpośrednio z cukrem, tworząc strukturę zgodną z dwuwarstwą lipidową. Zamiast glicerolu występuje w nich monosacharyd, zwykle mamy tu do czynienia z acylowaną glukozaminą tworzącą lipid A, składnik lipopolisacharydu bakterii Gram-ujemnych. Typowe lipidy A to disacharydy glukozaminy, do których przyłączać się może nawet 7 reszt acylowych. Najmniejszym lipopolisacharydem niezbędnym dla wzrostu bakterii Escherichia coli jest Kdo2-Lipid A, sześciokrotnie acylowany disacharyd glukozaminy glikozylowany przez dwie reszty kwasu 3-deoksy-D-mannooktulozowego (Kdo)[29].
Poliketydy
Poliketydy to związki powstające w wyniku enzymatycznej polimeryzacji. Enzymem takim jest na przykład PKS (polyketide synthase). Monomer stanowią podjednostki pochodzące z kwasów karboksylowych, jak reszty acetylowe i propionylowe. Do tej grupy należy wiele metabolitów wtórnych i innych naturalnych substancji spotykanych u zwierząt, roślin, grzybów. Różnią się one znacznie budową[30][31]. W ich cząsteczce występuje pierścień poddany dodatkowym modyfikacjom, jak glikozylacja, metylacja, hydroksylacja, oksydacja i inne procesy. Wśród poliketydów lub ich pochodnych spotyka się substancje o działaniu przeciwbakteryjnym, przeciwpasożytniczym i przeciwnowotworowym, jak erytromycyna, tetracykliny, awermektyny i epotilony[32].
Prenole
Prenole syntetyzowane są z pięciowęglowych prekursorów (difosforan izopentenylu i difosforan dimetyloallilu). Szlak biegnie przez kwas mewalonowy[33]. Proste izoprenoidy (liniowe alkohole, difosforany itp.) tworzone są przez dołączanie kolejnych grup pięciowęglowych (jednostka izoprenowa). Klasyfikuje się je na podstawie ich ilości. Związki liczące więcej, niż 40 atomów węgla określa się już jako politerpeny.
Grupą spełniających ważne funkcje izoprenoidów są karotenoidy. Działają jako przeciwutleniacze. Są wśród nich prekursory witaminy A[34]. Inna biologicznie istotna grupa cząsteczek zawiera chinony i hydrochinony zawierające izoprenoidowy łańcuch dołączony do pierścienia chinonowego o nieizoprenowym pochodzeniu[35]. Zalicza się tu witaminę E, K, ubichinon. Prokarionty syntetyzują poliprenole (baktoprenole), w których ostatnia jednostka izoprenowa przyłączona do tlenu pozostaje nienasycona, podczas gdy w zwierzęcych dolicholach jest ona uwodorniona[36].
Funkcje biologiczne
Błony
Komórka eukariotyczna ma organella spełniające różne funkcje otoczone błonami. W komórkach zwierzęcych błona komórkowa oddziela wnętrze komórki od środowiska zewnętrznego. Zarówno błona komórkowa, jak i błony plazmatyczne organelli tworzone są głównie przez glicerofosfolipidy. Jak już wspomniano, są to amfipatyczne związki zbudowane z dwóch łańcuchów ("ogonków") kwasów tłuszczowych (region hydrofobowy) przyłączonych wiązaniami estrowymi do glicerolu łączącego się przez ostatnią grupę hydroksylową z fosforanem (region hydrofilowy), również za pomocą wiązania estrowego. Oprócz nich w błonach spotyka się sfingomieliny i sterole, głównie cholesterol[37]. U roślin i glonów galaktozylodiacyloglicerole[38] i sulfodiacylglycerol[11], niemające grupy fosforanowej, są ważnymi składnikami błon chloroplastów i pokrewnych organelli. Występują najliczniej z wszystkich lipidów w tkankach prowadzących fotosyntezę u roślin wyższych, glonów i niektórych bakterii.
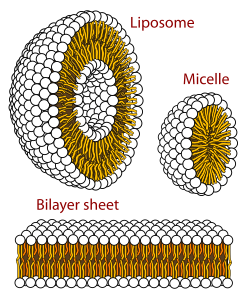
Błona biologiczna to forma dwuwarstwy lipidowej. Tworzenie tej ostatniej jest procesem uprzywilejowanym energetycznie, gdy opisane wyżej glicerofosfolipidy znajdą się w środowisku wodnym[39]. Wtedy polarne główki lipidów ułożą się w kierunku polarnego wodnego środowiska, natomiast hydrofobowe ogonki będą się zbierać razem, by zminimalizować kontakt z wodą. W rezultacie utworzy się pęcherzyk. Zależnie od stężenia krytycznego lipidów mogą powstać micele, liposomy, a nawet dwuwarstwa. Obserwuje się także inne agregaty, co stanowi część polimorfizmu amfifilowych właściwości lipidów. Ich właściwości fazowe to pole badań biofizyki i przedmiot badań akademickich[40][41]. Micele i dwuwarstwy tworzą się w polarnym medium w procesie znanym jako efekt hydrofobowy[42].
Przechowywanie energii
Triacyloglicerole, magazynowane w tkance tłuszczowej, są główną formą przechowywania energii u zwierząt. Adipocyty (komórki tłuszczowe) funkcjonują, by stale syntetyzować, magazynować i rozkładać triacyloglicerole. Lizę kontroluje w tym wypadku aktywacja lipazy hormonozależnej[43]. Kompletne utlenienie kwasów tłuszczowych zapewnia dużą ilość energii, około 9 kcal/g], dla porównania jest to 4 kcal/g w przypadku węglowodanów i białek. Migrujące ptaki, zmuszone do pokonywania długich dystansów bez pobierania pożywienia, zużywają wtedy energię zmagazynowaną w postaci triacylogliceroli[44].
Przekaźnictwo sygnałów
W ostatnich latach okazało się, że lipidy pełnią ważną rolę w przekazywaniu sygnałów przez komórki[45]. Może ono przebiegać poprzez aktywację receptora związanego z białkiem G lub receptora jądrowego. Jako cząsteczki sygnalne (w tym wypadku drugie przekaźniki) zidentyfikowano kilka różnych kategorii lipidów. Przekaźnictwo lipidowe może zajść poprzez aktywację receptorów sprzężonych z białkiem G lub receptorów jądrowych, a elementy różnych innych kategorii lipidów zostały zidentyfikowane jako cząsteczki przekaźnikowe i informatory II rzędu[46]. Obejmują one sfingozyno-1-fosforan, sfingolipid pochodzący od ceramidu spełniający rolę regulacyjną w mobilizacji wapnia[47], wzroście komórki i apoptozie[48]. Z kolei diacyloglicerol (DAG) i fosforany fosfatydyloinozytolu (PIPs) grają rolę w zależnej od wapnia aktywacji kinazy białkowej C[49]. Prostaglandyny, grupa pochodnych kwasów dwudziestowęglowych, angażują się w procesy związane z zapaleniem i odpornością[50]. Natomiast hormony steroidowe, jak estrogeny, testosteron i kortyzol, odpowiadają za liczne funkcje związane z reprodukcja, metabolizmem i ciśnieniem krwi. Oksysterole, na przykład 25-hydroksycholesterol, to agonisty receptorów X w wątrobie[51].
Inne funkcje
Witaminy rozpuszczalne w tłuszczach (A, D, E, K) – zbudowane m.in. na bazie izoprenu – stanowią niezwykle ważne składniki odżywcze magazynowane w wątrobie i tkance tłuszczowej, pełniące różnorodne funkcje. Karnityna uczestniczy w transporcie reszt kwasów tłuszczowych do mitochondriów, gdzie poddaje się je beta-oksydacji[52]. Poliprenole i ich ufosforylowane pochodne pełnią ważne funkcje w transporcie przezbłonowym oligosacharydów. Uczestniczą w pozacytoplazmatycznych reakcjach glikozylacji, w pozakomórkowej biosyntezie polisacharydów (np. peptydoglikan tworzony przez bakterie), a także w eukariotycznej N-glikozylacji białek[53][54]. Kardiolipiny to podgrupa glicerofosfolipidów zawierających cztery łańcuchy kwasów tłuszczowych i trzy grupy pochodzące z glicerolu. Występują obficie w wewnętrznej błonie mitochondrialnej[55]. Sądzi się, że aktywują enzymy biorące udział w fosforylacji oksydacyjnej[56].
Metabolizm
Najważniejszymi lipidami spożywczymi w przypadku człowieka i innych zwierząt są zwierzęce lub roślinne triacyloglicerole, sterole i fosfolipidy błonowe. Ich metabolizm obejmuje zarówno syntezę, jak i degradację lipidów charakterystycznych dla konkretnych tkanek.
Biosynteza
U zwierząt w przypadku nadmiaru węglowodanów mogą być one przekształcane w triacyloglicerole. Obejmuje to tworzenie kwasów tłuszczowych z acetylo-CoA i ich estryfikację (patrz lipogeneza)[57]. Reszty kwasów tłuszczowych tworzy syntaza kwasów tłuszczowych, która przyłącza do wydłużającego się łańcucha kolejne dwuwęglowe jednostki i redukuje je, przekształcając grupę ketonową w hydroksylową, następnie dehydratuje i ponownie redukuje, po czym powtarza cały cykl. Odpowiedzialne za proces enzymy podzielić można na dwie grupy. U zwierząt i grzybów wszystkie reakcje przeprowadza jeden wielofunkcyjny enzym[58], podczas gdy u roślin i prokariontów każdy krok przeprowadza oddzielna cząsteczka enzymu[59][60]. Stworzone reszty mogą być następnie przekształcane do triacylogliceroli i umieszczane w lipoproteinach wydzielanych przez wątrobę.
Synteza kwasów tłuszczowych o nienasyconych łańcuchach węglowych wymaga reakcji katalizowanej przez desaturazę wprowadzającą wiązanie podwójne pomiędzy atomami węgla łańcucha. Dla przykładu u ludzi odwodornienie reszty kwasu stearynowego prowadzi do reszty kwasu oleinowego. Podwójnie (kwas linolowy) i potrójnie (kwas linolenowy) nienasycone reszty nie powstają w tkankach ssaków, dlatego też te kluczowe związki muszą być dostarczane w pożywieniu[61]. Przyczyną jest brak desaturazy wprowadzającej wiązanie podwójne dalej, niż przy dziewiątym atomie węgla.
Synteza triacylogliceroli odbywa się w siateczce śródplazmatycznej. Grupy acylowe przenoszone są z acylo-CoA na grupy hydroksylowe glicerolo-3-fosforanu lub diacyloglicerolu[62].
Terpeny (izoprenoidy), w tym karotenoidy, tworzą się dzięki łączeniu i modyfikacji jednostek izoprenowych pochodzących ze związku prekursorowego pirofosforanu izopentenylu i pirofosforanu dimetyloallilu[63]. Te z kolei mogą powstawać w dwóch różnych drogach. U zwierząt, większości bakterii i archeonów powstają wyłącznie poprzez mewalonian z acetylo-CoA, podczas gdy u roślin i części bakterii występuje też ścieżka przebiegająca przez pirogronian i gliceraldehydo-3-fosforan[63][64][65]. Mogą one także służyć do biosyntezy steroidów. Łączą się wtedy. tworząc skwalen, przekształcany następnie do lanosterolu[66], a ten do cholesterolu i ergosterolu[66][67].
Degradacja
Beta-oksydacja to szlak metaboliczny, w którym łańcuchy kwasów tłuszczowych ulegają rozkładowi do reszt acetylowych w acetylo-CoA. Proces zachodzi w mitochondriach i peroksysomach. Zwracają uwagę podobieństwa, ale i różnice w stosunku do odwróconej syntezy długołańcuchowych acylo-CoA. Usunięcie dwuwęglowego fragmentu obejmuje bowiem sekwencję dehydrogenacji, przyłączenia cząsteczki wody, utlenienia grupy hydroksylowej do karbonylowej z utworzeniem pochodnej beta-ketokwasu, a w końcu jego podział poprzez tiolizę na dwie pochodne acylowe koenzymu A. Powstały w ten sposób acetylo-CoA służy do wytworzenia energii w postaci ATP, utleniając się do dwutlenku węgla w cykle kwasów trójkarboksylowych. Pobrane z niego równoważniki redukcyjne wędrują poprzez łańcuch oddechowy w wewnętrznej błonie mitochondrium, aż zostanie utworzona cząsteczka wody. Ze spalenia 1 mola palmitynianu może powstać 106 moli ATP[68]. Kwasy tłuszczowe nienasycone lub mające nieparzystą liczbę atomów węgla wymagają dodatkowych reakcji rozkładu.
Znaczenie dla zdrowia
Większość lipidów w pokarmie przybiera formę triacylogliceroli, cholesterolu i fosfolipidów. Ich minimalna zawartość w diecie jest niezbędna dla ułatwienia absorpcji witamin rozpuszczalnych w tłuszczach (retinolu, kalcyferolu, tokoferoli i filochinonu) oraz karotenoidów[69]. Ludzie i inne ssaki muszą dostarczać sobie z pożywieniem niezbędne kwasy tłuszczowe, jak kwas linolowy (omega-6) i linolenowy (omega-3). Nie syntezują ich bowiem samodzielnie[61] Większość olejów roślinnych stanowi bogate źródło kwasu linolowego (krokosz barwierski, słonecznik, kukurydza). Alpha-linolenian znajduje się w zielonych liściach roślin i w wybranych nasionach, orzeszkach i strąkach (szczególnie len, rzepak, orzech włoski i soja)[70]. Olej rybi obfituje zwłaszcza w długołańcuchowe kwasy omega-3, jak kwas eikozapentaenowy (EPA) i dokozaheksaenowy (DHA)[71]. Korzyściom dla zdrowia wynikającym ze spożycia kwasów omega-3 poświęcono wiele badań naukowych. Wpływają one pozytywnie na rozwój niemowlęcia, pomagają w przypadku chorób nowotworowych, sercowo-naczyniowych i umysłowych, jak depresja, demencja, ADHD[72][73]. Dla porównania uważa się obecnie, że spożycie tłuszczu wykazującego obecność częściowo uwodornionych kwasów tłuszczowych z wiązaniami trans stanowi czynnik ryzyka choroby sercowo-naczyniowej[74][75][76].
Kilka badań sugeruje, że dzienne spożycie tłuszczu wiąże się ze zwiększonym ryzykiem otyłości[77][78] i cukrzycy[79][80]. Jednakże wiele bardzo dużych badań, w tym Women's Health Initiative Dietary Modification Trial, ośmioletnie badanie 49 000 kobiet, Nurses' Health Study i Health Professionals Follow-up Study, nie wykazały takich powiązań[81][82][83]. Żadne z badań nie wykazuje związku pomiędzy ilością pobieranych z pożywieniem kalorii w postaci tłuszczu a ryzykiem raka, chorób serca czy wzrostem masy. The Nutrition Source, strona utrzymywana przez Department of Nutrition przy Harvard School of Public Health, podsumowuje obecny pogląd na wpływ tłuszczu następującymi słowami: „Szczegółowe badania, z których wiele przeprowadzono w Harvardzie, ukazują, że całkowita ilość tłuszczu w diecie w rzeczywistości nie wiąże się z masą ciała ani chorobą”[84].
Przypisy
- ↑ Michelle A: Human Biology and Health. Hopkins J, McLaughlin CW, Johnson S, Warner MQ, LaHart D, Wright JD.. Englewood Cliffs, New Jersey, USA: Prentice Hall, 1993. ISBN 0-13-981176-1. OCLC 32308337.
- ↑ Fahy E, Subramaniam S, Brown HA, et al.. A comprehensive classification system for lipids. „Journal of Lipid Research”. 5 (46), s. 839–61, 2005. DOI: 10.1194/jlr.E400004-JLR200. PMID: 15722563 (ang.).
- ↑ Advanced Nutrition and Human Metabolism. Belmont, CA: West Pub. Co, 1995, s. 98. ISBN 0-314-04467-1. (ang.)
- ↑ Devlin 1997 ↓, s. 193–195.
- ↑ Hunter JE.. Dietary trans fatty acids: review of recent human studies and food industry responses. „Lipids”. 11 (41), s. 967–992, 2006. DOI: 10.1007/s11745-006-5049-y. PMID: 17263298 (ang.).
- ↑ Biochemistry of Lipids, Lipoproteins and Membranes. Amsterdam: Elsevier, 2002. ISBN 0-444-51139-3. OCLC 51001207. (ang.)
- ↑ Lipodomics and Bioactive Lipids: Mass Spectrometry Based Lipid Analysis, Volume 432 (Methods in Enzymology). Boston: Academic Press, 2007. ISBN 0-12-373895-4. OCLC 166624879. (ang.)
- ↑ Fezza F, De Simone C, Amadio D, Maccarrone M.. Fatty acid amide hydrolase: a gate-keeper of the endocannabinoid system. „Subcellular Biochemistry”, s. 101–32, 2008. DOI: 10.1007/978-1-4020-8831-5_4. PMID: 18751909 (ang.).
- ↑ Coleman RA, Lee DP.. Enzymes of triacylglycerol synthesis and their regulation. „Progress in Lipid Research”, s. 134–76, 2004. DOI: 10.1016/S0163-7827(03)00051-1 (ang.).
- ↑ van Holde 1996 ↓, s. 630.
- ↑ a b Hölzl G, Dörmann P.. Structure and function of glycoglycerolipids in plants and bacteria. „Progress in Lipid Research”. 5 (46), s. 225–43, 2007. DOI: 10.1016/j.plipres.2007.05.001. PMID: 17599463 (ang.).
- ↑ Honke K, Zhang Y, Cheng X, Kotani N, Taniguchi N.. Biological roles of sulfoglycolipids and pathophysiology of their deficiency. „Glycoconjugates Journal”. 1–2 (21), s. 59–62, 2004. DOI: 10.1023/B:GLYC.0000043749.06556.3d. PMID: 15467400 (ang.).
- ↑ Farooqui AA, Horrocks LA, Farooqui T.. Glycerophospholipids in brain: their metabolism, incorporation into membranes, functions, and involvement in neurological disorders. „Chemistry and Physics of Lipids”. 1 (106), s. 1–29, 2000. DOI: 10.1016/S0009-3084(00)00128-6. PMID: 10878232 (ang.). [dostęp 2009-04-12].
- ↑ Ivanova PT, Milne SB, Byrne MO, Xiang Y, Brown HA.. Glycerophospholipid identification and quantitation by electrospray ionization mass spectrometry. „Methods in Enzymology”, s. 21–57, 2007. DOI: 10.1016/S0076-6879(07)32002-8. PMID: 17954212 (ang.).
- ↑ a b Stryer 2007 ↓, s. 330.
- ↑ van Holde 1996 ↓, s. 844.
- ↑ Paltauf F.. Ether lipids in biomembranes. „Chemistry and Physics of Lipids”. 2 (74), s. 101–39, 1994. DOI: 10.1016/0009-3084(94)90054-X. PMID: 7859340 (ang.).
- ↑ Merrill AH, Sandhoff K. (2002). "Sphingolipids: metabolism and cell signaling",in New Comprehensive Biochemistry: Biochemistry of Lipids, Lipoproteins,and Membranes, Vance, D.E. and Vance, J.E., eds. Elsevier Science, NY. Ch. 14.
- ↑ Devlin 1997 ↓, s. 421–422.
- ↑ Hori T, Sugita M. Sphingolipids in lower animals. „Prog. Lipid Res.”. 1 (32), s. 25–45, 1993. DOI: 10.1016/0163-7827(93)90003-F. PMID: 8415797 (ang.).
- ↑ Wiegandt H.. Insect glycolipids. „Biochimica et Biophysica Acta”. 2 (1123), s. 117–26, 1992. PMID: 1739742 (ang.).
- ↑ Guan X, Wenk MR.. Biochemistry of inositol lipids. „Frontiers in Bioscience”, s. 3239–51, 2008. DOI: 10.2741/2923. PMID: 18508430 (ang.).
- ↑ Bach D, Wachtel E.. Phospholipid/cholesterol model membranes: formation of cholesterol crystallites. „Biochim Biophys Acta”, s. 187–97, 2003. DOI: 10.1016/S0005-2736(03)00017-8 (ang.).
- ↑ Stryer 2007 ↓, s. 749.
- ↑ Bouillon R, Verstuyf A, Mathieu C, Van Cromphaut S, Masuyama R, Dehaes P, Carmeliet G.. Vitamin D resistance. „Best Practice & Research. Clinical Endocrinology & Metabolism”. 4 (20), s. 627–645, 2006. DOI: 10.1016/j.beem.2006.09.008. PMID: 17161336 (ang.).
- ↑ Russell DW.. The enzymes, regulation, and genetics of bile acid synthesis. „Annual Review of Biochemistry”, s. 137–74, 2003. DOI: 10.1146/annurev.biochem.72.121801.161712 (ang.).
- ↑ J.C. Villinski, J.M. Hayes, S.C. Brassell, V.L. Riggert i inni. Sedimentary sterols as biogeochemical indicators in the Southern Ocean. „Organic Geochemistry”. 5 (39), s. 567–88, 2008. DOI: 10.1016/j.orggeochem.2008.01.009 (ang.).
- ↑ Fungal Biology. Cambridge, MA: Blackwell Publishers, 2005, s. 342. ISBN 1-4051-3066-0. (ang.)
- ↑ a b Raetz CR, Garrett TA, Reynolds CM, Shaw WA, Moore JD, Smith DC Jr, Ribeiro AA, Murphy RC,Ulevitch RJ, Fearns C, Reichart D, Glass CK, Benner C, Subramaniam S, Harkewicz R, Bowers-Gentry RC, Buczynski MW, Cooper JA, Deems RA, Dennis EA.. Kdo2-Lipid A of Escherichia coli, a defined endotoxin that activates macrophages via TLR-4. „Journal of Lipid Research”, s. 1097–111, 2006. DOI: 10.1194/jlr.M600027-JLR200. PMID: 16479018 (ang.).
- ↑ Walsh CT.. Polyketide and nonribosomal peptide antibiotics: modularity and versatility. „Science”, s. 1805–10, 2004. DOI: 10.1126/science.1094318. PMID: 15031493 (ang.).
- ↑ Caffrey P, Aparicio JF, Malpartida F, Zotchev SB. Biosynthetic engineering of polyene macrolides towards generation of improved antifungal and antiparasitic agents. „Current Topics in Medicinal Chemistry”. 8 (8), s. 639–53, 2008. DOI: 10.2174/156802608784221479. PMID: 18473889 (ang.).
- ↑ Minto RE, Blacklock BJ.. Biosynthesis and function of polyacetylenes and allied natural products. „Progress in Lipid Research”. 4 (47), s. 233–306, 2008. DOI: 10.1016/j.plipres.2008.02.002. PMID: 18387369 (ang.). [dostęp 2009-04-12].
- ↑ Kuzuyama T, Seto H.. Diversity of the biosynthesis of the isoprene units. „Natural Product Reports”, s. 171–83, 2003. DOI: 10.1039/b109860h.
- ↑ Rao AV, Rao LG.. Carotenoids and human health. „Pharmacological Research : the Official Journal of the Italian Pharmacological Society”. 3 (55), s. 207–216, 2007. DOI: 10.1016/j.phrs.2007.01.012. PMID: 17349800.
- ↑ Brunmark A, Cadenas E.. Redox and addition chemistry of quinoid compounds and its biological implications. „Free Radical Biology & Medicine”. 4 (7), s. 435–77, 1989. DOI: 10.1016/0891-5849(89)90126-3. PMID: 2691341.
- ↑ Swiezewska E, Danikiewicz W.. Polyisoprenoids: structure, biosynthesis and function. „Progress in Lipid Research”. 4 (44), s. 235–58, 2005. DOI: 10.1016/j.plipres.2005.05.002. PMID: 16019076.
- ↑ Stryer 2007 ↓, s. 329–331.
- ↑ Heinz E.(1996). Plant glycolipids: structure, isolation and analysis. in Advances in Lipid Methodology – 3, s. 211–332, W.W. Christie (red.), Oily Press, Dundee)
- ↑ Stryer 2007 ↓, s. 333–334.
- ↑ van Meer G, Voelker DR, Feigenson GW.. Membrane lipids: where they are and how they behave. „Nature Reviews. Molecular Cell Biology”. 2 (9), s. 112–24, 2008. DOI: 10.1038/nrm2330. PMID: 18216768.
- ↑ Feigenson GW.. Phase behavior of lipid mixtures. „Nature Chemical Biology”. 11 (2), s. 560–63, 2006. DOI: 10.1038/nchembio1106-560. PMID: 17051225.
- ↑ Wiggins PM.. Role of water in some biological processes. „Microbiological Reviews”. 4 (54), s. 432–49, 1990. PMID: 2087221.
- ↑ Brasaemle DL. Thematic review series: adipocyte biology. The perilipin family of structural lipid droplet proteins: stabilization of lipid droplets and control of lipolysis. „J. Lipid Res.”. 12 (48), s. 2547–59, 2007. DOI: 10.1194/jlr.R700014-JLR200. PMID: 17878492.
- ↑ Stryer 2007 ↓, s. 619.
- ↑ Wang X.. Lipid signaling. „Current Opinions in Plant Biology”. 3 (7), s. 329–36, 2004. DOI: 10.1016/j.pbi.2004.03.012. PMID: 15134755.
- ↑ Eyster KM.. The membrane and lipids as integral participants in signal transduction. „Advances in Physiology Education”, s. 5–16, 2007. DOI: 10.1152/advan.00088.2006. PMID: 17327576.
- ↑ Hinkovska-Galcheva V, VanWay SM, Shanley TP, Kunkel RG.. The role of sphingosine-1-phosphate and ceramide-1-phosphate in calcium homeostasis. „Current Opinion in Investigational Drugs”. 11 (9), s. 1192–205, 2008. PMID: 18951299.
- ↑ Saddoughi SA, Song P, Ogretmen B.. Roles of bioactive sphingolipids in cancer biology and therapeutics. „Subcellular Biochemistry”, s. 413–40, 2008. DOI: 10.1007/978-1-4020-8831-5_16. PMID: 18751921.
- ↑ Klein C, Malviya AN.. Mechanism of nuclear calcium signaling by inositol 1,4,5-trisphosphate produced in the nucleus, nuclear located protein kinase C and cyclic AMP-dependent protein kinase. „Frontiers in Bioscience”, s. 1206–26, 2008. DOI: 10.2741/2756. PMID: 17981624.
- ↑ Boyce JA.. Eicosanoids in asthma, allergic inflammation, and host defense. „Current Molecular Medicine”. 5 (8), s. 335–49, 2008. DOI: 10.2174/156652408785160989. PMID: 18691060.
- ↑ Bełtowski J.. Liver X receptors (LXR) as therapeutic targets in dyslipidemia. „Cardiovascular Therapy”. 4 (26), s. 297–316, 2008. DOI: 10.1111/j.1755-5922.2008.00062.x. PMID: 19035881.
- ↑ Indiveri C, Tonazzi A, Palmieri F. Characterization of the unidirectional transport of carnitine catalyzed by the reconstituted carnitine carrier from rat liver mitochondria. „Biochim. Biophys. Acta”. 1 (1069), s. 110–6, 1991. DOI: 10.1016/0005-2736(91)90110-T. PMID: 1932043.
- ↑ Parodi AJ, Leloir LF. The role of lipid intermediates in the glycosylation of proteins in the eucaryotic cell. „Biochim. Biophys. Acta”. 1 (559), s. 1–37, 1979. DOI: 10.1016/0304-4157(79)90006-6. PMID: 375981.
- ↑ Helenius A, Aebi M.. Intracellular functions of N-linked glycans. „Science”, s. 2364–69, 2001. DOI: 10.1126/science.291.5512.2364. PMID: 11269317.
- ↑ Gohil VM, Greenberg ML.. Mitochondrial membrane biogenesis: phospholipids and proteins go hand in hand. „Journal of Cell Biology”. 4 (184), s. 469–72, 2009. DOI: 10.1083/jcb.200901127. PMID: 19237595.
- ↑ Hoch FL.. Cardiolipins and biomembrane function. „Biochimica et Biophysica Acta”. 1 (1113), s. 71–133, 1992. PMID: 10206472.
- ↑ Stryer 2007 ↓, s. 634.
- ↑ Chirala S, Wakil S.. Structure and function of animal fatty acid synthase. „Lipids”. 11 (39), s. 1045–53, 2004. DOI: 10.1007/s11745-004-1329-9. PMID: 15726818.
- ↑ White S, Zheng J, Zhang Y.. The structural biology of type II fatty acid biosynthesis. „Annual Review of Biochemistry”, s. 791–831, 2005. DOI: 10.1146/annurev.biochem.74.082803.133524. PMID: 15952903.
- ↑ Ohlrogge J, Jaworski J.. Regulation of fatty acid synthesis. „Annual Review of Plant Physiology and Plant Molecular Biology”, s. 109–136, 1997. DOI: 10.1146/annurev.arplant.48.1.109. PMID: 15012259.
- ↑ a b Stryer 2007 ↓, s. 643.
- ↑ Stryer 2007 ↓, s. 733–739.
- ↑ a b Kuzuyama T, Seto H.. Diversity of the biosynthesis of the isoprene units. „Natural Product Reports”. 2 (20), s. 171–83, 2003. DOI: 10.1039/b109860h. PMID: 12735695.
- ↑ Lichtenthaler H.. The 1-Dideoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants. „Annual Review of Plant Physiology and Plant Molecular Biology”, s. 47–65, 1999. DOI: 10.1146/annurev.arplant.50.1.47. PMID: 15012203.
- ↑ Grochowski L, Xu H, White R.. Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate. „Journal of Bacteriology”. 9 (188), s. 3192–98, 2006. DOI: 10.1128/JB.188.9.3192-3198.2006. PMID: 16621811.
- ↑ a b Schroepfer G.. Sterol biosynthesis. „Annual Review of Biochemistry”, s. 585–621, 1981. DOI: 10.1146/annurev.bi.50.070181.003101. PMID: 7023367.
- ↑ Lees N, Skaggs B, Kirsch D, Bard M.. Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review. „Lipids”. 3 (30), s. 221–26, 1995. DOI: 10.1007/BF02537824. PMID: 7791529.
- ↑ Stryer 2007 ↓, s. 625–626.
- ↑ Bhagavan 2002 ↓, s. 903.
- ↑ Russo GL.. Dietary n-6 and n-3 polyunsaturated fatty acids: from biochemistry to clinical implications in cardiovascular prevention. „Biochemical Pharmacology”. 6 (77), s. 937–46, 2009. DOI: 10.1016/j.bcp.2008.10.020. PMID: 19022225.
- ↑ Bhagavan 2002 ↓, s. 388.
- ↑ Riediger ND, Othman RA, Suh M, Moghadasian MH.. A systemic review of the roles of n-3 fatty acids in health and disease. „Journal of the American Dietetic Association”. 4 (109), s. 668–79, 2009. DOI: 10.1016/j.jada.2008.12.022. PMID: 19328262.
- ↑ Galli C, Risé P.. Fish consumption, omega 3 fatty acids and cardiovascular disease. The science and the clinical trials. „Nutrition and Health (Berkhamsted, Hertfordshire)”. 1 (20), s. 11–20, 2009. PMID: 19326716.
- ↑ Micha R, Mozaffarian D.. Trans fatty acids: effects on cardiometabolic health and implications for policy. „Prostaglandins, Leukotrienes, and Essential Fatty Acids”. 3–5 (79), s. 147–52, 2008. DOI: 10.1016/j.plefa.2008.09.008. PMID: 18996687.
- ↑ Dalainas I, Ioannou HP.. The role of trans fatty acids in atherosclerosis, cardiovascular disease and infant development. „International Angiology: a Journal of the International Union of Angiology”. 2 (27), s. 146–56, 2008. PMID: 18427401.
- ↑ Mozaffarian D, Willett WC.. Trans fatty acids and cardiovascular risk: a unique cardiometabolic imprint?. „Current Atherosclerosis Reports”. 6 (9), s. 486–93, 2007. DOI: 10.1007/s11883-007-0065-9. PMID: 18377789.
- ↑ Astrup A, Dyerberg J, Selleck M, Stender S.. Nutrition transition and its relationship to the development of obesity and related chronic diseases. „Obesity Review”, s. 48–52, 2008. DOI: 10.1111/j.1467-789X.2007.00438.x. PMID: 18307699.
- ↑ Astrup A.. The role of dietary fat in obesity. „Seminars in Vascular Medicine”. 1 (5), s. 40–47, 2005. DOI: 10.1055/s-2005-871740.
- ↑ Ma Y. et al. Low-carbohydrate and high-fat intake among adult patients with poorly controlled type 2 diabetes mellitus. „Nutrition”, s. 1129–1136, 2006. DOI: 10.1016/j.nut.2006.08.006.
- ↑ Astrup A.. Dietary management of obesity. „JPEN Journal of Parenteral and Enteral Nutrition”. 5 (32), s. 575–77, 2008. DOI: 10.1177/0148607108321707. PMID: 18753397. [dostęp 2009-04-12].
- ↑ Beresford SA, Johnson KC, Ritenbaugh C, et al.. Low-fat dietary pattern and risk of colorectal cancer: the Women's Health Initiative Randomized Controlled Dietary Modification Trial. „JAMA: the Journal of the American Medical Association”. 6 (295), s. 643–654, 2006. DOI: 10.1001/jama.295.6.643. PMID: 16467233.
- ↑ Howard BV, Manson JE, Stefanick ML, et al.. Low-fat dietary pattern and weight change over 7 years: the Women's Health Initiative Dietary Modification Trial. „JAMA: the Journal of the American Medical Association”. 1 (295), s. 39–49, 2006. DOI: 10.1001/jama.295.1.39. PMID: 16391215.
- ↑ Howard BV, Van Horn L, Hsia J, et al.. Low-fat dietary pattern and risk of cardiovascular disease: the Women's Health Initiative Randomized Controlled Dietary Modification Trial. „JAMA : the Journal of the American Medical Association”. 6 (295), s. 655–66, 2006. DOI: 10.1001/jama.295.6.655. PMID: 16467234.
- ↑ Fats and Cholesterol: Out with the Bad, In with the Good – What Should You Eat? – The Nutrition Source – Harvard School of Public Health. [dostęp 2009-05-12]. [zarchiwizowane z tego adresu (2012-09-19)].
Bibliografia
- Lubert Stryer, Jeremy M. Berg, John L. Tymoczko: Biochemistry. Wyd. 6. San Francisco: W.H. Freeman, 2007. ISBN 0-7167-8724-5. (ang.)
- NV Bhagavan: Medical Biochemistry. San Diego: Harcourt/Academic Press, 2002. ISBN 0-12-095440-0. (ang.)
- TM Devlin: Textbook of Biochemistry: With Clinical Correlations. Wyd. 4th. Chichester: John Wiley & Sons, 1997. ISBN 0-471-17053-4. (ang.)
- KE van Holde, CK Mathews: Biochemistry. Wyd. 2. Menlo Park, Calif: Benjamin/Cummings Pub. Co, 1996. ISBN 0-8053-3931-0. (ang.)
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: en:User:Lmaps and User:TimVickers, Licencja: CC BY-SA 3.0
Structure of the (3-deoxy-D-manno-octulosonic acid)2 Lipid A endotoxin from E. coli K-12
Cross section of the different structures that phospholipids can take in a aqueous solution. The circles are the hydrophilic heads and the wavy lines are the fatty acyl side chains.
Structure of Phosphatidyl-ethanolamine