Listeria monocytogenes
| ||
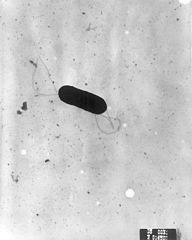 Listeria monocytogenes, obraz z mikroskopu elektronowego. | ||
| Systematyka | ||
| Domena | bakterie | |
| Typ | Firmicutes | |
| Klasa | Bacilli | |
| Rząd | Bacillales | |
| Rodzina | Listeriaceae | |
| Rodzaj | Listeria | |
| Gatunek | Listeria monocytogenes | |
| Nazwa systematyczna | ||
| Listeria monocytogenes (Murray et al. 1926) Pirie 1940 | ||
Listeria monocytogenes – gatunek względnie beztlenowej, wewnątrzkomórkowo żyjącej bakterii, która jest czynnikiem etiologicznym listeriozy. Jest jednym z najbardziej zjadliwych patogenów przenoszonych przez żywność (20 do 30 procent infekcji kończy się śmiercią)[1], na przykład w Stanach Zjednoczonych jest ona odpowiedzialna za około 2500 zachorowań i 500 zgonów rocznie (9,7 przypadków zachorowań na milion mieszkańców)[2], powodując tym samym większą śmiertelność niż salmonella czy Clostridium botulinum[3].
L. monocytogenes jest Gram-dodatnią bakterią nazwaną od nazwiska Josepha Listera. Bakteria korzystając ze swojego urzęsienia wykonuje ruchy w temperaturze 30 °C lub niższej (zazwyczaj nie wykazuje ruchu w 37 °C)[4].
Objawy kliniczne choroby związane z L. monocytogenes są coraz częściej rozpoznawane przez lekarzy weterynarii, szczególnie w przypadku zapalenia opon mózgowych i mózgu u przeżuwaczy.
Badania sugerują, że nawet co dziesiąty ludzki przewód pokarmowy może być zasiedlony przez L. monocytogenes[1].
Ze względu na chorobotwórczość L. monocytogenes związaną z zapaleniem opon mózgowych u noworodków (zakażenie drogą transwaginalną) nie zaleca się kobietom w ciąży spożywania miękkich serów takich jak brie, camembert bądź feta, które mogą być skażone tymi bakteriami[5]. Jest to trzecia z najczęstszych przyczyn zapalenia opon mózgowych u noworodków.
Charakterystyka
L. monocytogenes jest Gram-dodatnią, niesporującą, względnie beztlenową, wykazującą ruch pałeczką[6]. Jest katalazo-dodatnia, oksydazo-ujemna i beta-hemolityczna, przez co niszczy czerwone ciałka krwi. Bakteria oglądana w mikroskopie świetlnym wykazuje charakterystyczny, koziołkowaty ruch[7].
Do rodzaju Listeria zalicza się 6 różnych gatunków (L. monocytogenes, L. ivanovii, L. innocua, L. welshimeri, L. seeligeri i L. grayi). Zarówno L. monocytogenes, jak i L. ivanovii, są chorobotwórcze dla myszy, jednak tylko L. monocytogenes jest bezpośrednio związana z występowaniem choroby u ludzi[8]. Istnieje 13 serotypów L. monocytogenes, które mogą być przyczyną choroby u człowieka, jednak ponad 90% ludzkich izolatów należy jedynie do jednego z trzech serotypów: 1/2a, 1/2b, oraz 4b. Szczepy L. monocytogenes serotypu 4b są odpowiedzialne za 33 do 50% przypadków zachorowań ludzi na świecie oraz za wszystkie główne ogniska choroby w Europie i Stanach Zjednoczonych od lat 80. XX wieku[9][10].
Historia badań
L. monocytogenes opisał po raz pierwszy E.G.D. Murray w 1926 roku opierając się na sześciu przypadkach nagłych zgonów wśród młodych królików[11]. Zanim J.H. Harvey Pirie zmienił w 1940 roku nazwę rodzaju na Listeria, Murray odnosił się do swojego odkrycia jako Bacterium monocytogenes[12]. Pomimo że kliniczne przypadki zakażenia L. monocytogenes u ludzi i zwierząt zostały opisane w latach 20. XX wieku, do 1952 roku w NRD nie były one uznawane za istotną przyczynę sepsy i zakażenia opon mózgowych u noworodków[13]. Występowanie listeriozy u osób dorosłych było następnie kojarzone z obniżoną odpornością wynikającą np. z przyjmowania leków immunosupresyjnych bądź kortykosteroidów oraz u osób zakażonych HIV[14].
Dopiero w 1981 roku L. monocytogenes została uznana za przyczynę chorób przenoszonych drogą pokarmową. Wybuch ogniska listeriozy w Halifaksie w Nowej Szkocji będący powodem zachorowania 41 osób i śmierci 18 (głównie kobiet w ciąży i noworodków) był epidemiologicznie powiązany ze spożyciem surówki z białej kapusty, która była nawożona surowym, zanieczyszczonym listeriami owczym obornikiem[15]. Od tego czasu liczba przypadków zachorowań na listeriozę jest monitorowana, a L. monocytogenes jest obecnie uznawana jako ważne zagrożenie w przemyśle spożywczym[16].
Patogeneza
Zakażenie bakterią L. monocytogenes powoduje listeriozę. Jej główne objawy to sepsa[17], zapalenie opon mózgowo-rdzeniowych[17], zapalenie mózgu[18], wrzód rogówki[19], zapalenie płuc[20] oraz infekcje macicy u ciężarnych kobiet, które mogą prowadzić do poronień (drugi trymestr ciąży) bądź wewnątrzmacicznego obumarcia płodu. Noworodki, które przetrwają matczyną listeriozę mogą cierpieć z powodu upośledzenia fizycznego oraz ziarniniakowatości (granulomatosis infantiseptica) obejmującej całe ciało. Powyższe zaburzenia zazwyczaj poprzedzone są objawami grypopodobnymi, w tym utrzymującą się gorączką. Zaburzenia żołądkowo-jelitowe takie jak nudności, wymioty i biegunka mogą poprzedzać poważniejsze formy listeriozy, lecz mogą być również jedynymi wyrażonymi objawami tej choroby. U około 10% pacjentów patogen atakuje mięsień sercowy, przy czym prawdopodobnie zjadliwość zależy tu od szczepu, a nie od wrażliwości pacjenta[21]. Czas wystąpienia poważnych objawów nie jest dokładnie znany, ale może wahać się od kilku dni do trzech tygodni. Podejrzewa się, że czas po jakim występują dolegliwości ze strony układu pokarmowego nie przekracza 12 godzin. Dawka infekcyjna L. monocytogenes zależy od szczepu i podatności organizmu i waha się od 100 do 1000 komórek[21]. Zakłada się, że w przypadku surowego mleka do wywołania choroby u osoby wrażliwej wystarczy mniej niż 1000 bakterii. Mogą one wnikać do nabłonka jelit, a następnie zasiedlając makrofagi, monocyty bądź granulocyty dostają się do krwi, którą są roznoszone po całym organizmie (sepsa). Obecność bakterii wewnątrz komórek fagocytarnych sprawia, iż mogą się one przedostawać do mózgu oraz prawdopodobnie przenikać poprzez łożysko do płodu ciężarnej kobiety. Patogeneza L. monocytogenes opiera się głównie o zdolność bakterii do przetrwania i namnażania się w komórkach fagocytarnych gospodarza.
W przypadku wewnątrzkomórkowej lokalizacji bakterii dochodzi do indukcji produkcji interferonów typu I w wyniku wytwarzania przez Listerię cyklicznych dwunukleotydów GMP-AMP[22].
Regulacja patogenezy
L. monocytogenes w zależności od warunków środowiskowych w których występuje, może funkcjonować jako organizm saprofityczny bądź patogenny. Gdy bakteria jest obecna w organizmie gospodarza, dzięki mechanizmowi quorum sensing następuje ekspresja kilku genów wirulencji. W zależności od lokalizacji bakterii w organizmie, geny wirulencji regulowane są poprzez różne czynniki. SigB, alternatywny czynnik sigma reguluje geny Vir w jelitach, podczas gdy PrfA (pozytywny regulator transkrypcji A) reguluje ekspresję genów, kiedy bakterie obecne są we krwi[23][24][25][26]. Jak dotąd niewiele wiadomo na temat mechanizmu przełączania się bakterii między aktywnością saprofityczną a patogenną, jednak uważa się, że do wywołania tej zmiany niezbędnych jest kilka niekodujących RNA.
Leczenie
W przypadku wystąpienia zapalenia opon mózgowych i mózgu ogólna śmiertelność może sięgać 70%, przy sepsie 50%, przy zakażeniach okołoporodowych i noworodków powyżej 80%. Zakażenia podczas ciąży są dla matki zazwyczaj niezagrażające życiu. Leczenie obejmuje parenteralne podawanie penicyliny bądź ampicyliny. U osób uczulonych na penicylinę z powodzeniem stosuje się kotrimoksazol.
Użycie jako wektor do transfekcji
Z racji tego, że L. monocytogenes jest bakterią wewnątrzkomórkową, w niektórych badaniach została ona wykorzystana jako wektor do dostarczania genów in vitro. Aktualna skuteczność transfekcji pozostaje dość niska. Jednym z przykładów pomyślnego użycia L. monocytogenes w technologii in vitro jest realizacja terapii genowej w przypadkach zwłóknienia torbielowatego[27].
Szczepionka na raka szyjki macicy
Aktualnie szczepionka na raka szyjki macicy pod nazwą ADXS11-001 z żywych, atenuowanych szczepów L. monocytogenes jest w fazie rozwoju jako potencjalna forma leczenia raka szyjki macicy u kobiet. [28]
Przypisy
- ↑ a b Ramaswamy V, Cresence VM, Rejitha JS, Lekshmi MU, Dharsana KS, Prasad SP, Vijila HM.. Listeria – review of epidemiology and pathogenesis.. „J Microbiol Immunol Infect.”. 40 (1), s. 4–13, 02 2007. PMID: 17332901. [dostęp 2010-09-05].
- ↑ Listeria Monocytogenes. emedicine.medscape.com. [dostęp 2010-11-12].
- ↑ Dharmarha, Vaishali (December 2008). The majority of deaths from Listeria food poisoning are in individuals with compromised immune systems: pregnant women, newborns, the elderly, and the immunosupressed. "A Focus on Listeria Monocytogenes". National Agricultural Library, Food Safety Research Information Office. dostęp 28 stycznia 2009.
- ↑ Gründling, A., Burrack, L. S., Bouwer, H.G.A., Higgins, D.E. 2004. Listeria monocytogenes regulates flagellar motility gene expression through MogR, a transcriptional repressor required for virulence. Proc. Natl. Acad. Sci. USA. 101:12316–12323.
- ↑ Genigeorgis, C.,Carniciu, M., Dutulescu, D., Farver, T.B. 1991. Growth and survival of Listeria monocytogenes in market cheeses stored at 4 to 30 degrees C. J. Food Prot. 54(9):662-668.
- ↑ - Portalwiedzy.onet.pl
- ↑ J. M. Farber, P. I. Peterkin. Listeria monocytogenes, a food-borne pathogen. „Microbiology and Molecular Biology Reviews”. 55 (3), s. 476–511, September 1991. PMID: 1943998.
- ↑ Seafood HACCP Alliance (2007). "Compendium of Fish and Fishery Product Processes, Hazards, and Controls, Chapter 15: Listeria monocytogenes". Seafood Network Information Center. dostęp 28 stycznia 2009.
- ↑ Dharmarha, Vaishali (December 2008). "A Focus on Listeria Monocytogenes". National Agricultural Library, Food Safety Research Information Office. dostęp 28 stycznia 2009.
- ↑ T.J. Ward i inni, Intraspecific Phylogeny and Lineage Group Identification Based on the prfA Virulence Gene Cluster of Listeria monocytogenes, „Journal of Bacteriology”, 15, 186, 2004, s. 4994–5002, DOI: 10.1128/JB.186.15.4994-5002.2004, PMID: 15262937, PMCID: PMC451661.
- ↑ Murray, E.G.D., Webb, R.E., Swann, M.B.R. 1926. A disease of rabbits characterized by a large mononuclear leucocytosis, caused by a hitherto undescribed bacillus Bacterium monocytogenes (n. sp.). J. Pathol. Bacteriol. 29: 407– 439.
- ↑ Harvey, P.J.H. 1940. Listeria: change of name for a genus of bacteria. Nature. 145:264
- ↑ Potel, J. 1952. Zur Granulomatosis infantiseptica. Zentr. Bakteriol. I. Orig. 158: 329-331
- ↑ Schlech, W.F. III. 2001. Foodborne listeriosis. Clin. Infect. Dis. 31: 770-775.
- ↑ Schlech, W.F., Lavigne, P.M., Bortolussi, R.A., Allen, A.C., Haldane, E.V., Wort, A.J., Hightower, A.W., Johnson, S.E., King, S.H., Nicholls, E.S. and Broome, C.V. 1983. Epidemic listeriosis—evidence for transmission by food. New Engl. J. Med. 308:203–206.
- ↑ Ryser, E.T., Marth, E.H. (Eds.) 1999. Listeria, Listeriosis, and Food. Safety, 2nd edn. Marcel Dekker, New York.
- ↑ a b Gray, M. L., and A. H. Killinger. 1966. Listeria monocytogenes and listeric infection. Bacteriol. Rev. 30:309-382.
- ↑ Armstrong, R. W., and P. C. Fung. 1993. Brainstem encephalitis (Rhombencephalitis) due to Listeria monocytogenes: case report and review. Clin. Infect. Dis. 16:689-702.
- ↑ Holland, S., E. Alfonso, . Gelender, D. Heidegger, A. Mendelsohn, S. Ullman, and D. Miller. 1987. Corneal ulcer due to Listeria monocytogenes. Cornea 6:144-146.
- ↑ Whitelock-Jones, L., J. Carswell, and K. C. Rassmussen. 1989. Listeria pneumonia. A case report. South African Medical Journal 75:188-189.
- ↑ a b Olga Orzyłowska-Śliwińska. Wróg czyha w lodówce. „Świat Nauki”. nr 4 (236), s. 21, kwiecień 2011. ISSN 0867-6380.
- ↑ Szczepan Józefowski: Immunoregulacja w chorobach zakaźnych. W: Krzysztof Bryniarski (pod red.): Immunologia. Wrocław: edra, 2017, s. 121. ISBN 978-83-65625-62-5.
- ↑ J. Mengaud i inni, Pleiotropic control of Listeria monocytogenes virulence factors by a gene that is autoregulated, „Molecular Microbiology”, 9, 5, 1991, s. 2273–83, DOI: 10.1111/j.1365-2958.1991.tb02158.x, PMID: 1662763.
- ↑ M. Leimeister-Wachter. Identification of a Gene that Positively Regulates Expression of Listeriolysin, the Major Virulence Factor of Listeria monocytogenes. „Proceedings of the National Academy of Sciences”. 87, s. 8336–40, 1990. DOI: 10.1073/pnas.87.21.8336. PMCID: PMC54950.
- ↑ M. R. Garner, B. L. Njaa, M. Wiedmann, K. J. Boor. Sigma B Contributes to Listeria monocytogenes Gastrointestinal Infection but Not to Systemic Spread in the Guinea Pig Infection Model. „Infection and Immunity”. 74 (2), s. 876–86, 2006. DOI: 10.1128/IAI.74.2.876-886.2006. PMID: 16428730. PMCID: PMC1360341.
- ↑ Pierre Mandin i inni, VirR, a response regulator critical for Listeria monocytogenes virulence, „Molecular Microbiology”, 5, 57, 2005, s. 1367–80, DOI: 10.1111/j.1365-2958.2005.04776.x, PMID: 16102006.
- ↑ S Krusch i inni, Listeria monocytogenes mediated CFTR transgene transfer to mammalian cells., „The journal of gene medicine”, 6, 4, 2002, s. 655–67, DOI: 10.1002/jgm.313, PMID: 12439857.
- ↑ Fran Lowry. Live Listeria Vaccine Proves Safe Against End-Stage Cervical Ca in Human Trial. „Ob.Gyn. News Vol.43, No.10, page 2”, 05-15-2008.
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Electron micrograph of a flagellated Listeria monocytogenes bacterium, Magnified 41,250X. Listeria monocytogenes is the infectious agent responsible for the food borne illness Listeriosis. In the United States, an estimated 2,500 persons become seriously ill with listeriosis each year. Of these, 500 die. Typical size of Listeria: rods 0.4 by 1 to 1.5 µm

