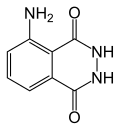
Luminol
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C8H7N3O2 | ||||||||||||||||||||||||||||||||||||||||||||||
| Masa molowa | 177,16 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | żółte igły[1] | ||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | 521-31-3 | ||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 10638 | ||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||


Luminol – organiczny związek chemiczny, hydrazyd kwasu ftalowego z grupą aminową w pierścieniu aromatycznym. Jest to substancja wykazująca chemiluminescencję związaną z utlenianiem luminolu w środowisku alkalicznym, w obecności określonych utleniaczy i aktywatorów jak np. heksacyjanożelazian(III) potasu K
3[Fe(CN)
6][3] czy siarczan miedzi CuSO
4[4]. Barwa emitowanego światła widzialnego zależy od warunków utlenienia (głównie od użytych aktywatorów).
W roztworze wodnym luminolu wydajność kwantowa „świecenia” jest mała, ale w niektórych polarnych rozpuszczalnikach organicznych (np. DMSO lub DMF), wydajność ta może być nawet kilkanaście razy większa i może zachodzić nawet pod wpływem tlenu z powietrza, bez obecności dodatkowego aktywatora[5].
Otrzymywanie
Luminol można otrzymać w wyniku ogrzewania kwasu 3-nitroftalowego z hydrazyną w wysokowrzącym rozpuszczalniku np. glicerolu. W wyniku reakcji kondensacji powstaje 3-nitroftalhydrazyd, który następnie poddaje się reakcji z ditionianem(III) sodu Na
2S
2O
4 w celu redukcji grupy nitrowej do grupy aminowej otrzymując luminol[6].
Zastosowania
| Ta sekcja od 2016-02 wymaga zweryfikowania podanych informacji. |
Luminol stosowany jest w kryminalistyce. Pozwala na ilościowe chemiluminescencyjne oznaczenie DNA. Ponadto stosowany jest również do oznaczania bardzo małych próbek ludzkiego DNA z włosów, plamek krwi, skrawków tkanek. Odnajdywanie śladów krwi jest możliwe dzięki spryskaniu podejrzanych miejsc roztworem luminolu z dodatkiem substancji utleniającej. Żelazo związane w hemoglobinie zadziała jak aktywator i będzie można zaobserwować świecące ślady krwi[7]. Nawet jeśli miejsce było intensywnie sprzątane, świecące ślady mają dokładnie taki sam kształt jak dawno nieobecne ślady krwi. Luminol reaguje też z innymi wydzielinami. Ale na podstawie kształtu śladów, można ustalić czy była to krew z ran, w konkretny sposób zadanych. Uciążliwą wadą tej metody jest niszczenie wykrywanego DNA, co uniemożliwia ustalenie tożsamości ofiary.
Luminol może być związkiem karcynogennym.
Przypisy
- ↑ a b c d CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, s. 3-18, ISBN 978-1-4822-0867-2 (ang.).
- ↑ Luminol – Material Safety Data Sheet (ang.). ScienceLab. [dostęp 2016-02-20].
- ↑ Marek Ples: Chemiluminescencja luminolu aktywowana żelazicyjankiem. Weird science. [dostęp 2014-10-21].
- ↑ Marek Ples: Chemiluminescencja luminolu aktywowana miedzią. Weird science. [dostęp 2014-10-21].
- ↑ Marek Ples: Chemiluminescencja luminolu w rozpuszczalniku organicznym. Weird science. [dostęp 2014-10-21].
- ↑ Ernest Huntress, Lester Stanley, Almon Parker. The Preparation of 3-Aminophthalhydrazide for Use in the Demonstration of Chemiluminescence. „J. Am. Chem. Soc”. 56, s. 241–242, 1934. DOI: 10.1021/ja01316a077 (ang.).
- ↑ „Efektowne Doświadczenia Chemiczne” pod red. M. Molskiego, Poznań 2007.
Media użyte na tej stronie
diagram showing the chemical synthesis of luminol
Autor: Adam Kozak, Licencja: CC BY-SA 4.0
Świecenie luminolu w teście na obecność krwi. Weekendowe zajęcia w laboratorium biologicznym, Centrum Nauki Kopernik w Warszawie.Fot Adam Kozak
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: David Muelheims (David Mülheims, Germany), Licencja: CC BY-SA 2.5
Chemoluminescence with Luminol
Autor: Antek123, Licencja: CC BY-SA 4.0
Roztwór luminolu w DMF z dodatkiem wodorotlenku potasu, świecący pod wpływem tlenu z powietrza.
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.