Malaria
| malaria, plasmodiosis | |
 | |
| ICD-10 | B50 |
|---|---|
| ICD-10 | B51 |
| ICD-10 | B52 |
| ICD-10 | B53 |
| ICD-10 | B54 |
Malaria, zimnica (śrdw. wł. mala aria ‘złe powietrze’; łac. malaria, plasmodiosis, dawne nazwy: febra z łac. febris = gorączka i paludyzm) – ostra lub przewlekła, tropikalna choroba pasożytnicza, której różne postacie wywoływane są przez jeden lub więcej z pięciu gatunków jednokomórkowego pierwotniaka z rodzaju Plasmodium:
- zarodźca ruchliwego (Plasmodium vivax);
- zarodźca pasmowego (Plasmodium malariae);
- zarodźca sierpowatego (Plasmodium falciparum);
- zarodźca owalnego (Plasmodium ovale);
- zarodźca małpiego (Plasmodium knowlesi).
Wyniki najnowszych badań wykazały, że występujący w Azji Południowo-Wschodniej zarodziec małpi, który – jak wcześniej sądzono – jest chorobotwórczy przede wszystkim dla małp, może także prowadzić do zarażeń u człowieka[1]. Jego cechy podobne są do zarodźca malarycznego, ale przebieg zachorowania jest ciężki i zbliżony do zarodźca sierpowatego.
U człowieka najczęściej dochodzi do zarażeń zarodźcem ruchliwym i sierpowatym, przy czym ten ostatni powoduje najcięższą postać choroby i stosunkowo najczęściej prowadzi do zgonu.
Inne gatunki z rodzaju Plasmodium zarażają zwierzęta.
Wektorem malarii przenoszącym ją między osobami chorymi i zdrowymi są samice komarów z rodzaju Anopheles.
Jest to najczęstsza na świecie choroba zakaźna, na którą co roku zapada ponad 220 mln osób, a umiera 1–3 mln (są to głównie dzieci poniżej 5 roku życia z Czarnej Afryki)[2]. Szacuje się, że w roku 2016 zachorowało na malarię 216 milionów osób, to jest o 5 milionów osób więcej w porównaniu z rokiem 2015[3].
Zachorowania poza terenami tropikalnymi i subtropikalnymi endemicznego występowania tej choroby spotykane są u osób powracających z tych regionów, a także sporadycznie w pobliżu lotnisk i portów, gdzie zostają zawleczone komary z rodzaju Anopheles.
Epidemiologia
Malaria występuje w ponad stu krajach strefy tropikalnej i subtropikalnej; narażonych na zachorowanie jest około 1 miliard ludzi.
Zarodźce wymagają do pełnego cyklu rozwojowego 2 żywicieli: człowieka, który jest żywicielem pośrednim (dochodzi w nim do rozmnażania bezpłciowego pierwotniaka) i komara z rodzaju Anopheles, który jest żywicielem ostatecznym (w nim zachodzi rozmnażanie płciowe). To zakażeni ludzie są rezerwuarem czynnika chorobotwórczego – zarodźca malarycznego. Wektorem malarii jest ok. 80 różnych gatunków komarów z rodzaju Anopheles (m.in. widliszek).
Do zakażenia dochodzi, kiedy żywiące się krwią ludzką zakażone samice komarów z rodzaju Anopheles wraz ze śliną do organizmu człowieka wprowadzają sporozoity zarodźca. Do zakażenia może dochodzić także przez transfuzje krwi, zakażone igły i strzykawki oraz z kobiety w ciąży na płód przez łożysko. Gametocyty od osoby chorującej na malarię dostają się do organizmu samicy komara, gdzie w ciągu 8–35 dni przechodzą cykl rozwojowy, w przebiegu którego powstają sporozoity. Przy ukąszeniu komara sporozoity dostają się do krwi człowieka.
Występowanie zimnicy zależy od zasięgu występowania komarów przenoszących pasożyta, od zasięgu występowania Plasmodium, a te zależne są od złożonych czynników środowiskowych, biologicznych i społeczno-politycznych, a także od zapoczątkowanego przez WHO w 1953 roku programu masowego zwalczania malarii.
Ze względu na korzystne dla komarów Anopheles warunki rozwoju do rozprzestrzeniania się malarii dochodzi przede wszystkim w rejonach, gdzie temperatura powietrza wynosi 16–33 °C, a średnia wilgotność względna wynosi powyżej 60%. W temperaturze powietrza poniżej 10 °C larwy komarów nie rozwijają się, a przy temperaturach 10–16 °C rozwijają się wolniej i wykazują mniejszą żywotność. Ze względu na niższą temperaturę i wilgotność powietrza do zakażeń malarią rzadko dochodzi na wysokościach powyżej 2000–2500 m n.p.m.
Samice komarów pobierają pokarm od zmierzchu do świtu, a miejsca ich rozmnażania znajdują się głównie w rejonach wiejskich. Chociaż w niektórych krajach ryzyko zachorowania w miastach jest bardzo małe, to np. w Afryce Subsaharyjskiej jest znaczące.
U dużej części Afrykanów występuje odporność na zakażenia P. vivax, co jest spowodowane tym, że ich erytrocyty nie posiadają układu grupowego Duffy, który jest konieczny do zapoczątkowania ich inwazji przez ten gatunek zarodźca. Rozwój zarodźców w erytrocytach jest także utrudniony u pacjentów z hemoglobiną S, hemoglobiną C, hemoglobiną E, talasemią, niedoborem dehydrogenazy glukozo-6-fosforanowej i niektórymi typami owalocytozy.
W rejonach wysokiej zachorowalności infekcje u dzieci są powszechne i powodują wysoką śmiertelność, lecz po jej kilkukrotnym przechorowaniu u progu dorosłości najczęściej wytwarza się częściowa odporność o zróżnicowanym stopniu, niemniej nadal możliwe są ponowne zarażenia, aczkolwiek przebieg ich zwykle nie jest już cieżki. Jednakże po emigracji ze strefy malarycznej częściowa ochrona immunologiczna przeciw malarii zanika po około 2 latach, o czym często nie wiedzą lub zapominają emigranci odwiedzający krewnych lub przyjaciół w kraju pochodzenia.
Etiologia
Malaria jest wywoływana przez pierwotniaki z rodzaju Plasmodium. U człowieka są to cztery gatunki: P. falciparum, P. malariae, P. ovale i P. vivax. Ten ostatni jest najczęstszym czynnikiem etiologicznym malarii w skali światowej, odpowiadając za około 80% zachorowań. Jednak P. falciparum uważany jest za istotniejszy patogen, wprawdzie odpowiedzialny tylko za 15% zachorowań, ale aż za 90% zgonów[4]. Pasożytnicze gatunki z rodzaju Plasmodium zarażają też ptaki, gady, małpy i gryzonie[5]. Udokumentowano przypadki zarażeń człowieka gatunkami typowo wywołującymi chorobę u małp, mianowicie P. knowlesi, P. inui, P. cynomolgi[6], P. simiovale, P. brazilianum, P. schwetzi i P. simium; znaczenie epidemiologiczne tych infekcji jest jednak bardzo ograniczone. Ptasia zimnica może być śmiertelna dla kur i indyków, ale nie przyczynia się do ekonomicznych strat u hodujących te ptaki. Jej zawleczenie na Hawaje przyczyniło się jednak do poważnego zagrożenia występującej tam endemicznej awifauny[7].
Cykl rozwojowy zarodźca u człowieka
W cyklu rozwojowym zarodźców występuje 2 żywicieli:
- żywiciel ostateczny – komar z rodzaju Anopheles,
- żywiciel pośredni – człowiek.
Ogólny schemat cyklu rozwojowego przedstawicieli rodzaju Plasmodium powodujących malarię u człowieka jest identyczny, różnice pomiędzy poszczególnymi gatunkami są niewielkie.
Sporozoity zarodźca dostają się do krwi. Część z nich zostaje zniszczona przez leukocyty, ale wiele z biegiem krwi dostaje się do wątroby. W ciągu ok. 30 minut sporozoity znikają z krwi. W komórkach wątroby (hepatocytach) w ciągu 1-3 tygodni przebiega dalsza faza rozwojowa, tzn. pozakrwinkowa faza rozwojowa (schizogonia pozakrwinkowa). Sporozoity zmieniają swój kształt, tworząc formę schizonta. Schizonty dzielą się wielokrotnie, przekształcają się i ostatecznie pękają, uwalniając 2–40 tys. merozoitów, które uwalniane są do krwi. Proces ten w zależności od gatunku zarodźca trwa 5–21 dni, lecz w wypadku P. vivax i P. ovale schizogonia pozakrwinkowa może być opóźniona nawet do 1–2 lat – takie „uśpione” formy pierwotniaka nazywane są hypnozoitami. Z tego względu mogą występować późne nawroty malarii. Chociaż zjawisko takie nie występuje w przypadku P. falciparum i P. malariae, to występuje u nich przewlekła faza choroby we krwi, co powoduje nawroty w ciągu kilku lat (P. falciparum) lub nawet kilkanaście (P. malariae).
Merozoity zaczynają atakować czerwone krwinki i w wyniku ich działania dochodzi do rozpadu erytrocytów, co powoduje wystąpienie objawów chorobowych typowych dla malarii. W erytrocytach zachodzi albo proces schizogonii krwinkowej, kiedy powstają w dużej liczbie schizonty lub wytwarzane są stosunkowo nieliczne gametocyty (rozmnażanie płciowe zarodźca), które z pobieraną krwią mogą zarażać samice komara z rodzaju Anopheles. W przewodzie pokarmowym samicy komara tworzą one gamety, a po zapłodnieniu zygotę. Zygota przekształca się w oocystę, w której powstaje do ok. 10 tys. sporozoitów. Gdy oocysta pęka, sporozoity przemieszczają się do jamy ciała, a stamtąd do gruczołów ślinowych. Proces powstawania zakaźnych dla człowieka form inwazyjnych trwa 2-3 tygodnie.
Cechami wspólnymi tych pierwotniaków są schizogoniczny podział w hepatocytach (stadia trofozoita i schizonta) oraz w erytrocytach (stadium pierścienia, schizonta, merozoita) oraz podział gamogoniczny (gamety, ookineta) i sporogoniczny (sporocysta, sporozoity) w organizmie komara.
| Porównanie przebiegu malarii spowodowanej różnymi gatunkami zarodźca | |||
|---|---|---|---|
| Gatunek | Okres wylęgania | Postać choroby | Periodyczność gorączki |
| P. falciparum | 7–30 dni (90%) dłużej (10%)* | Malaria tropikalna | Brak regularności |
| P. malariae | 16–50 dni | Czwartaczka | 72 h |
| P. ovale | 12–18 dni, dłużej(10%)* | Trzeciaczka | 48 h |
| P. vivax | 12–18 dni, dłużej(10%)* | Trzeciaczka | 48 h |
* przy wcześniejszym zastosowaniu chemioprofilaktyki
Objawy kliniczne i przebieg
Objawy choroby występują po okresie wylęgania, który wynosi zwykle: dla zarodźca sierpowatego 7–14 dni, 7–30 dni dla zarodźca pasmowego i 8–14 dni dla zarodźca ruchliwego i owalnego. Pierwsze objawy są niecharakterystyczne – choroba rozpoczyna się dreszczami i wysoką gorączką (nawet ponad 40 °C), którym towarzyszą bóle głowy, nudności, wymioty, niekiedy biegunka, w końcowym okresie napadu pojawiają się obfite poty i następuje gwałtowne obniżenie temperatury ciała. Napady gorączki pojawiają się co 24 godziny (w zakażeniu zarodźcem małpim), 48 godzin w przypadku malarii nazywanej łagodną trzeciaczką (wywołanej przez zarodźca ruchliwego lub owalnego) lub co 72 godziny (w przypadku malarii wywołanej przez zarodźca pasmowego, zwanej czwartaczką), zarażenie zarodźcem sierpowatym wywołuje gorączkę nieregularną lub ciągłą, występującą co około 36–48 godzin; nazywane jest malarią tropikalną lub złośliwą trzeciaczką[8][9]. Jednak nie we wszystkich przypadkach, szczególnie na początku zachorowania, przebieg gorączki ma tak „klasyczny” przebieg.
Objawy spowodowane są niszczeniem przez pierwotniaka erytrocytów i w mniejszym stopniu odczuwalne, uszkadzaniem hepatocytów. Efektem rozpadu erytrocytów jest niedokrwistość hemolityczna, żółtaczka i hemoglobinuria.
Inne objawy to: bóle mięśniowe, bóle kręgosłupa, zaburzenia świadomości, objawy neurologiczne, kaszel i duszność. Mogą występować objawy ze strony układu pokarmowego, takie jak nudności, wymioty, ból brzucha, biegunka i brak apetytu[10].
Atypowy przebieg i objawy chorobowe mogą występować u osób, które uzyskały częściową odporność lub wcześniej stosowały profilaktykę przeciwmalaryczną.
W przypadku inwazji P. ovale i P. vivax choroba lub jej nawroty mogą wystąpić po miesiącach albo latach (pasożyty wytwarzają specjalne formy – hipnozoity).
- Wyniki badań laboratoryjnych
W badaniach laboratoryjnych u pacjentów z objawową malarią stwierdza się wzrost aktywności aminotransferaz, proteinurię, urobilinogenurię, wzrost aktywności LDH w osoczu, wzrost stężenia sorbitolu i jonów Na+.
Powikłania
Powikłania malarii mogą być wczesne i późne.
Do wczesnych należą:
- ciężka niedokrwistość;
- pęknięcie śledziony;
- malaria mózgowa, objawiająca się zaburzeniami przytomności do śpiączki włącznie, objawami ogniskowymi, drgawkami;
- hipoglikemia;
- skaza krwotoczna;
- niewydolność nerek;
- ostra niewydolność oddechowa (obrzęk płuc albo ARDS);
- wstrząs.
Późne powikłania:
- nadreaktywny zespół malaryczny z hipersplenizmem (zespół splenomegalii tropikalnej);
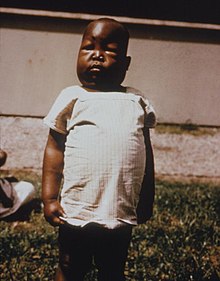
- zespół nerczycowy;
- chłoniak Burkitta;
- zwłóknienie wsierdzia.
Patogeneza
W przypadku choroby wywołanej przez zarodźca pasmowatego stwierdzono trzy mechanizmy patogenetyczne:
Niedotlenienie tkanek jest wynikiem rozpadu krwinek czerwonych, spowodowanym zarażeniem pasożyta, w mechanizmach autoimmunologicznych, z powodu hipersplenizmu i masywnej hemolizy. Czynnik martwicy nowotworów powoduje supresję erytropoezy. Sekwestracja płytek polega na zlepianiu się erytrocytów i trombocytów ze sobą oraz przyleganiu ich do śródbłonka. Sekwestracja może prowadzić do zamykania drobnych naczyń, uszkodzenia ich ściany i martwicy; to z kolei prowadzi do zmian narządowych, takich jak rozlane symetryczne zapalenie mózgu, martwica kłębuszków nerkowych, uszkodzenie wątroby.
Rozpoznanie
Podejrzenie zimnicy można powziąć na podstawie objawów chorobowych u osoby mieszkającej lub powracającej z terenów endemicznego jej występowania. Czasem prawidłowe rozpoznanie jest opóźnione ze względu na mylenie objawów zimnicy z innymi chorobami gorączkowymi.
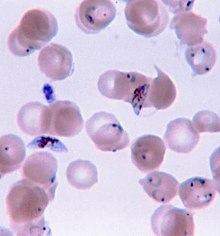
Laboratoryjnym potwierdzeniem rozpoznania są badania mikroskopowe preparatów krwi obwodowej barwionych metodą Giemsy: tzw. gruba kropla pozwalająca na wykrywanie zarodźców wewnątrz krwinek czerwonych celem ustalenia rozpoznania i oceny parazytemii, uzupełniona o tzw. cienki rozmaz pozwalający na ocenę gametocytów zarodźca celem ustalenia jego gatunku. Alternatywną metodą wykrycia pasożytów jest koncentracja krwinek w rurkach hematokrytowych.
Dostępne są też testy bibułowe na obecność antygenów P. falciparum, choć niektóre jego szczepy wykształciły mutacje w genach kodujących wykrywane antygeny, przez co możliwe są wyniki fałszywie ujemne, z kolei niektóre choroby (zwłaszcza układowe choroby tkanki łącznej) mogą dawać wyniki fałszywie dodatnie. Z powyższych względów wyniki testów antygenowych powinny zawsze zostać zweryfikowane badaniami mikroskopowymi.
Wybrane laboratoria dysponują możliwościami wykrycia oraz określenia gatunku pasożyta metodą PCR, a w pojedynczych ośrodkach referencyjnych – także określenia lekooporności.
| Porównanie morfologii gatunków zarodźca wywołujących malarię u człowieka (według CDC[11]) | |||
|---|---|---|---|
| Gatunek | Stadia obecne we krwi | Wygląd erytrocytu | Morfologia pasożyta |
| Plasmodium falciparum | Pierścień | Prawidłowy; więcej niż w infekcjach innymi gatunkami krwinek zawiera pasożyta | Delikatna cytoplazma; 1-2 małe grudki chromatyny; okazjonalnie postaci appliqué |
| Trofozoit | Prawidłowy; rzadko, szczeliny Maurera* | Rzadko obserwowane w krwi obwodowej; zbita cytoplazma; ciemny barwnik | |
| Schizont | Prawidłowy; rzadko, szczeliny Maurera* | Rzadko obserwowane w krwi obwodowej; dojrzałe = 8-24 małych merozoitów; ciemny barwnik, zgromadzony w jednym miejscu | |
| Gametocyt | Zniszczony przez pasożyta | Księżycowaty lub kiełbaskowaty kształt; chromatyna zbita w jedną grudkę (makrogametocyt) lub rozproszona (mikrogametocyt); ziarna ciemnego barwnika | |
| Plasmodium vivax | Pierścień | Prawidłowy-powiększony do 0,25×; okrągły; okazjonalnie plamki Schüffnera; nierzadko masywna infekcja licznych erytrocytów | Obfita cytoplazma, niekiedy pseudopodia; duża grudka chromatyny |
| Trofozoit | Powiększony do 0,5-2×, może być uszkodzony; plamki Schüffnera | Obfita cytoplazma i ameboidalny wygląd; obfita chromatyna; drobne ziarna żółtawobrązowego barwnika | |
| Schizont | Powiększony do 0,5-2×, może być uszkodzony; plamki Schüffnera | Duży, może niemal całkiem wypełniać erytrocyt; dojrzałe = 12-24 merozoitów; zółtawobrązowy, zbity pigment | |
| Gametocyt | Powiększony 0,5-2×; może być uszkodzony; plamki Schüffnera | Okrągły lub owalny; zbity; może całkiem wypełniać wnętrze krwinki czerwonej; chromatyna zbita, rozmieszczona ekscentrycznie (makrogametocyt) lub rozproszona (mikrogametocyt); rozrzucone ziarna brązowego barwnika | |
| Plasmodium ovale | Pierścień | Normalny lub powiększony do 0,25×; okrągły lub owalny; okazjonalnie plamki Schüffnera; niektóre z postrzępionym brzegiem; nierzadko masywna inwazja erytrocytów | Gęsta cytoplazma; obfita chromatyna |
| Trofozoit | Normalny lub powiększony do 0,25×; okrągły lub owalny; niektóre z postrzępionym brzegiem; plamki Schüffnera | Zbite, z obfitą chromatyną i ciemnobrązowym barwnikiem | |
| Schizont | Normalny lub powiększony do 0,25×; okrągły lub owalny; niektóre z postrzępionym brzegiem; plamki Schüffnera | Dojrzałe = 6-14 merozoitów z dużymi jądrami, otoczonych ciemnobrązowym barwnikiem | |
| Gametocyt | Normalny lub powiększony do 0,25×; okrągły lub owalny; niektóre z postrzępionym brzegiem; plamki Schüffnera | Okrągłe lub owalne; mogą całkiem wypełniać erytrocyt; chromatyna zbita, ekscentrycznie (makrogametocyt) lub bardziej równomiernie rozproszona (mikrogametocyt); rozsiane ziarna brązowego barwnika | |
| Plasmodium malariae | Pierścień | Normalny lub powiększony do 0,75× | Gęsta cytoplazma; obfita chromatyna |
| Trofozoit | Normalny lub powiększony do 0,75×; rzadko, kropkowanie Ziemanna* | Zbita cytoplazma; obfita chromatyna; okazjonalnie postaci pasmowate; gruboziarnisty brązowy barwnik | |
| Schizont | Normalny lub powiększony do 0,75×; rzadko, kropkowanie Ziemanna* | Dojrzałe = 6-12 merozoitów z dużymi jądrami, otoczonych ciemnobrązowym gruboziarnistym barwnikiem; niekiedy rozetki | |
| Gametocyt | Normalny lub powiększony do 0,75×; rzadko, kropkowanie Ziemanna* | Okrągłe lub owalne; mogą całkiem wypełniać erytrocyt; chromatyna zbita, ekscentrycznie (makrogametocyt) lub bardziej równomiernie rozproszona (mikrogametocyt); rozsiane ziarna brązowego barwnika | |
| * widoczne w specjalnym barwieniu | |||
Różnicowanie
Malaria wymaga diagnostyki różnicowej z innymi zakaźnymi chorobami gorączkowymi np.:
- posocznicą
- gruźlicą,
- durem brzusznym,
- żółtą gorączką,
- dengą,
- leptospirozami,
- grypą,
a także innymi ciężko przebiegającymi chorobami niezakaźnymi, jak:
Leczenie
| Porównanie leków przeciwmalarycznych[12] | ||||||
|---|---|---|---|---|---|---|
| Lek | Koszt ($, 2003) | Liczba dawek | Czas trwania | Zabijane postaci zarodźca | Działania niepożądane | Przeciwwskazania |
| Chlorochina | 0,11 | 3 | 48 h | Schizonty | Zaburzenia pracy przewodu pokarmowego, świąd, zawroty głowy, śmierć w wyniku przedawkowania | Padaczka |
| Sulfadoksyna+pirymetamina | 0,14 | 1 | Pojedyncza dawka | Schizonty | Zespół Stevensa-Johnsona | Ciąża, choroba nerek |
| Chinina | 0,97 | 21 | 7 dni | Schizonty | Tinnitus, zawroty głowy, bóle głowy, gorączka, delirium, nudności | Niedobór G6PD, zapalenie nerwu wzrokowego, ciąża, szumy uszne, plamica małopłytkowa |
| Meflochina | 2,55 | 1 | Pojedyncza dawka | Schizonty | Wymioty, ból głowy, insomnia, koszmary, lęk, psychoza | Depresja, schizofrenia, zaburzenia lękowe, psychozy, zaburzenia rytmu serca |
| Atowakwon+proguanil | 48 | 3 | 48 h | Schizonty | Dyspepsja, ból głowy, zapalenie żołądka | |
| Artemeter+lumefantryna | 9,12 | 6 | 48 h | Schizonty, gametocyty | Zawroty głowy, kołatanie serca | |
| Artesunat+meflochina | 5 | 6 | 48 h | Schizonty, gametocyty | Wymioty, utrata łaknienia, biegunki | Depresja, schizofrenia, zaburzenia rytmu serca |
| Artesunat+sulfadoksyna+pirymetamina | 2,40 | 3 | 48 h | Schizonty, gametocyty | ||
| Artesunat+amodiachina | 2 | 3 | 48 h | Schizonty, gametocyty | ||
| Halofantryna | Dyspepsja, wydłużenie QTc | Zatrzymanie akcji serca | ||||
| Prymachina | 1,68 | 7-14 | 7 dni | Schizonty w tkankach, gametocyty | Dyspepsja, methemoglobinemia, anemia hemolityczna | Ciąża, niedobór G6PD, laktacja |
Przyczynowe leczenie zimnicy zależy od ciężkości choroby, stwierdzonego gatunku i pochodzenia geograficznego pasożyta, wieku pacjenta, leku stosowanego w ramach ewentualnej chemioprofilaktyki podczas pobytu chorego w rejonie endemicznym, ewentualnej ciąży w przypadku kobiet, a także ewentualnej poważnej nadwrażliwości na dany lek lub innych przeciwwskazań do jego stosowania stwierdzonych u chorego.
Podstawowe leki w leczeniu malarii niepowikłanej to doustne tzw. ACTs (terapie skojarzone oparte na artemizyninach), głównie:
Malaria ciężka początkowo musi być leczona dożylnie artesunatem (lub – wyłącznie w przypadku ciężkiej nadwrażliwości na artesunat albo w wyjątkowych, awaryjnych sytuacjach jego braku – mniej skutecznymi lekami zastępczymi: domięśniowym beta-artemeterem albo dożylną chininą) w skojarzeniu z doksycykliną (wyłącznie >12 r.ż.) lub klindamycyną, a po uzyskaniu poprawy leczenie kontynuuje się jednym z doustnych ACTs. Artesunatu i innych pochodnych artemizyniny nie wolno stosować w monoterapii.
W przypadku zarażenia P. vivax lub P. ovale, leczenie powyższe musi zostać uzupełnione o cykl terapii prymachiną celem wyeliminowania z tkanek (głównie z wątroby) hipnozoitów, czyli postaci uśpionych, które pozostawione stwarzałyby ryzyko nawrotu choroby, niekiedy nawet po wielu latach.
W zależności od sytuacji, stosuje się niekiedy także inne leki: chlorochinę (wyłącznie P. vivax, tylko w wybranych rejonach), meflochinę i leki skojarzone inne niż ACTs (atowakwon z prokwanilem, pirymetamina z sulfadoksyną).
Leczeniem zajmować się mogą wyłącznie ośrodki zapewniające dostępność szybkiej diagnostyki oraz utrzymujące zabezpieczenie w odpowiedni dostępny na bieżąco na miejscu zapas leków wymaganych wytycznymi, w szczególności dożylnego artesunatu, który do niedawna dostępny był wyłącznie poprzez import docelowy spoza UE, ale od 2021 r. został dopuszczony do obrotu w UE jego pierwszy i jak dotąd jedyny preparat, irlandzki Artesunate Amivas. W warunkach polskich w praktyce oznacza to, że leczenie zimnicy (zwłaszcza zimnicy tropikalnej P. falciparum o ciężkim przebiegu) powinno być prowadzone w jednej z dwóch referencyjnych klinik medycyny tropikalnej, tj. w Gdyni lub w Poznaniu. Mniej skomplikowanymi przypadkami zajmują się także wybrane ośrodki chorób zakaźnych: w Warszawie, Szczecinie, Łodzi, Krakowie, Białymstoku i we Wrocławiu.
Oporność na leki przeciwmalaryczne
Poważnym problemem wobec odległej perspektywy uzyskania szczepionki przeciw malarii dla podróżujących jest wystąpienie i rozprzestrzenianie się oporności zarodźców na wiele istniejących leków stosowanych w chemioprofilaktyce lub leczeniu malarii.
P. falciparum
Oporność P. falciparum na chlorochinę jest powszechna. Z tego powodu leku tego zupełnie nie wolno już stosować w leczeniu zarażeń P. falciparum ani w profilaktyce malarii w rejonach występowania tego gatunku.
| Mechanizmy oporności Plasmodium falciparum na leki przeciwmalaryczne[12] | ||||||
|---|---|---|---|---|---|---|
| Zmutowany gen | Produkt genu | Miejsce/typ mutacji | Lek | |||
| PFCRT | Transporter | Thr76 | Chlorochina | |||
| PFMDR1 | Transporter | Tyr86 | Chlorochina Meflochina Chinina Dihydroartemizyna | |||
| PFDHPS | Syntetaza dihydropteroinianu | Gly437, Glu540, Gly581 | Sulfadoksyna | |||
| PFDHFR | Reduktaza dihydrofolianu | Asn108, Arg59, Ile51, Leu164 | Pirymetamina | |||
| PFCYTB | Cytochrom b | Ser268 | Atowakwon | |||
| PFKELCH13 | Artemizyniny | |||||
Oporność na chlorochinę stwierdzono po raz pierwszy pod koniec lat 50. XX wieku w Kolumbii i Tajlandii. Następnie oporność stwierdzano także w innych krajach Ameryki Południowej i południowo-wschodniej Azji. Sytuacja stała się jeszcze bardziej poważna po stwierdzeniu występowania oporności także w Afryce (po raz pierwszy w Kenii w 1979 r.). W następnych latach stwierdzono rozprzestrzenianie się oporności najpierw w Afryce wschodniej, potem w całej Afryce subsaharyjskiej.
Ustalono, że oporność P. falciparum na chlorochininę i niektóre inne środki przeciwmalaryczne jest wywoływana przez mutację jednego genu (pfcrt).
Szczególnie niepokojącą sytuacją jest pojawienie się szczepów o zmniejszonej wrażliwości na artemizyniny w Subregionie Większego Mekongu (szczególnie Kambodży). Wiązana jest ona z mutacją w genie Pfkelch13.
P. vivax
Szczepy P. vivax oporne na chlorochinę zaobserwowano w początkowo Papui-Nowej Gwinei, na Wyspach Salomona, w Birmie oraz w części Indonezji i Indii, obecnie są one rozpowszechnione w wielu rejonach świata[13].
Presja ewolucyjna malarii na ludzki genom
Uważa się, że malaria wywarła największą presję selekcyjną na gatunek ludzki w jego najnowszej historii[14]. Powodem tego jest wysoki współczynnik zachorowalności i śmiertelności, zwłaszcza w chorobie wywołanej przez P. falciparum. Skutkiem presji jest upowszechnienie naturalnych mechanizmów odporności na chorobę na obszarach zagrożenia malarycznego.
Niedokrwistość sierpowatokrwinkowa
Najlepiej zbadany wpływ pasożyta na frekwencję genów w ludzkim genomie ma genetyczna choroba krwi jaką jest niedokrwistość sierpowatokrwinkowa (anemia sierpowata). Chorobę tę wywołuje mutacja w genie HBB kodującym podjednostkę β hemoglobiny. Prawidłowy allel genu koduje glutaminian w pozycji 6 łańcucha β globiny, podczas gdy w niedokrwistości glutaminian zastąpiony jest przez walinę. Zmienia to charakter łańcucha z hydrofilnego na hydrofobowy i sprawia, że cząsteczki hemoglobiny polimeryzują zniekształcając erytrocyty. Krwinki o nieprawidłowym kształcie są szybko usuwane z krążenia i niszczone, przede wszystkim w śledzionie.
Talasemie
Innym dobrze udokumentowanym przykładem presji selekcyjnej na genom ludzki spowodowanej przez malarię są mutacje wywołujące talasemie. Badania przeprowadzone na Sardynii[15] i Papui-Nowej Gwinei wykazały, że częstość mutacji wywołującej β-talasemię zależy od częstości występującej tam endemicznie malarii. Badanie na grupie ponad 500 dzieci w Liberii dowiodło, że dzieci mające mutację wywołującą β-talasemię mają o 50% mniejsze ryzyko zachorowania na objawową malarię[16]. Inne prace potwierdziły istnienie zależności między częstością endemicznej malarii a prewalencją postaci α+ oraz α-talasemii na tych obszarach, co pozwala przypuszczać, że na geny warunkujące te postaci hemoglobinopatii również wywierana była w toku ewolucji ludzkiego genomu presja selekcyjna[17].
Antygeny Duffy
Antygeny Duffy podlegają ekspresji w różnych komórkach ludzkiego organizmu, w tym w erytrocytach, i pełnią funkcje receptorów chemokin. Antygeny Duffy kodowane są przez geny Fy (Fya, Fyb, Fyc itd.). Plasmodium vivax potrzebuje antygenów Duffy, by móc wniknąć do erytrocytu. U niektórych ludzi antygeny Duffy nie podlegają ekspresji w tych komórkach (są Fy−/Fy−). Taki fenotyp zapewnia całkowitą oporność na zarażenie P. vivax. Spotykany jest rzadko u Europejczyków, Azjatów i w populacji amerykańskiej, za to jest bardzo rozpowszechniony wśród rdzennej ludności zachodniej i środkowej Afryki. Uważa się, że jest to skutek wysokiego narażenia na infekcję P. vivax w Afryce na przestrzeni ostatnich kilkuset lat[18].
Niedobór dehydrogenazy glukozo-6-fosforanowej
Dehydrogenaza glukozo-6-fosforanowa (G6PD) jest enzymem zapewniającym ochronę erytrocytu przed stresem oksydacyjnym. Niedobór enzymu, określany też jako fawizm (OMIM+305900), jest częstą chorobą genetyczną o dziedziczeniu sprzężonym z chromosomem X. Wykazano, że nosiciele zmutowanego genu G6PD rzadziej chorują na ciężką postać zimnicy[19].
HLA i interleukina-4
Obecność antygenu HLA-B53 wiąże się z niskim ryzykiem zachorowania na malarię. Ta cząsteczka MHC klasy I prezentuje antygeny wątrobowych postaci zarodźców i sporozoitów komórkom T. Interleukina 4 produkowana przez aktywowane komórki T pobudza proliferację i różnicowanie komórek B wytwarzających przeciwciała. W badaniach przeprowadzonych na Fulanach zamieszkujących Burkina Faso, u których stwierdza się rzadsze zachorowania na ciężką malarię i wyższe niż w sąsiednich plemionach miana przeciwciał przeciwko antygenom zarodźców, stwierdzono związek allelu IL4-524 T z podwyższonym mianem przeciwciał przeciwko antygenom pasożyta; potwierdza to hipotezę o związku HLA-B53 z wrodzoną odpornością na zachorowania[20].
Profilaktyka
Ważne jest stosowanie profilaktyki przy podróżach na tereny endemicznego występowania malarii[21].
Środki niefarmakologiczne
Do środków niefarmakologicznyvh należy stosowanie płynów odstraszających komary (repelentów), stosowanie moskitier naokiennych i nadłóżkowych oraz klimatyzacji, eliminacja komarów wewnątrz pomieszczeń środkami owadobójczymi (insektycydami), ubiór zakrywający kończyny.
Chemioprofilaktyka
Profilaktyka obejmuje także przyjmowanie leków antymalarycznych.
Meflochina jest jednym z najskuteczniejszych leków w zapobieganiu chorobie wywoływanej przez Plasmodium falciparum oporne na chlorochinę, jednak wywołuje liczne działania niepożądane, w szczególności zaburzenia neuropsychiatryczne. W dużych badaniach klinicznych małe dawki meflochiny wykazywały działania niepożądane nie częściej niż chlorochina. W Polsce nie jest dopuszczona do obrotu ani na poziomie krajowym ani ogólnounijnym, przez co dostępna jest wyłącznie poprzez skomplikowaną urzędową procedurę importu docelowego.
Połączenie atowakwonu i proguanilu pod nazwą handlową „Malarone” dostępne jest w niektórych krajach europejskich, w tym w Polsce; skuteczność preparatu jest porównywalna z meflochiną, lek ma też mniej działań niepożądanych[22]. W profilaktyce choroby wywoływanej przez zarodźce wrażliwe na chlorochinę nie zaleca się już stosowania chlorochiny z prymachiną z powodu ryzyka wywołania hemolizy u chorych z niedoborem dehydrogenazy glukozo-6-fosforanowej.
Skutecznym preparatem profilaktycznym jest również doksycyklina, która jednakże nie może być stosowana u dzieci, a ponadto powoduje znaczny wzrost podatności na oparzenia słoneczne, powodując konieczność unikania promieni słonecznych i stosowania kremów blokujących promienie UV, uniemożliwiając w ten sposób opalanie, ponadto w trakcie jej przyjmowania przeciwwskazane jest spożywanie alkoholu oraz spożywanie wraz z lekiem nabiału.
Zwalczanie populacji wektora

W związku ze zsekwencjonowaniem w 2002 roku genomu komara Anopheles gambiae[23] powstały plany stworzenia genetycznie zmodyfikowanego komara opornego na zakażenia przez pierwotniaki.
Szczepionki
Liczne zespoły naukowe pracują nad uzyskaniem skutecznej szczepionki przeciw malarii. Ze względu na pewne cechy cyklu życiowego zarodźca (głównie chodzi o jego wewnątrzkomórkowy rozwój) uzyskanie takiej szczepionki natrafia na różne trudności. Obecnie stosowana jest wyłącznie szczepionka dla dzieci żyjących na terenach malarycznych, nie nadaje się ona jednak do stosowania jako metoda profilaktyczna u podróżujących.
Malaria w Polsce[24]
Terytorium Polski w przeszłości należało do terenów, na których malaria występowała endemicznie. Pierwsze doniesienia o zachorowaniach na malarię pochodzą z XIX wieku. Ważniejsze epidemie malarii stwierdzono w latach: 1846, 1847, 1854–1856, 1873, 1898, 1920–1923 oraz 1946–1949.
W okresie 1921–1925 stwierdzono prawie 16 tysięcy zachorowań. W latach 1921–1926 podjęto pierwszą akcję zwalczania malarii w Polsce. Zaowocowało to tym, że w 1938 zarejestrowano już tylko 316 przypadków tej choroby, wywołanej głównie przez P. vivax.
Poprawę zaobserwowano w latach 50. XX wieku, a uzyskano ją w następstwie prowadzenia od 1945 intensywnej akcji przeciwmalarycznej, prowadzonej przez Naczelny Nadzwyczajny Komisariat do Walki z Epidemiami.
Wyraźny i stały spadek zachorowań na malarię stwierdzano od roku 1950, a od 1956 notowano tylko sporadyczne zachorowania zawleczone z innych krajów.
W roku 1968 Światowa Organizacja Zdrowia uznała Polskę za kraj wolny od zimnicy endemicznej. Aktualnie na terenie Polski zachorowania rodzime nie występują.
Liczba zgłaszanych zachorowań na malarię w latach 1970–1993 wahała się od kilku do ponad 30 rocznie. Były to głównie zachorowania wywołane przez P. vivax i stwierdzane u osób powracających z zagranicy. Zgony były tylko pojedyncze.
W latach 1994–2000 liczba zgłaszanych zachorowań rocznie wahała się od 18 (1994) do 38 (1998). Czynnikiem etiologicznym w większości był P. falciparum. Stwierdzono 7 zgonów.
Nie jest całkowicie wykluczone lokalne szerzenie się w Polsce malarii zawleczonej z zagranicy, ponieważ w Polsce występują powszechnie komary zdolne do jej roznoszenia[25].
Zimnica umieszczona jest w urzędowym wykazie chorób zakaźnych i zakażeń, podlegających zgłaszaniu do jednostek sanitarno-epidemiologicznych[26].
Rys historyczny
W 1880 roku francuski lekarz wojskowy Charles Louis Alphonse Laveran przedstawił hipotezę, że malaria jest wywoływana przez pierwotniaka. Po raz pierwszy stwierdzono, że pierwotniaki mogą powodować chorobę u ludzi. Za swój wkład w medycynę Laveran został w roku 1907 uhonorowany Nagrodą Nobla w dziedzinie medycyny.
Rok później kubański lekarz Carlos Finlay lecząc pacjentów chorujących na żółtą febrę po raz pierwszy zasugerował, że tę chorobę przenoszą komary. Brytyjczyk Ronald Ross w roku 1898 wykazał, że niektóre gatunki komarów przenoszą malarię na ptaki i w roku 1902 uzyskał Nagrodę Nobla w dziedzinie medycyny za opisanie cyklu rozwojowego pasożyta.
Zobacz też
Przypisy
- ↑
 A. Pain, U. Böhme, A.E. Berry, K. Mungall i inni. The genome of the simian and human malaria parasite Plasmodium knowlesi. „Nature”. 455 (7214), s. 799–803, 2008. DOI: 10.1038/nature07306. PMID: 18843368. PMCID: PMC2656934.
A. Pain, U. Böhme, A.E. Berry, K. Mungall i inni. The genome of the simian and human malaria parasite Plasmodium knowlesi. „Nature”. 455 (7214), s. 799–803, 2008. DOI: 10.1038/nature07306. PMID: 18843368. PMCID: PMC2656934. - ↑ Malaria – Disease and Mortality in Sub-Saharan Africa – NCBI Bookshelf.
- ↑ World Health Organization: World Malaria Report 2017. ISBN 978-92-4-156552-3. [dostęp 2017-12-01].Sprawdź autora:1.
- ↑ Mendis K, Sina B, Marchesini P, Carter R. The neglected burden of Plasmodium vivax malaria. „Am J Trop Med Hyg”. 64. 1-2 Suppl, s. 97–106, 2001. PMID: 11425182.
- ↑ Escalante A, Ayala F. Phylogeny of the malarial genus Plasmodium, derived from rRNA gene sequences. „Proc Natl Acad Sci U S A”. 91. 24, s. 11373–11377, 1994. PMID: 7972067. PMCID: PMC45233.
- ↑ Garnham, PCC: Malaria parasites and other haemosporidia. Blackwell Scientific Publications, 1966.
- ↑ Atkinson CT, Woods KL, Dusek RJ, Sileo LS, Iko WM. Wildlife disease and conservation in Hawaii: pathogenicity of avian malaria (Plasmodium relictum) in experimentally infected iiwi (Vestiaria coccinea). „Parasitology”. 111. Suppl, s. 59–69, 1995. PMID: 8632925.
- ↑ Szczeklik i Gajewski 2017 ↓, s. 2411.
- ↑ Dziubek i Duszczyk 2017 ↓, s. 502.
- ↑ Dziubek i Duszczyk 2017 ↓, s. 506.
- ↑ CDC: Comparison of Plasmodium Species Which Cause Human Malaria.
- ↑ a b Baird JK. Effectiveness of antimalarial drugs. „New England Journal of Medicine”. 352. 15, s. 1565–1577, 2005. PMID: 15829537.
- ↑ M. Whitby. Drug resistant Plasmodium vivax malaria. „J Antimicrob Chemother”. 40 (6), s. 749–752, Dec 1997. PMID: 9462425.
- ↑ Sergiusz Prokurat, Economic outcomes of Malaria in South East Asia, „Opportunities for cooperation between Europe and Asia”, Józefów 2015, s. 157–174, ISBN 978-83-62753-58-1 [dostęp 2016-07-28] [zarchiwizowane z adresu 2016-10-07].
- ↑ Luzzatto L. Thalassemia and malaria selection. „Minerva Med”. 72. 10, s. 603–612, 1981. PMID: 7017472.
- ↑ Willcox M, Bjorkman A, Brohult J, Pehrson PO, Rombo L, Bengtsson E. A case-control study in northern Liberia of Plasmodium falciparum malaria in haemoglobin S and beta-thalassaemia traits. „Ann Trop Med Parasitol”. 77. 3, s. 239–246, 1983. PMID: 6354114.
- ↑ Yenchitsomanus PT, Summers KM, Bhatia KK, Cattani J, Board PG. Extremely high frequencies of alpha-globin gene deletion in Madang and on Kar Kar Island, Papua New Guinea. „Am J Hum Genet”. 37. 4, s. 778–784, 1985. PMID: 9556666. PMCID: PMC1684607.
- ↑ Carter R, Mendis KN. Evolutionary and historical aspects of the burden of malaria. „Clin Microbiol Rev”. 15. 4, s. 564–594, 2002. PMID: 12364370. PMCID: PMC126857.
- ↑ Allison AC, Clyde DF. Malaria in African children with deficient erythrocyte glucose-6-phosphate dehydrogenase. „Br Med J”. 1. 5236, s. 1346–1349, 1961. PMID: 13682585. PMCID: PMC1954496.
- ↑ Verra F, Luoni G, Calissano C, Troye-Blomberg M, Perlmann P, Perlmann H, Arcà B, Sirima B, Konaté A, Coluzzi M, Kwiatkowski D, Modiano D. IL4-589C/T polymorphism and IgE levels in severe malaria. „Acta Trop”. 90. 2, s. 205–209, 2004. DOI: 10.1016/j.actatropica.2003.11.014. PMID: 15177147.
- ↑ Sulyok M, Rückle T, Roth A et al. DSM265 for Plasmodium falciparum chemoprophylaxis: a randomised, double blinded, phase 1 trial with controlled human malaria infection. „Lancet Infect Dis.”, 2017 Mar 28. DOI: 10.1016/S1473-3099(17)30139-1. PMID: 28363637. PMCID: PMC5446410. (ang.).
- ↑ de Alencar FE, Cerutti C Jr, Durlacher RR, Boulos M, Alves FP, Milhous W, et al. Atovaquone and proguanil for the treatment of malaria in Brazil. „J Infect Dis”. 175, s. 1544–1547, 1997.
- ↑ Science. 2002 Oct 4;298(5591):129-49.
- ↑ Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny. pzh.gov.pl. [zarchiwizowane z tego adresu (2007-09-28)].
- ↑ WORLD MALARIA REPORT 2005: Global distribution of dominant malaria vectors. [dostęp 2009-06-15]. [zarchiwizowane z tego adresu (2009-06-22)].
- ↑ Ustawa z dnia 6 września 2001 r. o chorobach zakaźnych i zakażeniach Dz.U. z 2001 r. nr 126, poz. 1384.
Bibliografia
- Zdzisław Dziubek, Ewa Duszczyk: Choroby zakaźne i pasożytnicze. Wyd. IV. Warszawa: Wydawnictwo Lekarskie PZWL, 2017, s. 502–514. ISBN 978-83-200-4534-5.
- Andrzej Szczeklik, Piotr Gajewski: Interna Szczeklika 2017. Kraków: Wydawnictwo Medycyna Praktyczna, 2017, s. 2410–2413. ISBN 978-83-7430-517-4.
- Włodzimierz Brühl Vademecum terapii
- Malaria – informacje dla podróżujących na serwerze Światowej Organizacji Zdrowia (PDF) (ang.)
Linki zewnętrzne
- WHO/TDR MALARIA DATABASE. [dostęp 2007-10-20]. [zarchiwizowane z tego adresu (12 września 2004)]. (ang.).
- Malaria. CDC Division of Parasitic Diseases. [dostęp 2007-10-20]. [zarchiwizowane z tego adresu (6 października 2006)]. (ang.).
- Mapy zagrożenia występowaniem malarii – przydatne dla podróżników. [dostęp 2012-02-01]. [zarchiwizowane z tego adresu (2015-03-30)]. (ang.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.A thin-film Giemsa stained micrograph of ring-forms, and gametocytes of Plasmodium falciparum.
From http://phil.cdc.gov/phil/home.asp ID#:5856Komar Anopheles albimanus wysysający krew z ręki człowieka. Stanowi on wektor malarii i dlatego redukcja jego populacji jest bardzo efektywną metodą zapobiegania malarii.
ID#: 1381 Description: Histopathology of malaria exoerythrocytic forms in liver. Histopathology of malaria exoerythrocytic forms in liver. Parasite. Content Providers(s): CDC/Dr. Melvin Creation Date: 1973
Copyright Restrictions: None - This image is in the public domain and thus free of any copyright restrictions. As a matter of courtesy we request that the content provider be credited and notified in any public or private usage of this image.Autor:
- image by Ute Frevert;
- false color by Margaret Shear
Malaria is caused by a parasite (Plasmodium) transmitted to people and animals by mosquitoes of the genus Anopheles. The sporozoite life-stage of the parasite develops inside oocysts and are released in large numbers into the hemocoel of mosquitoes. This false-colored electron micrograph shows a sporozoite of Plasmodium bergei migrating through the cytoplasm of midgut epithelia of an Anopheles stephensi mosquito.
Autor: Radoslaw Botev (original: S. Jähnichen; Roke), Licencja: CC-BY-SA-3.0
Obszary zagrożenia malarycznego
Cykl życiowy zarodźca malarii Plasmodium spp.
(c) Muntuwandi z angielskiej Wikipedii, CC-BY-SA-3.0
based on http://www.understandingrace.org/humvar/sickle_01.html
-not updatedID#: 3894 Description: The edema exhibited by this African child was brought on by nephrosis associated with malaria. Infection with one type of malaria, Plasmodium falciparum, if not promptly treated, may cause kidney failure. Swelling of the abdomen, eyes, feet and hands are some of the symptoms of nephrosis brought on by the damaged kidneys.
Content Providers(s): CDC/Dr. Myron Schultz Creation Date: 1975
Copyright Restrictions: None - This image is in the public domain and thus free of any copyright restrictions. As a matter of courtesy we request that the content provider be credited and notified in any public or private usage of this image.