Marawirok
| Ten artykuł należy dopracować |
| |||||||||||||||||
| |||||||||||||||||
| Ogólne informacje | |||||||||||||||||
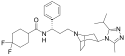
| Wzór sumaryczny | C29H41F2N5O | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 513,67 g/mol | ||||||||||||||||
| Wygląd | biały proszek[2] | ||||||||||||||||
| Identyfikacja | |||||||||||||||||
| Numer CAS | |||||||||||||||||
| PubChem | |||||||||||||||||
| DrugBank | |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||
| ATC | |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
Marawirok (łac. maraviroc) – organiczny związek chemiczny będący silnym, selektywnym, wolno oddysocjowującym inhibitorem receptora CCR5 dla chemokin[6][7], przeznaczony do leczenia chorych zakażonych wirusem HIV-1. Marawirok należy do nowej grupy leków przeciwretrowirusowych – inhibitorów wejścia[8]. Jest skuteczny jedynie w wypadku zakażenia wirusem HIV-1 wykazującym tzw. CCR5-tropizm, czyli takim, który wykorzystuje receptor CCR5 podczas wnikania do komórki. Nie wykazano, by marawirok indukował oporność na inne leki stosowane w leczeniu zakażeń HIV[9].
Historia
Marawirok został wynaleziony przez firmę Pfizer w trakcie szeroko zakrojonych poszukiwań substancji małocząsteczkowych będących tzw. inhibitorami wejścia[10]. Jako że struktura CCR5 nie była wtedy znana, przebadano tysiące związków chemicznych w poszukiwaniu tych, które mogły być inhibitorami CCR5. Spośród znalezionych substancji, do dalszych badań wybrano jedną – UK-107543[1]. Zsyntetyzowano niemal 1000 analogów UK-107543 oraz przebadano je pod kątem siły inhibicji oraz własności farmakologicznych i farmakokinetycznych. Substancją o najlepszych właściwościach okazał się marawirok[11][12].
Mechanizm działania[1][13][14][15]
Na powierzchni wirusa HIV znajdują się dwie glikoproteiny: gp120 i gp41. Każda z nich składa się z 3 podjednostek. Wniknięcie wirusa do komórki inicjowane jest przez połączenie gp120 z receptorem CD4 znajdującym się na powierzchni limfocytów. Powoduje to zmianę konformacji białka gp120, dzięki czemu możliwe jest jego połączenie z receptorem CCR5. Prowadzi to z kolei do zmiany konformacyjnej białka gp41, co umożliwia hydrofobowej domenie odpowiedzialnej za fuzję wirusa z komórką gospodarza penetrację błony komórkowej. Dzieje się tak w wyniku powstawania specyficznego „harpunu” białkowego, składającego się z sześciu spiralnych podjednostek powiązanych ze sobą mostkami disiarczkowymi. Ów „harpun” powoduje utworzenie w błonie komórkowej porów, przez które wirus wnika do komórki. Marawirok, łącząc się z CCR5, powoduje zmianę jego konformacji, co uniemożliwia łączenie się białka gp120 z tym receptorem i, tym samym, blokuje wnikanie wirusa do makrofaga[16]. Inhibicja tego receptora nie pozwala również na przekazywanie sygnałów zapalnych przez cytokiny i inne związki o charakterze chemotaktycznym. Marawirok, stosowany łącznie z innymi lekami przeciwretrowirusowymi, powoduje znaczące zwiększenie skuteczności terapii, mierzone ilością kopii wirusowego RNA/mm³ krwi oraz liczbą leukocytów CD4+.

Oporność
Marawirok jest aktywny jedynie wobec wirusów CCR5-tropowych. Badania in vitro wskazują, że wirusy wykazujące CCR4-tropizm lub tropizm podwójny nie są wrażliwe na lek[18]. W badaniach na hodowlach komórkowych stwierdzono, że wirusy HIV-1 oporne na nukleozydowe inhibitory odwrotnej transkryptazy, nienukleozydowe inhibitory odwrotnej transkryptazy, inhibitory proteazy oraz enfuwirtyd są wrażliwe na marawirok, natomiast te wirusy, które cechowała oporność na marawirok, były wciąż wrażliwe na enfuwirtyd i sakwinawir[19].
Oporność na lek wiąże się ze zmianą tropizmu (przejście na CCR4-tropizm lub tropizm podwójny) lub też z opornością fenotypową[20]. Oporność genotypowa nie została jednoznacznie określona. Wśród chorych, którzy nie odpowiedzieli na leczenie marawirokiem w próbach klinicznych MOTIVATE 1 i MOTIVATE 2, stwierdzono[21]:
- zmianę tropizmu z CCR5 na CCR4 lub tropizm podwójny w ciągu 4–6 tygodni od daty rozpoczęcia leczenia u 7,6% ogólnej liczby pacjentów[22]
- obniżoną wrażliwość wirusa HIV-1 na marawirok (22 osoby)
- nieprzestrzeganie zaleceń lekarza (36 osób)
Przeprowadzone analizy wskazują na to, że przerwanie podawania marawiroku powoduje przejście zmienionych tropowo wirusów z powrotem na CCR5-tropizm[23].
Badania kliniczne
Skuteczność marawiroku (w połączeniu z innymi lekami przeciwretrowirusowymi), wyrażona jako wpływ na poziom RNA wirusa w osoczu oraz liczbę komórek CD4+, była badana na 1076 zakażonych w dwóch trwających badaniach wieloośrodkowych, randomizowanych, z podwójnie ślepą próbą – MOTIVATE 1 i MOTIVATE 2. Do badania zakwalifikowano chorych zakażonych wirusem HIV-1 CCR5-tropowym, co potwierdzono testem Monogram Trofile Assay. Chorzy ci byli wcześniej leczeni co najmniej 3 różnymi lekami przeciwretrowirusowymi lub wykazywali oporność na co najmniej jeden lek z tej grupy. Pacjentów przypisano w sposób losowy w stosunku 2:2:1 do trzech poniższych grup:
- chorzy przyjmujący marawirok w dawce 300 mg raz dziennie,
- chorzy przyjmujący marawirok w dawce 300 mg dwa razy dziennie,
- chorzy przyjmujący placebo i od 3 do 6 leków przeciwretrowirusowych w ramach tzw. optymalnego leczenia podstawowego
Dane zbiorcze z obu badań (MOTIVATE 1 i MOTIVATE 2) przedstawiają się następująco:
| Kryteria | Marawirok + optymalne leczenie podstawowe | Optymalne leczenie podstawowe | Różnica w leczeniu (przedział ufności[25]) |
|---|---|---|---|
| RNA wirusa w log10/ml krwi (zmiana w stosunku do wartości początkowej) | – 1,84 | – 0,78 | – 1,05 (-1,33; -0,78) |
| Liczba pacjentów z RNA wirusa <400 kopii/ml (w %)[26] | 56,1% | 22,5% | Iloraz szans: 4,76 (3,24; 7,001) |
| Liczba pacjentów z RNA wirusa <50 kopii/ml (w %) | 45,5% | 16,7% | Iloraz szans: 4,49 (2,96; 6,83) |
| Liczba komórek CD4+ mierzona liczbą komórek/mm³ (zmiana w stosunku do wartości początkowej)[27] | 124,07 | 60,93 | 63,13 (44,28; 81,99) |
Synteza chemiczna
Synteza chemiczna marawiroku rozpoczyna się od zabezpieczenia atomu azotu w bicyklicznej aminie. Otrzymany związek jest następnie przekształcany w oksym, który poddaje się redukcji do aminy pierwsząrzędowej wobec sodu w alkoholu. Następnie, tak otrzymaną aminę poddaje się szeregowi reakcji chemicznych, mających na celu utworzenie pierścienia triazolowego. Najpierw przeprowadza się acylację aminy chlorkiem kwasowym – pochodną kwasu izomasłowego, otrzymując układ izobutyloamidu, który w reakcji z POCl3 ulega przemianie w chlorową pochodną odpowiedniej iminy. Pochodna ta reaguje z acetylohydrazyną, a tak otrzymany związek ogrzewa się w środowisku kwaśnym otrzymując pierścień triazolowy. Substancję tę redukuje się wodorem, a następnie poddaje reakcji kondensacji ze zredukowaną wcześniej do postaci aldehydu estrową pochodną quasi-dipeptydu, otrzymując tym samym marawirok[28].
Farmakokinetyka[29][30]
Marawirok szybko wchłania się z przewodu pokarmowego, osiągając w ciągu ok. 2 h maksymalne stężenie we krwi. Pokarm zmniejsza Cmax o 33%, jednak nie jest to istotne klinicznie. Lek wiąże się z białkami osocza w około 76%, głównie z albuminami i kwaśną α1-glikoproteiną. Marawirok jest częściowo metabolizowany w wątrobie przy udziale CYP3A4 i wydalany z kałem (76%) i moczem (20%), głównie w postaci niezmetabolizowanej. Okres półtrwania wynosi 13,2 h. Marawirok jest również substratem P-glikoproteiny.

Wskazania
Marawirok jest wskazany, w połączeniu z innymi lekami przeciwretrowirusowymi, w leczeniu dorosłych pacjentów zakażonych wirusem HIV-1 CCR5-tropowym, którzy byli wcześniej poddawani leczeniu przeciwretrowirusowemu[31].
Przeciwwskazania
- nadwrażliwość na marawirok
- alergia na orzeszki ziemne i/lub soję (obecność w preparacie lecytyny sojowej)
Ostrzeżenia specjalne
- Marawirok powinien być stosowany łącznie z innymi lekami przeciwretrowirusowymi, na które wirus wykazuje wrażliwość.
- Przed zastosowaniem marawiroku należy upewnić się, że we krwi pacjenta wykrywalny jest wyłącznie wirus HIV-1 CCR5-tropowy. Tropizm nie może zostać określony na podstawie historii leczenia ani też w oparciu o przechowywane próbki krwi pacjenta[32][33].
- Marawirok może wywoływać niedociśnienie ortostatyczne, szczególnie u chorych leczonych, u których stwierdzono hipotonię w wywiadzie lub którzy są leczeni lekami mogącymi obniżać ciśnienie krwi.
- Marawirok może osłabiać odpowiedź immunologiczną. Należy wziąć to pod uwagę w przypadku pacjentów z gruźlicą lub inwazyjnymi infekcjami grzybiczymi.
- Należy zachować szczególną ostrożność w przypadku chorych z ciężkimi chorobami sercowo-naczyniowymi, którzy są leczeni marawirokiem.
- Pacjenci zakażeni wirusem HIV, u których występuje znaczny niedobór immunologiczny w momencie wprowadzenia leczenia przeciwretrowirusowego, są narażeni na wystąpienie zespołu reaktywacji immunologicznej w odpowiedzi na bezobjawowe lub szczątkowe zakażenie oportunistyczne. Wynikiem tego mogą wystąpić ciężkie stany kliniczne lub zaostrzenie istniejących już objawów. Należy przez pierwsze tygodnie leczenia obserwować pacjentów i, w razie potrzeby, wdrożyć odpowiednie leczenie.
- Skojarzone leczenie przeciwretrowirusowe może być jednym z czynników sprzyjających występowaniu martwicy kości. Należy poinformować pacjenta, aby zgłosił się do lekarza w przypadku pojawienia się bólów, sztywności stawów lub trudności w poruszaniu się.
- Istnieją doniesienia o kilku przypadkach ciężkiej hepatotoksyczności wywołanej przez marawirok. Należy zachować ostrożność stosując marawirok u pacjentów z niewydolnością wątroby, gdyż lek może nasilać objawy choroby. W przypadku pogorszenia stanu chorego, marawirok należy odstawić i wdrożyć odpowiednie leczenie[34][35].
Interakcje[36]
Jako że marawirok jest substratem izoenzymu CYP3A4 cytochromu P-450, wchodzi w interakcje z lekami mającymi powinowactwo do tego izoenzymu. Dawkę marawiroku należy zwiększyć w przypadku łącznego podawania z efawirenzem i ryfampicyną[37]. Dawkę leku należy zmniejszyć, gdy podawane są jednocześnie następujące substancje[38]:
- atazanawir
- rytonawir (sam, jak i w preparatach złożonych, z wyjątkiem połączeń rytonawiru z fosamprenawirem i typranawirem)
- lopinawir
- sakwinawir
- darunawir
- nelfinawir
- indynawir
- ryfabutyna
- klarytromycyna
- telitromycyna
- ketokonazol i itrakonazol (ale nie flukonazol, ze względu na umiarkowaną inhibicję CYP3A4)
Nie zaleca się stosowania preparatów z dziurawca w trakcie leczenia marawirokiem, gdyż obniżają jego stężenie we krwi[39].
Działania niepożądane[40]
Do najczęściej występujących działań niepożądanych należą:
- nudności, wymioty, bóle brzucha, wzdęcia, niestrawność i zaparcia
- kaszel
- zwiększenie aktywności enzymów wątrobowych,
- zawroty głowy, parestezje, zaburzenia smaku, senność/bezsenność
- wysypka i świąd
- bóle pleców, bolesne kurcze mięśni,
- osłabienie
Znacznie rzadziej wystąpić mogą:
- zaburzenia w pracy serca, w tym zawał serca lub jego niedokrwienie
- pancytopenia
- neutropenia
- powiększenie węzłów chłonnych
- niewydolność oddechowa
- skurcz oskrzeli
- ostre zapalenie trzustki
- krwawienia z odbytu
- niewydolność nerek
- białkomocz
- zapalenie mięśni
- zaburzenia psychiczne (omamy)
W pojedynczych przypadkach donoszono o wystąpieniu:
- hepatotoksyczności, która najprawdopodobniej spowodowana jest silną reakcją alergiczną na marawirok[2]
- zespołu reaktywacji immunologicznej
- martwicy kości
Istnieją obawy co do długoterminowych skutków blokowania receptora CCR5, gdyż jego funkcja u osób zdrowych nie jest w pełni poznana[41].
Dawkowanie[42][43]
Marawirok podaje się dwa razy dziennie w standardowej dawce 300 mg. Dawkę tę należy zmniejszyć do 150 mg w przypadku jednoczesnego stosowania leków będących silnymi inhibitorami izoenzymu CYP3A4. Zwiększenie dawki do 600 mg następuje w przypadku jednoczesnego zażywania silnych induktorów CYP3A4. Nie ma konieczności modyfikacji dawki przy niewydolności nerek, niemniej jednak:
- podczas jednoczesnego przyjmowania preparatu sakwinawir + rytonawir należy wydłużyć odstęp między kolejnymi dawkami leki, w zależności od stopnia upośledzenia pracy nerek, zgodnie z następującym schematem:
- odstęp 24-godzinny, gdy klirens kreatyniny wynosi 50–80 ml/min
- odstęp 48-godzinny, gdy klirens kreatyniny wynosi <30–50 ml/min
- odstęp 72-godzinny, gdy klirens kreatyniny wynosi <30 ml/min
- podczas jednoczesnego stosowania silnych inhibitorów CYP3A4, odstęp między kolejnymi dawkami marawiroku należy wydłużyć do 24 godzin, niezależnie od klirensu kreatyniny
Ze względu na skąpe dane, u pacjentów z niewydolnością wątroby konieczne może być indywidualne ustalanie dawek.
Przedawkowanie
Największą przyjętą dawką marawiroku było 1200 mg. Jedynym zaobserwowanym objawem przedawkowania było niedociśnienie ortostatyczne. Nie ma swoistej odtrutki – stosuje się leczenie podtrzymujące. Należy zadbać o to, by pacjent leżał na plecach, a także monitorować EKG, ciśnienie krwi oraz inne parametry życiowe. Można zastosować płukanie żołądka, a także podać węgiel aktywowany. Ze względu na duży stopień wiązania marawiroku z białkami osocza, skutecznym postępowaniem w przypadku przedawkowania może być hemodializa.
Preparaty
- Celsentri – Pfizer – tabletki powlekane zawierające marawirok w dawce 150/300 mg oraz 0,84/1,64 mg lecytyny sojowej.
Przypisy
- ↑ a b c Elias James Corey: Molecules and medicine. Hoboken: Wiley, 2007, s. 156. ISBN 978-0-470-22749-7.
- ↑ a b c SELZENTRY (MARAVIROC) label (ang.). U.S. Food and Drug Administration. [dostęp 2018-10-24].
- ↑ a b c S. Abel, D. Russell, L.A. Whitlock, C.E. Ridgway i inni. Assessment of the absorption, metabolism and absolute bioavailability of maraviroc in healthy male subjects. „Br J Clin Pharmacol”. 65 Suppl 1, s. 60–67, Apr 2008. DOI: 10.1111/j.1365-2125.2008.03137.x. PMID: 18333867.
- ↑ a b c ScienceDirect – xPharm: The Comprehensive Pharmacology Reference Home Page. [dostęp 2009-11-27]. – wersja pdf (strony 9204–9).
- ↑ a b c Sean C. Sweetman: Martindale: The Complete Drug Reference, 36th Edition. Pharmaceutical Press, s. 897–898. ISBN 978-0-85369-840-1.
- ↑ R. Yost, T.R. Pasquale, E.G. Sahloff. Maraviroc: a coreceptor CCR5 antagonist for management of HIV infection. „Am J Health Syst Pharm”. 66 (8), s. 715–726, Apr 2009. DOI: 10.2146/ajhp080206. PMID: 19336831.
- ↑ T. Melby, M. Westby. Inhibitors of viral entry. „Handb Exp Pharmacol”, s. 177–202, 2009. DOI: 10.1007/978-3-540-79086-0_7. PMID: 19048201.
- ↑ C. Lehmann, K. Meuer, T. Kümmerle, G. Fätkenheuer. New antiretroviral drug classes in HIV therapy. „MMW Fortschr Med”. 151 (18), s. 64–66, Apr 2009. PMID: 19769081.
- ↑ L. Vandekerckhove, C. Verhofstede, D. Vogelaers. Maraviroc: perspectives for use in antiretroviral-naive HIV-1-infected patients. „J Antimicrob Chemother”. 63 (6), s. 1087–1096, Jun 2009. DOI: 10.1093/jac/dkp113. PMID: 19377064.
- ↑ D.A. Price, D. Armour, M. de Groot, D. Leishman i inni. Overcoming hERG affinity in the discovery of maraviroc; a CCR5 antagonist for the treatment of HIV. „Curr Top Med Chem”. 8 (13), s. 1140–1151, 2008. PMID: 18782009.
- ↑ R.D. MacArthur, R.M. Novak. Reviews of anti-infective agents: maraviroc: the first of a new class of antiretroviral agents. „Clin Infect Dis”. 47 (2), s. 236–241, Jul 2008. DOI: 10.1086/589289. PMID: 18532888.
- ↑ P. Dorr, M. Westby, S. Dobbs, P. Griffin i inni. Maraviroc (UK-427,857), a potent, orally bioavailable, and selective small-molecule inhibitor of chemokine receptor CCR5 with broad-spectrum anti-human immunodeficiency virus type 1 activity. „Antimicrob Agents Chemother”. 49 (11), s. 4721–4732, Nov 2005. DOI: 10.1128/AAC.49.11.4721-4732.2005. PMID: 16251317.
- ↑ V. Soriano, E. Poveda. [Pharmacokinetics, interactions and mechanism of action of maraviroc]. „Enferm Infecc Microbiol Clin”. 26 Suppl 11, s. 12–16, Oct 2008. PMID: 19133216.
- ↑ J.S. Hunt, F. Romanelli. Maraviroc, a CCR5 coreceptor antagonist that blocks entry of human immunodeficiency virus type 1. „Pharmacotherapy”. 29 (3), s. 295–304, Mar 2009. DOI: 10.1592/phco.29.3.295. PMID: 19249948.
- ↑ D.J. Caldwell, J.D. Evans. Developing clinical role of a CCR5 co-receptor antagonist in HIV-1 infection. „Expert Opin Pharmacother”. 9 (18), s. 3231–3242, Dec 2008. DOI: 10.1517/14656560802576324. PMID: 19040343.
- ↑ J.A. Levy. HIV pathogenesis: 25 years of progress and persistent challenges. „AIDS”. 23 (2), s. 147–160, Jan 2009. DOI: 10.1097/QAD.0b013e3283217f9f. PMID: 19098484.
- ↑ R. Kondru, J. Zhang, C. Ji, T. Mirzadegan i inni. Molecular interactions of CCR5 with major classes of small-molecule anti-HIV CCR5 antagonists. „Mol Pharmacol”. 73 (3), s. 789–800, Mar 2008. DOI: 10.1124/mol.107.042101. PMID: 18096812.
- ↑ M. Saag, J. Goodrich, G. Fätkenheuer, B. Clotet i inni. A double-blind, placebo-controlled trial of maraviroc in treatment-experienced patients infected with non-R5 HIV-1. „J Infect Dis”. 199 (11), s. 1638–1647, Jun 2009. DOI: 10.1086/598965. PMID: 19432546.
- ↑ Indeks leków Medycyny Praktycznej 2009. Kraków: Wydawnictwo Medycyna Praktyczna, 2009. ISBN 978-83-7430-221-0. – Marawirok, [w:] Indeks Leków MP [online], opis substancji, Medycyna Praktyczna [dostęp 2010-01-10].
- ↑ C. Agrawal-Gamse, F.H. Lee, B. Haggarty, A.P. Jordan i inni. Adaptive mutations in a human immunodeficiency virus type 1 envelope protein with a truncated V3 loop restore function by improving interactions with CD4. „J Virol”. 83 (21), s. 11005–11015, Nov 2009. DOI: 10.1128/JVI.01238-09. PMID: 19692476.
- ↑ R. Delgado. [Mechanisms of resistance and failure of treatment with maraviroc]. „Enferm Infecc Microbiol Clin”. 26 Suppl 11, s. 28–33, Oct 2008. PMID: 19133219.
- ↑ J.P. Moore, D.R. Kuritzkes. A pièce de resistance: how HIV-1 escapes small molecule CCR5 inhibitors. „Curr Opin HIV AIDS”. 4 (2), s. 118–124, Mar 2009. DOI: 10.1097/COH.0b013e3283223d46. PMID: 19339950.
- ↑ D.E. Mosier. Changes in HIV-1 tropism: clinical and prognostic consequences. „Eur J Med Res”. 12 (9), s. 371–374, Oct 2007. PMID: 17933716.
- ↑ S. Moreno, B. Hernández, C. Gutiérrez, E. Delsol. [Maraviroc efficacy in clinical studies on the development of the molecule]. „Enferm Infecc Microbiol Clin”. 26 Suppl 11, s. 17–22, Oct 2008. PMID: 19133217.
- ↑ We wszystkich punktach zastosowano przedział ufności 0,95, z wyjątkiem zmiany poziomu RNA wirusa, gdzie zastosowano przedział ufności 0,975.
- ↑ Maraviroc reduces viral load in naive patients at 48 weeks. „AIDS Patient Care STDS”. 21 (9), s. 703–704, Sep 2007. PMID: 17941136.
- ↑ M. Lanzafame, E. Lattuada, S. Vento. Maraviroc and CD4+ cell count recovery in patients with virologic suppression and blunted CD4+ cell response. „AIDS”. 23 (7), s. 869, kwiecień 2009. DOI: 10.1097/QAD.0b013e3283262aa0. PMID: 19363332.
- ↑ Daniel Lednicer, Lester A. Mitscher: The organic chemistry of drug synthesis. Volume 7. New York: Wiley, 2008, s. 107–108. ISBN 978-0-470-10750-8.
- ↑ M.C. Rosario, P. Jacqmin, P. Dorr, I. James i inni. Population pharmacokinetic/pharmacodynamic analysis of CCR5 receptor occupancy by maraviroc in healthy subjects and HIV-positive patients. „Br J Clin Pharmacol”. 65 Suppl 1, s. 86–94, Apr 2008. DOI: 10.1111/j.1365-2125.2008.03140.x. PMID: 18333870.
- ↑ P.L. Chan, B. Weatherley, L. McFadyen. A population pharmacokinetic meta-analysis of maraviroc in healthy volunteers and asymptomatic HIV-infected subjects. „Br J Clin Pharmacol”. 65 Suppl 1, s. 76–85, Apr 2008. DOI: 10.1111/j.1365-2125.2008.03139.x. PMID: 18333869.
- ↑ G. Fätkenheuer, M. Nelson, A. Lazzarin, I. Konourina i inni. Subgroup analyses of maraviroc in previously treated R5 HIV-1 infection. „N Engl J Med”. 359 (14), s. 1442–1455, Oct 2008. DOI: 10.1056/NEJMoa0803154. PMID: 18832245.
- ↑ First medication in new class of ARTs poised to be available for salvage therapy. Tropism testing helps determine best patients for drug. „AIDS Alert”. 22 (8), s. 85–88, Aug 2007. PMID: 17763555.
- ↑ W badaniach klinicznych wykorzystywano test Monogram Trofile. Inne testy są obecnie badane i oceniane.
- ↑ T. Edmunds-Ogbuokiri. An in-depth look at the challenges of prescribing maraviroc. „HIV Clin”. 20 (3), s. 9–11, 2008. PMID: 18814378.
- ↑ S. Abel, J.D. Davis, C.E. Ridgway, J.C. Hamlin i inni. Pharmacokinetics, safety and tolerability of a single oral dose of maraviroc in HIV-negative subjects with mild and moderate hepatic impairment. „Antivir Ther”. 14 (6), s. 831–837, 2009. DOI: 10.3851/1297. PMID: 19812445.
- ↑ S. Abel, D.J. Back, M. Vourvahis. Maraviroc: pharmacokinetics and drug interactions. „Antivir Ther”. 14 (5), s. 607–618, 2009. PMID: 19704163.
- ↑ S. Abel, T.M. Jenkins, L.A. Whitlock, C.E. Ridgway i inni. Effects of CYP3A4 inducers with and without CYP3A4 inhibitors on the pharmacokinetics of maraviroc in healthy volunteers. „Br J Clin Pharmacol”. 65 Suppl 1, s. 38–46, Apr 2008. DOI: 10.1111/j.1365-2125.2008.03134.x. PMID: 18333864.
- ↑ R. Hyland, M. Dickins, C. Collins, H. Jones i inni. Maraviroc: in vitro assessment of drug-drug interaction potential. „Br J Clin Pharmacol”. 66 (4), s. 498–507, Oct 2008. DOI: 10.1111/j.1365-2125.2008.03198.x. PMID: 18647303.
- ↑ Maraviroc (Selzentry, Celsentri). aidsinfonet.org The AIDS InfoNet. [dostęp 2010-01-21].
- ↑ J.M. Emmelkamp, J.K. Rockstroh. Maraviroc, risks and benefits: a review of the clinical literature. „Expert Opin Drug Saf”. 7 (5), s. 559–569, Sep 2008. DOI: 10.1517/14740338.7.5.559. PMID: 18759708.
- ↑ J. Stephenson. Researchers buoyed by novel HIV drugs: will expand drug arsenal against resistant virus. „JAMA”. 297 (14), s. 1535–1536, Apr 2007. DOI: 10.1001/jama.297.14.1535. PMID: 17426263.
- ↑ M. Leal, A. Camacho, M. Genebat, A. Rivero. At what time and with which combinations should maraviroc be indicated in the new antiretroviral treatment scenario?. „Enferm Infecc Microbiol Clin”. 26 Suppl 11, s. 34–39, Oct 2008. PMID: 19133220.
- ↑ Charakterystyka Produktu Leczniczego Celsentri (wersja pdf) (pol.). [dostęp 2010-01-09].
Bibliografia
- Elias James Corey: Molecules and medicine. Hoboken: Wiley, 2007, s. 156. ISBN 978-0-470-22749-7.
- ScienceDirect – xPharm: The Comprehensive Pharmacology Reference Home Page. [dostęp 2009-11-27]. – wersja pdf (strony 9204–9)
- Sean C. Sweetman: Martindale: The Complete Drug Reference, 36th Edition. Pharmaceutical Press, s. 897–898. ISBN 978-0-85369-840-1.
- Charakterystyka Produktu Leczniczego Celsentri (wersja pdf) (pol.). [dostęp 2010-01-09].
- Indeks leków Medycyny Praktycznej 2009. Kraków: Wydawnictwo Medycyna Praktyczna, 2009. ISBN 978-83-7430-221-0. – Marawirok, [w:] Indeks Leków MP [online], opis substancji, Medycyna Praktyczna [dostęp 2010-01-10].
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Schemat syntezy marawiroku
Wzór strukturalny UK-107543
Miejsca wiązania marawiroku z CCR5
Przemiany metaboliczne marawiroku