Mentol
| |||||||||||||||||||||||||||||||||||
 Kryształy mentolu | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C10H20O | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 156,27 g/mol | ||||||||||||||||||||||||||||||||||
| Wygląd | białe lub bezbarwne, krystaliczne ciało stałe | ||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||
| Numer CAS | 89-78-1 – racemat 2216-51-5 – (−)-izomer 15356-60-2 – (+)-izomer | ||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||
| Podobne związki | menton, karwon, limonen | ||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||
Mentol – alkohol z grupy terpenów, o ostrym, przenikliwym zapachu miętowym, stosowany masowo w przemyśle kosmetycznym i pomocniczych środkach farmaceutycznych.
Występowanie
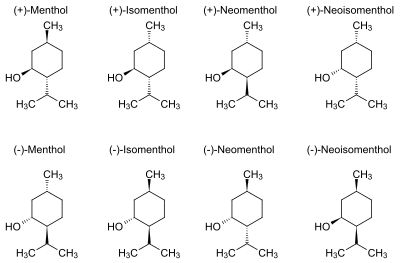
Najpowszechniej naturalnie występującym izomerem jest (−)-mentol, czyli (1R,2S,5R)-5-metylo-(prop-2-ylo)cykloheksan-1-ol, który produkowany jest przez różne gatunki mięty. Olejek z mięty polnej zawiera go ok. 70–80%[3], jest też głównym składnikiem olejku miętowego z mięty pieprzowej[3][1], występuje także w wielu olejkach eterycznych innych roślin. Inne izomery występujące w mniejszych ilościach w mięcie pieprzowej to (+)-neomentol, (+)-izomentol i (+)-neoizomentol[4].
Otrzymywanie
Przemysłowo uzyskuje się go przez izolację z olejków z mięty polnej, pieprzowej i innych gatunków mięty oraz za pomocą syntezy chemicznej. Izolacja z olejku polega na schłodzeniu produktu i odwirowaniu wytrąconych kryształów[3].
Synteza chemiczna
Synteza asymetryczna (1R,2S,5R)-(–)-mentolu prowadzona jest na skalę tysięcy ton przez japońską firmę Takasago International Corporation[5] przy użyciu metody opracowanej przez laureata Nagrody Nobla, Ryōjiego Noyoriego:
Właściwości
W temperaturze pokojowej tworzy białe, igłowe kryształki. Słabo rozpuszczalny w wodzie, dobrze rozpuszcza się w polarnych rozpuszczalnikach organicznych. Ze względu na to, że zawiera on 3 centra chiralności, ma 8 izomerów optycznych. Najczęściej spotykany (−)-mentol wykazuje najsilniejsze działanie biologiczne.
Mentol ulega reakcjom typowym dla alkoholi drugorzędowych, na przykład utlenianiu za pomocą trójtlenku chromu do ketonu (mentonu) lub ketokwasu karboksylowego, eliminacji do alkenu (3-mentenu) lub chlorowaniu za pomocą PCl5 do chlorku mentylu:
Zastosowanie
Mentol ma własności znieczulające i zmniejszające podrażnienie błon śluzowych. Jego wdychanie lub spożywanie daje szybko odczuwalne wrażenie chłodu i świeżości. Jest stosowany w specyfikach wspomagających leczenie przeziębień i kataru. Jest też dodawany do maści na ból mięśni, aromatyzuje się nim chusteczki higieniczne, papierosy, tabaki, proszki do prania, płyny do mycia naczyń. Jest też stosowany jako jeden ze składników wielu kompozycji zapachowych stosowanych w kosmetyce. Zaaplikowany na dolną powiekę wywołuje łzawienie oczu, przez co znajduje zastosowanie w aktorstwie i modelingu.
W syntezie chemicznej mentol i jego pochodne wykorzystywane są jako pomocniki i katalizatory chiralne[6].
Zagrożenia
Mentol jest uważany za bezpieczny składnik produktów spożywczych, jednak w czystej formie jest substancja szkodliwą i odnotowano przypadki zatruć ostrych (objawy obejmują zapalenie skóry i warg, owrzodzenie jamy ustnej, ból brzucha, nudności, obrzęk mózgu, wymioty, bradykardię i dreszcze) spowodowanych spożyciem czystego olejku miętowego[1]. Do zatrucia może doprowadzić też spożycie dużych ilości lub produktów bogatych w mentol[1] lub długotrwałe przyjmowanie preparatów mentolowych[7]. Dawkę śmiertelną dla człowieka szacuje się na 50–150 mg/kg. W 2016 r. opisano pierwszy śmiertelny przypadek zatrucia mentolem, do którego doszło w wyniku wdychania oparów olejku miętowego podczas czyszczenia zbiornika na ten produkt[1].
Przypisy
- ↑ a b c d e Akshay Kumar i inni, A fatal case of menthol poisoning, „International Journal of Applied & Basic Medical Research”, 6 (2), 2016, s. 137–139, DOI: 10.4103/2229-516X.179015, PMID: 27127746, PMCID: PMC4830155.
- ↑ MSDS Merck
- ↑ a b c Karl‐Georg Fahlbusch i inni, Flavors and Fragrances, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 28-29, DOI: 10.1002/14356007.a11_141 (ang.).
- ↑ Paul M. Dewick, Medicinal Natural Products. A Biosynthetic Approach, wyd. 3, Wiley, 2009, s. 199, DOI: 10.1002/9780470742761, ISBN 978-0-470-74276-1 (ang.).
- ↑ Japan: Takasago to Expand L-Menthol Production in Iwata Plant. Food Industry News. [dostęp 2010-09-15].
- ↑ R. Łaźny, A. Nodzewska, B. Żabicka. Narzędzia chemii kombinatorycznej. Cz. 4. Synteza asymetryczna na fazie stałej. „Wiad. Chem.”. 60 (3–4), s. 191–255, 2006.
- ↑ Motaz Baibars i inni, Menthol toxicity: an unusual cause of coma, „Case Reports in Medicine”, 2012, 2012, s. 187039, DOI: 10.1155/2012/187039, PMID: 23251165, PMCID: PMC3521632.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Mentholisomere
Menthol-skeletal
Menthol crystals