Mewa widłosterna
| Creagrus furcatus[1] | |||
| (Neboux, 1846) | |||
 | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Infragromada | |||
| Rząd | |||
| Podrząd | |||
| Parvordo | |||
| Nadrodzina | |||
| Rodzina | |||
| Podrodzina | |||
| Rodzaj | Creagrus | ||
| Gatunek | mewa widłosterna | ||
| Synonimy | |||
| Kategoria zagrożenia (CKGZ)[4] | |||
 | |||
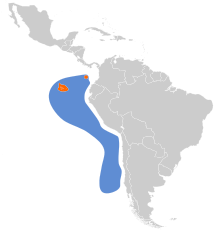
| Zasięg występowania | |||
 | |||
Mewa widłosterna[5] (Creagrus furcatus) – gatunek dużego ptaka z rodziny mewowatych (Laridae). Gniazduje na Galapagos i kolumbijskiej wyspie Malpelo. Nie jest zagrożony wyginięciem.
Taksonomia
Po raz pierwszy gatunek opisał francuski lekarz i przyrodnik Adolphe-Simon Neboux. Mewa widłosterna została odkryta podczas podróży La Vénus (1836–1839) pod dowództwem kapitana Vaillanta, w trakcie której Neboux był lekarzem okrętowym. Opis z dołączoną tablicą barwną (oznaczoną numerem X), ukazał się w 1846. Holotyp miał pochodzić z Monterey[2], co było pomyłką w zapisie – został pozyskany na Galapagos[6]. Autor nadał nowemu gatunkowi nazwę Larus furcatus[2].
Obecnie (2021) Międzynarodowy Komitet Ornitologiczny umieszcza mewę widłosterną w monotypowym rodzaju Creagrus. Nie wyróżnia podgatunków[7]. Tę samą klasyfikację zastosowano między innymi w Handbook of the Birds of the World, w opracowywanej przy współpracy z BirdLife International oraz autorami HBW liście ptaków świata (wydanie książkowe: 2016, 5. wersja online: grudzień 2020)[8] i w Clements Checklist of Birds of the World (2019)[9].
Dawniej za najbliżej spokrewnioną z mewą widłosterną uważano mewę obrożną (Xerna sabini). Opierano się na podobieństwach w upierzeniu i budowie ciała, zarówno szkieletu, jak i tkanek miękkich[10][3]. W 2000 ukazały się wyniki badań z wykorzystaniem sekwencji mitochondrialnego genu cytochromu b oraz regionu kontrolnego mtDNA, którym objęto 32 gatunki mew. Mewa widłosterna ma według nich stanowić takson siostrzany wobec mewy małej (Hydrocoloeus minutus, wówczas Larus minutus)[11]. W 2005 opublikowano wyniki badań z użyciem tych samych sekwencji, jednak dla 53 gatunków mew – wszystkich według przyjętego ujęcia. Autorzy odrzucili wcześniejsze hipotezy o bliskim pokrewieństwie mewy widłosternej z małą. Według uzyskanych wyników C. furcatus reprezentuje klad bazalny podrodziny mew, jednak ich pewność jest umiarkowana. Pons et al. (2005) wskazali konieczność dalszych badań molekularnych, które pozwoliłyby ustalić pozycję mewy widłosternej w obrębie podrodziny[12]. Inne wyniki uzyskali Baker et al. (2007), którzy skupili się na 90 z 96 rodzajów w rzędzie siewkowych, nie gatunkach, i wykorzystali sekwencje 12S rRNA, ND2, cytochromu b oraz RAG1. Część rodziny Laridae nieobejmująca rybołówek i atolówki (1. i 2. grupa zewnętrzna) dzieli się według nich na dwa klady. W starszym z nich kladem bazalnym są brzytwodzioby (Rynchops), reprezentujące obecnie osobną podrodzinę. Pozostałą jego część tworzą mewy (jako podrodzina, Larinae), a mewa widłosterna wraz z różową (Rhodostethia rosea) – gatunkiem siostrzanym – stanowią jej klad bazalny[13]. Jetz et al. (2012) w bardzo obszernym badaniu obejmującym 9993 gatunki ptaków również ulokowali mewę widłosterną i różową w kladzie bazalnym Larinae jako gatunki siostrzane. Ich wspólna linia rozwojowa wyodrębniła się około 10,0 mln lat temu, a rozdzieliły się około 6,2 mln lat temu[14]. Według Baker et al. (2007) było to odpowiednio 25,7 i 22,9 mln lat temu[13]. Thomas et al. (2004a[15], 2004b[16]) uzyskali jeszcze inne układy gałęzi drzewa filogenetycznego.
Poniżej przedstawiono fragment drzewa filogenetyczego opracowanego przez Dufour et al. (2020) w oparciu o konserwowany rdzeń (ang. backbone) i liczne dostępne drzewa filogenetyczne, a także poprawionego o rezultaty nowszych badań[17]:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
¹gatunki z tych rodzajów były włączone przez autorów do Larus, jednak wyraźnie skupiają się w osobnych kladach, współcześnie przez część autorów wydzielanych do rangi rodzaju
Morfologia
Długość ciała wynosi 51–57 cm, masa ciała – 610–780 g[6], rozpiętość skrzydeł – 124–139 cm[18]. Mewy widłosterne są bardzo charakterystyczne, z przykuwającym uwagę wzorem i rozwidlonym ogonem. U dorosłych w szacie godowej głowa jest ciemnoszara, upierzenie jaśnieje w górnej części szyi i na piersi. Nad nasadą dzioba znajduje się biała plama. Płaszcz, grzbiet i skrzydła szare. Kuper i ogon białe, podobnie jak spód ciała. Dziób czarniawy z jasną końcówką. Nogi i stopy różowoczerwone. Tęczówka ciemnobrązowa. Widoczna jaskrawa czerwona obrączka oczna[6]. Świeżo wyklute młode są szare, później aż do opierzenia – głównie białe. To nietypowa cecha na tle rodziny, ponieważ w upierzeniu młodych mew zwykle przeważa brązowy[19].
Zasięg występowania
Mewy widłosterne gniazdują niemal wyłącznie na Galapagos, gdzie zajmują wszystkie główne wyspy i kilka mniejszych[20], chociaż skupione są bardziej po wschodniej stronie archipelagu[6]. W 2013 znano lokalizacje 46 kolonii na 16 wyspach[21]. Jedyne miejsce gniazdowania poza Galapagos to kolumbijska wyspa Malpelo[6][20]. W 1970 największe znane kolonie (szacunkowo ponad 1 tys. osobników) mieściły się na Española (Hood Island) – 2 kolonie – oraz Genovesa (Tower) i Wolf (Wenman) – po 1 kolonii[22].
Poza sezonem lęgowym mewy widłosterne przebywają głównie na morzu, choć pojawiają się również wzdłuż wybrzeży Ameryki Południowej od Ekwadoru do centralnego Peru, sporadycznie i do środkowego Chile[6].
Ekologia i zachowanie
Choć mewy widłosterne występują na wszystkich głównych wyspach Galapagos i niektórych mniejszych, to unikają chłodniejszych wód wokół wschodniej Fernandiny i zachodniej Isabeli[22]. Ich miejsca gniazdowania znajdują się na stromych zboczach lub klifach, często na szerokich półkach skalnych, i w miejscach ledwo powyżej zasięgu fal, a prócz tego na żwirowych plażach i pod osłoną roślinności. Do wielu z nich łatwo mogą dostać się ludzie. Po lęgach mewy opuszczają kolonie i wracają po 4–5 miesiącach, nierzadko w to samo miejsce. Przeważnie udają się na wschód od terenów lęgowych[6]. Jeszcze w 1992 mewy widłosterne były jednymi z dwóch gatunków ptaków lęgowych na wyspie Malpelo. Wówczas mieściła się tam największa kolonia głuptaków galapagoskich (Sula granti)[23].
Mewy widłosterne żywią się kałamarnicami i śledziokształtnymi. Często widywane są podczas żerowania do 500 km od miejsc gniazdowania[6]. Udział ryb i kałamarnic może być znacznie zmienny, co prawdopodobnie wynika ze zmiennej dostępności pokarmu[24][22]. Zidentyfikowane ryby to sardynki Sardinops, a kałamarnice – Sthenoteuthis oualaniensis. Sardynki są dobrze znane z Galapagos, S. oualaniensis natomiast należą do bardzo pospolitych kałamarnic z tropikalnych regionów wschodniego Pacyfiku[25][24][22].
Po raz pierwszy dostępne informacje o występowaniu, rozmnażaniu i – wówczas jeszcze niepotwierdzonym – nocnym trybie życia zebrał i opublikował Murphy w 1936. Dopiero w 1964 Hailman potwierdził, że mewy widłosterne żerują wyłącznie nocą. Tamtego roku zaczęła działać Charles Darwin Research Station, co ułatwiło prowadzenie badań. Później kilka przeprowadzili Barbara i David Snow[21], którzy jako jedyni jak dotąd spędzili dłuższy czas na wyspie. Kolejny był Michael Harris, który razem z żoną stacjonował w CDRS między listopadem 1965 i lipcem 1967; w 1970 ukazał się jego artykuł poświęcony biologii rozrodu mewy widłosternej[22].
Aktywność mew widłosternych związana jest z fazami Księżyca. Stosunkowo więcej czasu spędzają nocami na morzu podczas ciemniejszych nocy, jako że zgodnie z przebiegiem dobowych migracji pionowych ich zdobyczy wówczas zbiera się ona blisko powierzchni wody. Dla mew dostępna jest jedynie ta znajdująca się najwyżej 1 m pod powierzchnią[26]. Młode są karmione od około północy do godziny po wschodzie słońca. W sezonie lęgowym nocy w kolonii zostają jedynie osobniki wysiadujące jaja lub opiekujące się pisklętami[19].
Mimo że różni autorzy wskazywali na szczególnie duże oczy będące przystosowaniem do żerowania w nocy, to nie popierano tych twierdzeń wymiarami. Dopiero w 2010 pojawiły się weryfikujące te twierdzenia wyniki badań, w tym rezultaty pomiarów. Oczy mew widłosternych ani rozmiarem, ani kształtem nie różnią się znacząco od oczu innych mewowców. Mają jedynie nieco większą rogówkę i są dłuższe[27]. Analiza sekwencji genu kodującego opsynę SWS1 u C. furcatus wskazuje na typ UVS. Sugeruje to możliwość widzenia ultrafioletu przez mewy widłosterne[28].
Lęgi
Mewy widłosterne mogą wyprowadzać lęgi w dowolnej porze roku. Na Galapagos ogółem przystępują do lęgów asynchronicznie, jednak w poszczególnych podkoloniach występuje większa synchronizacja lęgów. Sprzyjają temu interakcje między osobnikami. Cykl rozrodczy zwykle trwa około 6 miesięcy[6], lecz dla poszczególnych par jest to 9–10 miesięcy[24].
Mewy widłosterne często gniazdują samotnie, lecz poza tym tworzą luźne kolonie z dużymi odstępami między gniazdami. Mogą być umieszczone na ziemi, na wulkanicznych skałach lub żwirze, nierzadko pod osłoną skały lub krzewu. Przeważnie znajdują się blisko wybrzeża. Mają formę niewielkiego zagłębienia, którego wyściółkę stanowią drobne kamyki, pióra albo kości. Dorosłe mewy widłosterne niekiedy połykają małe kamyki i zwracają w gnieździe[6].
W zniesieniu znajduje się 1 jajo. Wysiadywanie trwa 33–35 dni. Uczestniczą w nim obydwa ptaki z pary, czasami zmieniają się co dobę. Po wykluciu się pisklęcia nie usuwają skorupy z gniazda. Młode jest pod stałą opieką przez pierwsze 48 godzin życia, później kilka tygodni przebywa w pobliżu gniazda. Opiekują się nim oboje rodzice. Młode stają się w pełni opierzone po 58–65 dniach. Pozostają jednak zależne od rodziców i trzymają się kolonii przez 90–140 dni[6]. Najniższy znany wiek przystąpienia do rozrodu po raz pierwszy to 3 lata i 4 miesiące[29].
Status i zagrożenia
IUCN uznaje mewę widłosterną za gatunek najmniejszej troski (LC, Least Concern) nieprzerwanie od 1988 (stan w 2021). BirdLife International uznaje trend liczebności populacji za trudny do ustalenia. Potencjalnym zagrożeniem dla gatunku są okresowe niedobory pożywienia skutkujące tymczasowym zakłóceniem cyklu rozrodczego. Powoduje je między innymi zjawisko El Niño. Ma jednak niewielki długofalowy wpływ na populację, jako że skutki niedoborów są zmniejszane przez zróżnicowany cykl rozrodczy między poszczególnymi koloniami na różnych wyspach[20].
Przypisy
- ↑ Creagrus furcatus, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ a b c Adolphe-Simon Neboux, Voyage autour du monde sur la Venus, pendant 1836-1839, 1846, Pl. 10.
- ↑ a b M. Moynihan, A revision of the family Laridae (Aves), „American Museum novitates”, 1928, 1959, s. 1–42.
- ↑ Creagrus furcatus, [w:] The IUCN Red List of Threatened Species [online] (ang.).
- ↑ Systematyka i nazwy polskie za: P. Mielczarek & M. Kuziemko: Podrodzina: Larinae Rafinesque, 1815 - mewy (wersja: 2020-07-29). [w:] Kompletna lista ptaków świata [on-line]. Instytut Nauk o Środowisku Uniwersytetu Jagiellońskiego. [dostęp 2021-06-16].
- ↑ a b c d e f g h i j k J. Hoyo (red.), A. Elliott, J. Sargatal, Handbook of the Birds of the World, t. 3. Hoatzin to Auks, Barcelona: Lynx Edicions, 1996, s. 621–622.
- ↑ F. Gill, D. Donsker, P. Rasmussen (red.): Noddies, gulls, terns, skimmers, skuas, auks. IOC World Bird List (v11.1), 19 stycznia 2021. [dostęp 2021-06-09].
- ↑ Handbook of the Birds of the World and BirdLife International digital checklist of the birds of the world. Version 5, BirdLife Data Zone, grudzień 2020 [dostęp 2021-06-16].
- ↑ J.F. Clements, M.J. Iliff, S.M. Billerman, T.A. Fredericks, B.L. Sullivan, C.L. Wood T. S. Schulenberg, The eBird/Clements Checklist of Birds of the World: v2019, 2019 [dostęp 2021-06-10].
- ↑ Chu PC, A phylogeny of the gulls (Aves: Larinae) inferred from osteological and integumentary characters, „Cladistics”, 1, 14, 1998, s. 1–43, DOI: 10.1111/j.1096-0031.1998.tb00202.x.
- ↑ Crochet, Bonhomme, Lebreton, Molecular phylogeny and plumage evolution in gulls (Larini), „Journal of Evolutionary Biology”, 13 (1), 2000, s. 47–57, DOI: 10.1046/j.1420-9101.2000.00135.x, ISSN 1010-061X.
- ↑ Pons JM, Hassanin A, Crochet PA, Phylogenetic relationships within the Laridae (Charadriiformes: Aves) inferred from mitochondrial markers, „Molecular Phylogenetics and Evolution”, 37 (3), 2005, s. 686–699, DOI: 10.1016/j.ympev.2005.05.011.
- ↑ a b Allan Baker, Sérgio Pereira, Tara Paton, Phylogenetic relationships and divergence times of Charadriiformes genera: Multigene evidence for the Cretaceous origin of at least 14 clades of shorebirds, „Biology letters”, 3, 2007, s. 205–209, DOI: 10.1098/rsbl.2006.0606.
- ↑ W. Jetz i inni, The global diversity of birds in space and time, „Nature”, 491 (7424), 2012, s. 444–448, DOI: 10.1038/nature11631, ISSN 0028-0836. (drzewo filogenetyczne dostępne w bazie pod adresem timetree.org)
- ↑ Gavin H Thomas, Matthew A Wills, Tamás Székely, Phylogeny of shorebirds, gulls, and alcids (Aves: Charadrii) from the cytochrome-b gene: parsimony, Bayesian inference, minimum evolution, and quartet puzzling, „Molecular Phylogenetics and Evolution”, 30 (3), 2004, s. 516–526, DOI: 10.1016/S1055-7903(03)00222-7.
- ↑ Gavin H Thomas, Matthew A Wills, Tamás Székely, A supertree approach to shorebird phylogeny, „BMC Evolutionary Biology”, 4 (1), 2004, s. 28, DOI: 10.1186/1471-2148-4-28, PMCID: PMC515296.
- ↑ Paul Dufour i inni, Plumage colouration in gulls responds to their non‐breeding climatic niche, „Global Ecology and Biogeography”, 29 (10), 2020, s. 1704–1715, DOI: 10.1111/geb.13142, ISSN 1466-822X.
- ↑ Klaus Malling Olsen, Gulls of Europe, Asia and North America, Bloomsbury Publishing, 2010, s. 584, ISBN 978-1-4081-3528-0.
- ↑ a b Jack P. Hailman, The Galápagos Swallow-Tailed Gull Is Nocturnal, „The Wilson Bulletin”, 4, 76, 1964, s. 347–354.
- ↑ a b c Swallow-tailed Gull Creagrus furcatus. BirdLife International. [dostęp 2021-06-09].
- ↑ a b Sebastian M. Cruz, At-sea movement and migration of the nocturnal swallow-tailed gull (Creagrus furcatus) [Dissertation], Konstanz: University of Konstanz, 2013.
- ↑ a b c d e Michael P. Harris, Breeding Ecology of the Swallow-Tailed Gull, Creagrus Furcatus , „The Auk”, 2, 87, 1970, s. 215–243.
- ↑ Robert L. Pitman, Larry B. Spear, Michael P. Force, The Marine Birds of Malpelo Island, Colombia, „Colonial Waterbirds”, 18 (1), 1995, s. 113, DOI: 10.2307/1521408, JSTOR: 1521408.
- ↑ a b c Barbara K. Snow, D.W. Snow, Behavior of The Swallow-Tailed Gull of The Galápagos, „The Condor”, 3, 70, 1968, s. 252–264, DOI: 10.2307/1366698, JSTOR: 1366698.
- ↑ D.W. Snow, B.K. Snow, The breeding cycle of the Swallow-tailed Gull Creagrus furcatus, „Ibis”, 109 (1), 1967, s. 14–24, DOI: 10.1111/j.1474-919X.1967.tb00003.x (ang.).
- ↑ Sebastian M. Cruz i inni, At–Sea Behavior Varies with Lunar Phase in a Nocturnal Pelagic Seabird, the Swallow-Tailed Gull, „PLoS ONE”, 2, 8, 2013, DOI: 10.1371/journal.pone.0056889.
- ↑ Andrew N.Iwaniuk i inni, Morphometrics of the eyes and orbits of the nocturnal Swallow-tailed Gull (Creagrus furcatus), „Canadian Journal of Zoology”, 9, 88, s. 855–865, DOI: 10.1139/Z10-051.
- ↑ Gabriel E. Machovsky Capuska i inni, UVS is rare in seabirds, „Vision Research”, 51 (12), 2011, s. 1333–1337, DOI: 10.1016/j.visres.2011.04.008.
- ↑ M.P. Harris, Survival and Ages of First Breeding of Galápagos Seabirds, „Bird-Banding”, 1, 50, 1979, s. 56–61.
Linki zewnętrzne
- Zdjęcia, nagrania głosów i krótkie filmy. [w:] eBird [on-line]. Cornell Lab of Ornithology. (ang.).
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor: Cephas, Licencja: CC BY-SA 4.0
Range map of Swallow-tailed Gull (Creagrus furcatus).
Autor: Bernard Gagnon, Licencja: CC BY-SA 3.0
Juvenile Swallow-tailed Gull (Creagrus furcatus) in Plaza Sur Island, Galápagos National Park, Ecuador
Autor: Mike's Birds from Riverside, CA, US, Licencja: CC BY-SA 2.0
South Plaza Island
Autor: Gregory "Slobirdr" Smith, Licencja: CC BY-SA 2.0
S. Plaza Island Swallow-tailed Gull Head







