Mieszalność cieczy
Mieszalność cieczy jest zjawiskiem, które dotyczy cieczy o zbliżonych właściwościach (znana reguła "podobne w podobnym"), np. ciecze polarne mieszają się z innymi cieczami polarnymi, ciecze niepolarne mieszają się dobrze z innymi cieczami niepolarnymi (zobacz np. napięcie powierzchniowe, heteroazeotrop, heterozeotrop).
Rozróżnia się:
- nieograniczoną mieszalność – mieszanie w dowolnych proporcjach cieczy A i B prowadzi zawsze do powstania 1 fazy ciekłej, np. woda i alkohol etylowy lub woda i aceton mieszają się ze sobą w dowolnych proporcjach
- ograniczoną (częściową) mieszalność – po zmieszaniu dwóch ciekłych składników A i B może powstać roztwór B w A oraz roztwór A w B, oddzielone od siebie powierzchnią fazową.
Jeżeli ograniczona mieszalność występuje w pewnym przedziale temperatur, wówczas rozróżnia się:
- dolną temperaturę krytyczną mieszalności – poniżej tej temperatury występuje nieograniczona mieszalność, natomiast powyżej – ograniczona
- górną temperaturę krytyczną mieszalności – powyżej tej temperatury występuje nieograniczona mieszalność, natomiast poniżej – ograniczona
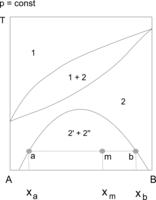
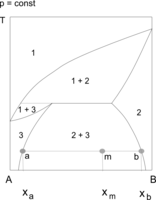
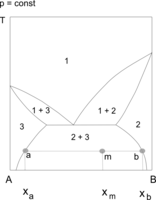
Przykładami układów, w których występuje zarówno górna jak i dolna krytyczna temperatura mieszalności, są układy woda–nikotyna i woda–tetrahydrofuran (THF). Na wykresach równowagi przedstawia się np. w układzie współrzędnych temperatura – udziały składników układu, granicę obszaru współistnienia obu faz ciekłych. W polu otoczonym tą linią znajdują się punkty określające skład całego układu. Składy faz ciekłych, znajdujących się w równowadze termodynamicznej wyznaczają odpowiednie izotermy, przechodzące przez te punkty. Stosunek ilości obu faz w wybranej temperaturze określa się na podstawie reguły dźwigni (odległości punktu opisującego układ od granic obszaru dwufazowego). Wraz ze zmianami temperatury skład obu cieczy (zawartość składników) i ilościowe udziały faz w mieszaninie ulegają równoczesnym zmianom.
Wodny roztwór tetrahydrofuranu (THF) o stężeniu 30–70% jest w temperaturze około 150 °C jednofazowy. W czasie jego chłodzenia obserwuje się, że w temperaturze 130–140 °C staje się mętny (zaczyna się wydzielać druga faza ciekła), po czym można zauważyć rozwarstwienie obu cieczy. Rozwarstwienie zanika w temperaturze 70–90 °C (zależnej od stężenia THF).
Obszary ograniczonej mieszalności w fazie ciekłej mogą łączyć się z obszarami równowagi ciecz–ciało stałe (np. krystalizacja z roztworów dwufazowych) lub ciecz–para. W układach ciecz–ciecz–para występuje wówczas heteroazeotropia lub heterozeotropia. Przemiany zachodzące w stanie równowagi dwóch cieczy z fazą stałą są wykorzystywane w procesach ekstrakcji. W tego rodzaju układach występują tzw. punkty inwariantne (niezmiennicze, zerozmienne), co wynika z reguły faz Gibbsa. Zgodnie z regułą układy dwuskładnikowe nie mają stopni swobody, gdy w równowadze znajdują się trzy fazy, na przykład dwie ciecze i kryształy, lub dwie ciecze i para. W czasie chłodzenia lub ogrzewania takiego układu obserwuje się "przystanek" (plateau). Temperatura nie zmienia się, dopóki jedna z faz nie zniknie[1][2][3].
- Przykładowe wykresy fazowe
Wykres fazowy układu tetrahydrofuran–woda
z górną i dolną temperaturą krytyczną mieszalności cieczy
Występowanie analogicznych zjawisk ograniczonej mieszalności składników w stopach metali umożliwia ich skuteczne uplastycznianie lub utwardzanie metodami obróbki cieplnej (np. obróbka cieplna stopów żelaza).
Liczba mieszalności
Rozpuszczalnikom organicznym przypisać można empiryczną wartość liczbową mieszalności w skali 1–31. Wzorcem najwyższej hydrofilowości o wartości 1 jest gliceryna, a wzorcem najwyższej lipofilowości o wartości 31 jest wazelina. Rozpuszczalniki, których różnica w liczbie mieszalności jest mniejsza niż 16 są zazwyczaj wzajemnie mieszalne. Dlatego rozpuszczalniki o liczbie mieszalności ok. 16 są zwykle mieszalne z wszystkimi innymi rozpuszczalnikami. Należą do nich np. pirydyna i izopropanol[4].
Zobacz też
Przypisy
- ↑ Stanisław Bursa: Chemia fizyczna. Wyd. Wyd. 2 popr. Warszawa: Państ. Wydaw. Naukowe, 1979. ISBN 83-01-00152-6. (pol.)
- ↑ Janusz Ciborowski: Podstawy inżynierii chemicznej. Warszawa: WNT, 1965. (pol.)
- ↑ Janusz Ciborowski: Inżynieria chemiczna. Wyd. II. Warszawa: PWT, 1955. (pol.)
- ↑ Yizhak Marcus: The Properties of Solvents. Wiley, 1998, s. 175–186. ISBN 0-471-98369-1.
Media użyte na tej stronie
Autor: Joanna Kośmider, Licencja: CC BY 3.0
Phase diagrams/ liquid-liquid equilibrium 1
Autor: Joanna Kośmider, Licencja: CC BY 3.0
Phase diagrams/ liquid-liquid equilibrium 4
Binary phase diagram of tetrahydrofuran with water (constructed from experimental data reported in Matous, J.; Novak, J.P.; Sobr, J.; Pick, J.: Coll. Czech. Chem. Commun. 37 (1972) 2653-2663 and Hayduk, W.; Laurie, H.; Smith, O.H.: J. Chem. Eng. Data 18 (1973) 373-376)
Phase diagrams/ liquid-liquid equilibrium 2
Wykresy fazowe/równowaga ciecz-ciecz 7