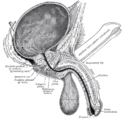
Moczownik
| ||
| Urachus | ||
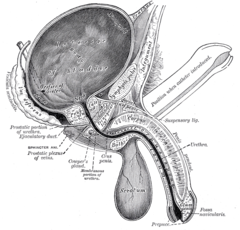 Przekrój poprzeczny miednicy męskiej. Moczownik widoczny u szczytu (summit) pęcherza. | ||
 Ściana przednia jamy brzusznej poniżej pępka. Pośrodku zarośnięty moczownik. | ||
| Prekursor | Omocznia | |
Moczownik, inaczej: przewód omoczniowy (łac. urachus) – pasmo tkanki łącznej będące pozostałością omoczni, jednej z błon płodowych, która w pewnym okresie znajduje się wewnątrz sznura pępowinowego. W życiu pozapłodowym struktura ta jest rozpoznawana jako więzadło pępkowe pośrodkowe. Leży ono w przestrzeni Retziusa między powięzią poprzeczną a otrzewną ścienną, która przykrywa je od tyłu (jako fałd pępkowy pośrodkowy). Łączy pępek ze szczytem pęcherza moczowego[1].
Przed zaniknięciem moczownik składa się z podłużnych pasm mięśniówki gładkiej, biorących swój początek bezpośrednio z mięśnia wypierającego pęcherza. Wewnątrz jest on wyłożony jednowarstwowym nabłonkiem gruczołowym[1][2]. Zachowanie drożności w życiu dorosłym może prowadzić do kilku nieprawidłowości rozwojowych, stosunkowo rzadko dających objawy kliniczne: torbieli moczownika, szczeliny pępkowej lub pełnej przetoki oraz nowotworów tej struktury.
Embriogeneza
Omocznia, będąca jedną z błon płodowych, powstaje w 16 dniu rozwoju zarodka jako uwypuklenie tylnej części pęcherzyka żółtkowego do szypuły łączącej. Uczestniczy w tworzeniu przegrody moczowo-odbytowej (ang. urorectal septum), oddzielającej zatokę moczowo-płciową od kanału odbytniczego. Ze szczytu zatoki powstaje między 9–13. tygodniem pęcherz moczowy. W szczytowym momencie swojego rozwoju (8 tydzień) zajmuje całą długość sznura pępowinowego; po tym czasie zanika, pozostawiając podłużny przewód zwany moczownikiem, łączący szczyt uformowanego pęcherza moczowego z pępkiem[3][4]. Przed końcem ciąży światło moczownika zamyka się i całość włóknieje, pozostawiając łącznotkankowe pasmo zwane więzadłem pępkowym pośrodkowym[5].
Znaczenie kliniczne
Uważa się, że izolowane anomalie wynikające z zachowania drożności moczownika są spotykane rzadko[6]. Najnowsze doniesienia podkreślają jednak fakt, że pozostałości moczownika (ang. urachal remnants, UR) można wykryć nawet u 60% pacjentów poniżej 16. roku życia, którzy zgłaszają objawy urologiczne. Odsetek rozpoznawanych UR maleje z wiekiem, co świadczy o postępującym procesie włóknienia w trakcie dalszego rozwoju[7]. Schorzenia onkologiczne dotyczące moczownika omówiono osobno.
Wyróżnia się cztery rodzaje możliwych nieprawidłowości anatomicznych[8]:
- Torbiel moczownika (ang. urachal cyst): najczęstsza wada polegająca na gromadzeniu się płynu surowiczego wewnątrz izolowanego odcinka moczownika, który zachował drożność. Aktywność wydzielnicza nabłonka prowadzi do wytworzenia cysty, mogącej zostać ogniskiem infekcji
- Drożny moczownik, inaczej: przetoka pępkowa (ang. urachal fistula): pełna drożność przewodu prowadzi do wyciekania moczu przez otwór w pępku
- Szczelina pępkowa (ang. urachal sinus): drożność górnej części przewodu, umożliwiająca włożenie sondy przez otwór w pępku
- Uchyłek pęcherzowy moczownika (ang. urachal a. vesicourachal diverticulum): najrzadziej spotykana przypadłość, kiedy drożny pozostaje dolny odcinek przewodu; sprzyja to retencji moczu oraz infekcjom
Notowano również pojedyncze przypadki przepukliny pęcherza moczowego (poprzez otwór w pępku)[9][10] oraz znacznego poszerzenia sznura pępowiny z powodu przetrwałego wewnątrz przewodu omoczniowego[11]. Podczas cewnikowania naczyń pępkowych perforacja drożnej części moczownika skutkuje gromadzeniem się moczu w otrzewnej z narastaniem wodobrzusza[12].
Diagnostyka
| ||
| ICD-10 | Q64.4 | |
| DiseasesDB | 32765 | |
| MeSH | D014496 | |
Do najczęściej zgłaszanych dolegliwości należy występowanie szczeliny pępkowej, wyczuwalna masa w podbrzuszu, ból brzucha, zapalenie pępka oraz (rzadziej) problemy z oddawaniem moczu[13]. W każdym wypadku należy wykluczyć współwystępowanie innych defektów układu moczowo-płciowego. Do najbardziej użytecznych badań dodatkowych należą ultrasonografia oraz tomografia komputerowa. Rozpoznanie szczeliny powinno nakłonić do wykonania zdjęcia tej przestrzeni z użyciem kontrastu (tzw. sinogram lub fistulogram)[8]. Cystografia mikcyjna pozwala zobrazować układ moczowy w całej rozciągłości.
W diagnozie różnicowej u noworodka uwzględnia się izolowane zapalenie pępka, ziarniniak kikuta pępowiny oraz zapalenie naczyń pępkowych; w późniejszym wieku m.in. zapalenie wyrostka robaczkowego[8]. Do wad układu moczowo-płciowego, stwierdzanych łącznie z pozostałościami moczownika, należą: refluks pęcherzowo-moczowodowy, wodonercze, niedrożność ujścia miedniczkowo-moczowodowego, torbiel jajnika[13].
Leczenie
Rozpoznanie w okresie noworodkowym pozostałości moczownika nie pociąga za sobą od razu interwencji chirurgicznej[14]. W ciągu pierwszych 6. miesięcy życia większość niewielkich zmian ulega spontanicznej regresji. W wieku późniejszym albo kiedy wada rozwojowa jest bardziej zaawansowana leczeniem z wyboru pozostaje jednak operacja[13]. Stany zapalne, wynikające przeważnie z nadkażenia torbieli (zwykle bakteriami: Staphylococcus spp. lub E. Coli), traktuje się wpierw antybiotykami, a potem wycina w ramach zabiegu[8].
Nowotwory moczownika
Zmiany neoplastyczne wywodzące się z tkanek moczownika stanowią mały (<0,4%) odsetek nowotworów pęcherza moczowego[15]. Nie ma dowodów, że stwierdzenie w dzieciństwie pozostałości moczownika sprzyja późniejszemu rozwojowi nowotworu[6]. Profilaktyczne usuwanie pozostałości bywa zalecane[16], ale stanowisko to spotyka się z krytyką niektórych środowisk[13]. Histologicznie nowotwory te mogą być zaklasyfikowane jako[1]:
- gruczolakoraki, powstające w 5–7. dekadzie życia
- mięsaki, stwierdzane u młodszych (<40 r.ż.) pacjentów
Leczenie polega na chirurgicznym wycięciu zmiany. Kliniczny stopień zaawansowania oraz margines resekcji są najistotniejszymi czynnikami prognostycznymi. Guz jest oporny na radio- i chemioterapię, więc do całkowitego wyleczenia niezbędne jest rozpoznanie go przed tym, jak zaczyna naciekać okoliczne narządy[17]. Z powodu późnego występowania objawów oraz agresywnego przebiegu 5-letni okres przeżycia kształtuje się na poziomie 50%[18][19].
Zobacz też
- Torbiel moczownika
- Błony płodowe, w tym: pęcherzyk żółtkowy, omocznia
- Układ moczowo-płciowy, w tym: pęcherz moczowy
- Rak pęcherza moczowego
Przypisy
- ↑ a b c Tsiouris Athanasios, Ahmed Hashim Uddin. Urachal tumour: clinical and radiological features of a poorly understood carcinoma. „Ann R Coll Surg Engl 2007; 89”, s. On-line Case Report, Ann R Coll Surg Engl 2007; 89.
- ↑ Standring 2008, rozdz. 75, sekcja: Ligaments of the bladder.
- ↑ Kozłowska 2005, s.97.
- ↑ Kozłowska 2005, ss.198–199.
- ↑ Sadler 2009, s. 368.
- ↑ a b Copp Hillary L.. Clinical Presentation and Urachal Remnant Pathology: Implications for Treatment. „Journal of Urology”, s. 1921–1924, October 2009 (ang.).
- ↑ Robert Y, Hennequin-Delerue C: Urachal remnants: sonographic assessment. J Clin Ultrasound 1996; 24: 339.
- ↑ a b c d Snyder Charles L.. Current management of umbilical abnormalities and related anomalies. „Seminars in Pediatric Surgery”, s. 41–49, 2007 (ang.).
- ↑ Lugo B, McNulty J. Bladder prolapse through a patent urachus:fetal and neonatal features. J Pediatr Surg 2006; 41(5): e5-7.
- ↑ Yeats M, Pinch L. Patent urachus with bladder eversion. J Pediatr Surg 2003; 38(11): E12-3.
- ↑ Nobuhara KK, Lukish JR The giant umbilical cord: an unusual presentation of a patent urachus. J Pediatr Surg 2004; 39(1): 128–9.
- ↑ Mata JA, Livne PM. Urinary ascites: complication of umbilical artery catheterization. Urology 1987; 30(4): 375–7.
- ↑ a b c d Galati Vincenzo , Donovan Ben. Management of Urachal Remnants in Early Childhood. „The Journal of Urology”, s. 1824–1827, October 2008 (ang.).
- ↑ Ueno T, Hashimoto H: Urachal anomalies: ultrasonography and management. J Pediatr Surg 2003; 38: 1203
- ↑ Sheldon CA, Clayman RV: Malignant urachal lesions. J Urol 1984; 131: 1
- ↑ Upadhyay V, Kukkady A. Urachal remnants: an enigma. Eur J Pediatr Surg 2003; 13: 372–6.
- ↑ Siefker-Radtke AO, Gee J Multimodality management of urachal carcinoma: the M.D. Anderson Cancer Center experience. J Urol 2003; 169: 1295–8.
- ↑ Ashley RA, Inman BA Urachal carcinoma: clinicopathologic features and long-term outcomes of an aggressive malignancy. Cancer 2006; 107: 712–20
- ↑ Pinthus JH, Haddad R Population based survival data on urachal tumors. J Urol 2006; 175(6): 2042–7.
Bibliografia
- Susan Standring: Gray's Anatomy 40th ed.. Elsevier, 2008. ISBN 978-0-443-06684-9.
- Sadler T.W.: Langman's Medical Embryology, 11th Edition. Lippincott Williams & Wilkins, 2009. ISBN 978-0781790697.
- Kozłowska Krystyna: Zarys embriologii wraz z elementami biologii rozwoju. Gdańsk: Akademia Medyczna w Gdańsku, 2005. ISBN 83-60253-05-6.
- Heinz Feneis: Ilustrowana anatomia człowieka. Mianownictwo międzynarodowe. Warszawa: PZWL, 2003. ISBN 83-200-2744-6. (polskie mianownictwo anatomiczne)
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.