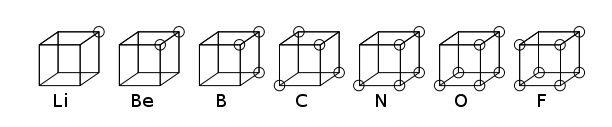
Model atomu Lewisa
Model atomu Lewisa (w oryginale ang. cubical model, pol. model sześcienny) – historyczny model budowy atomu, opublikowany w 1916 (choć opracowany już w 1902) przez amerykańskiego fizykochemika Gilberta N. Lewisa. Zakłada on m.in., że powłoki elektronowe mają kształt sześcianów, a elektrony rozmieszczone są na ich wierzchołkach. Model Lewisa ma charakter jakościowy. W przeciwieństwie do konkurencyjnego wówczas modelu atomu Bohra nie dostarcza aparatu matematycznego do obliczenia np. energii powłok czy długości linii widmowych[1]. Jest także sprzeczny z ówczesną, choć nieugruntowaną jeszcze wówczas[2], wiedzą o kształcie atomów czy też ruchu elektronów na powłokach. Pozwala on jednak przewidzieć niektóre własności wiązań chemicznych (np. regułę Abegga). Był punktem wyjścia do opracowania przez Lewisa teorii wiązania kowalencyjnego i koncepcji struktury punktowej[1].
Model wyszedł z użycia w obliczu rozwoju mechaniki kwantowej[3], której jednym z rezultatów jest wprowadzona do obiegu naukowego w 1926 teoria atomu oparta na koncepcji orbitali.
Lewis zdawał sobie sprawę z niekompletności modelu, dostrzegając np. to, że nie wyjaśnia on własności chemicznych pierwiastków spoza grup głównych[4], jak również błędnie implikuje obecność 8 elektronów na powłoce zewnętrznej atomu helu[5].
Postulaty Lewisa
Systematyczny opis swojego modelu Lewis opublikował w 1916 w artykule „The Atom and the Molecule” (pol. Atom i cząsteczka). Swoje rozumowanie skoncentrował wokół sześciu postulatów o strukturze atomowej[6].
- Atom posiada część wewnętrzną („jądro”), która nie ulega zmianom podczas typowych przemian chemicznych. W „jądrze” występuje nadmiar elektrycznego ładunku dodatniego w ilości zależnej od numeru grupy głównej układu okresowego, w której znajduje się pierwiastek.
- Atom posiada także część zewnętrzną („powłokę”), w której znajdują się elektrony. W swobodnym atomie (obojętnym elektrycznie) liczba elektronów odpowiada numerowi grupy układu okresowego. W wyniku przemian chemicznych liczba ta może się zmieniać od 0 do 8.
- Atom zmierza do posiadania parzystej liczby elektronów na „powłoce”, a w szczególności do posiadania tam 8 elektronów. Elektrony w normalnych warunkach rozmieszczone są symetrycznie na 8 wierzchołkach sześcianu.
- Dwie powłoki atomowe mogą się wzajemnie przenikać.
- Elektrony mogą zmieniać swoją pozycję na „powłoce”, jednak są one utrzymywane w miejscu przez pewne więzy. Wielkość sił wiążących oraz dokładne położenie elektronu są determinowane przez rodzaj atomu i atomów z nim związanych.
- Siły elektryczne pomiędzy cząstkami znajdującymi się bardzo blisko siebie nie spełniają prawa Coulomba.
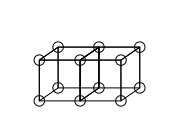
„Jądro” (ang. kernel), o którym mowa w pierwszym postulacie, nie jest tożsame z jądrem atomowym we współczesnym rozumieniu – raczej z całym atomem z wyłączeniem powłoki walencyjnej. Zgodnie z nomenklaturą stosowaną przez Lewisa, „powłoka” wypełniona 8 elektronami staje się częścią „jądra”, natomiast dodanie kolejnego elektronu skutkuje stworzeniem kolejnej „powłoki”[4]. W ten sposób powstawać miały współśrodkowe sześcienne powłoki elektronowe[4].
Wiązania chemiczne w modelu Lewisa
Według modelu Lewisa, atomy tworzą wiązania kowalencyjne poprzez łączenie się ze sobą sześciennych powłok elektronowych. Wiązanie pojedyncze powstaje wówczas, gdy powłoki złączą się jedną krawędzią (uwspólniając w ten sposób jedną parę elektronów)[7], natomiast podwójne wtedy, kiedy łączą się czterema krawędziami (uwspólniając 2 pary elektronów)[8].
Wiązanie jonowe modelowane jest przez przejście pojedynczego elektronu z powłoki jednego atomu na powłokę drugiego. Powłoki pozostają jednak niezłączone[7].
Istnienie wiązania potrójnego Lewis wyjaśniał, posiłkując się dodatkową hipotezą. Przypuszczał, że w niektórych przypadkach 8 atomów powłoki może łączyć się w 4 pary umieszczone na wierzchołkach czworościanu foremnego. Połączenie trzema krawędziami dwóch takich powłok powoduje uwspólnienie trzech par elektronów (wiązanie potrójne)[9].
Przypisy
- ↑ a b Lewis 1916 ↓.
- ↑ Langmuir 1919 ↓, s. 868.
- ↑ Pauling 1960 ↓.
- ↑ a b c Lewis 1916 ↓, s. 769.
- ↑ Lewis 1916 ↓, s. 774.
- ↑ Lewis 1916 ↓, s. 768.
- ↑ a b Lewis 1916 ↓, s. 775.
- ↑ Lewis 1916 ↓, s. 778.
- ↑ Lewis 1916 ↓, s. 780.
Bibliografia
- Gilbert N. Lewis. The Atom and the Molecule. „Journal of the American Society”. 38 (4), s. 762-785, 1916-04. DOI: 10.1021/ja02261a002 (ang.).
- Irving Langmuir. The Arrangement of Electrons in Atoms and Molecules. „Journal of the American Society”. 41 (6), s. 868-934, 1919-06. DOI: 10.1021/ja02227a002 (ang.).}
- Linus Pauling: The Nature of the Chemical Bond. Ithaca: Cornell University Press, 1960. ISBN 0-8014-0333-2.}
| |||||||||||||||||
Media użyte na tej stronie
Atoms according cubical atom model
Atoms according cubical atom model
Atoms according cubical atom model
Atoms according cubical atom model
Model of atom.