NF-κB
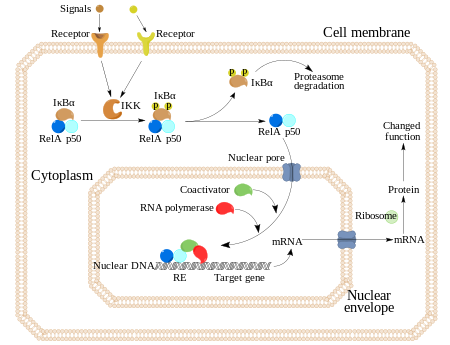
NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells) jest kompleksem białkowym działającym jako czynnik transkrypcyjny. NF-κB występuje w niemal wszystkich komórkach zwierzęcych i bierze udział w odpowiedzi komórki na bodźce, takie jak stres, cytokiny, wolne rodniki, ultrafiolet, czy antygeny[1][2][3][4][5]. NF-κB odgrywa kluczową rolę w regulacji odpowiedzi immunologicznej na infekcję. Zaburzenia w regulacji NF-κB są powiązane z nowotworami, zapaleniami oraz chorobami autoimmunologicznymi, wstrząsem septycznym, zakażeniami wirusowymi, oraz niewłaściwym rozwojem układu odpornościowego. NF-κB bierze także udział w procesach związanych z plastycznością synaptyczną oraz pamięcią[6].
Czynnik NF-κB został odkryty przez laureata nagrody Nobla, Davida Baltimore. Kluczem do odkrycia było oddziaływanie NF-kB z sekwencja 11 par zasad w enhancerze lekkiego łańcucha immunoglobuliny w limfocytach typu B[7].
U ssaków występuje pięć białek z rodziny białek NF-kB:[8]
| Klasa | Białko | Aliasy | Gen |
|---|---|---|---|
| Class I | NF-κB1 | p105 → p50 | NFKB1 |
| NF-κB2 | p100 → p52 | NFKB2 | |
| Class II | RelA | p65 | RELA |
| RelB | RELB | ||
| c-Rel | REL |
Poza tym, białka NF-kB obecne są u bezkręgowców, takich jak owady, jeżowce czy gąbki.
Białka NF-kB zawierają sekwencje lokalizacji jądrowej, które w stanie nieaktywnym są zablokowane przez dowiązane inhibitory z rodziny IκB. Aktywacja NF-kB następuje przez fosforylację i degradację IκB (poprzez kinazę IKK2). Po odłączeniu IkB, NF-kB natychmiast przedostają się do jądra, gdzie może być wykonana ich funkcja jako czynników transkrypcyjnych (związanie się z DNA).
Zobacz też
Linki zewnętrzne
- Thomas D Gilmore: The Rel/NF-κB Signal Transduction Pathway. Boston University. [dostęp 2009-03-04]. [zarchiwizowane z tego adresu (2007-11-23)].
Bibliografia
- Sankar Ghosh: Handbook of Transcription Factor NF-κB. Boca Raton: CRC, 2006. ISBN 0-8493-2794-6.
Przypisy
- ↑ a b Gilmore TD. Introduction to NF-κB: players, pathways, perspectives. „Oncogene”. 25 (51), s. 6680–4, 2006. DOI: 10.1038/sj.onc.1209954. PMID: 17072321 (ang.).
- ↑ a b Brasier AR. The NF-κB regulatory network. „Cardiovasc. Toxicol.”. 6 (2), s. 111–30, 2006. DOI: 10.1385/CT:6:2:111. PMID: 17303919 (ang.).
- ↑ a b Perkins ND. Integrating cell-signalling pathways with NF-κB and IKK function. „Nat. Rev. Mol. Cell Biol.”. 8 (1), s. 49–62, styczeń 2007. DOI: 10.1038/nrm2083. PMID: 17183360 (ang.).
- ↑ Gilmore TD. The Rel/NF-κB signal transduction pathway: introduction. „Oncogene”. 18 (49), s. 6842–4, 1999. DOI: 10.1038/sj.onc.1203237. PMID: 10602459 (ang.).
- ↑ Tian B, Brasier AR. Identification of a nuclear factor κ B-dependent gene network. „Recent Prog. Horm. Res.”. 58, s. 95–130, 2003. DOI: 10.1210/rp.58.1.95. PMID: 12795416 (ang.).
- ↑ Albensi BC, Mattson MP. Evidence for the involvement of TNF and NF-κB in hippocampal synaptic plasticity. „Synapse”. 35, s. 151–9, 2000. DOI: <151::AID-SYN8>3.0.CO;2-P 10.1002/(SICI)1098-2396(200002)35:2<151::AID-SYN8>3.0.CO;2-P. PMID: 10611641 (ang.).
- ↑ Sen R, Baltimore D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences. „Cell”. 46 (5), s. 705–16, 1986. DOI: 10.1016/0092-8674(86)90346-6. PMID: 3091258 (ang.).
- ↑ Nabel GJ, Verma IM. Proposed NF-κB/IκB family nomenclature. „Genes Dev.”. 7 (11), s. 2063, listopad 1993. PMID: 8224837 (ang.).
