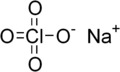Nadchloran sodu
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||
| Wzór sumaryczny | NaClO 4 | ||||||||||||||||||||||||||||||
| Masa molowa | 122,44 g/mol | ||||||||||||||||||||||||||||||
| Wygląd | białe, higroskopijne, krystaliczne ciało stałe | ||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||
| Numer CAS | 7601-89-0 | ||||||||||||||||||||||||||||||
| PubChem | 522606 | ||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||
| Inne aniony | NaClO, NaClO 2, NaClO 3 | ||||||||||||||||||||||||||||||
| Inne kationy | LiClO 4, KClO 4, RbClO 4, CsClO 4, FrClO 4 | ||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||
Nadchloran sodu, NaClO
4 – nieorganiczny związek chemiczny, sól sodowa kwasu nadchlorowego.
Właściwości
Nadchloran sodu jest najlepiej rozpuszczalną solą z nadchloranów. Jest białą, higroskopijną, krystaliczną substancją stałą. Zazwyczaj występuje jako monohydrat o rombowym układzie krystalograficznym[1].
Otrzymywanie
Związek jest otrzymywany w reakcji anodowego utleniania chloranu sodu na anodzie wykonanej z platyny, β-tlenku ołowiu(II) lub grafitu. Katoda jest wykonana ze stali[5].
Schematyczny przebieg reakcji jest następujący:
- NaClO
3 + H
2O → NaClO
4 + H
2↑
Ponadto jako produkt uboczny na anodach wydziela się tlen. W zależności od używanych anod wymagane jest napięcie prądu 4,75 V (anoda z tlenku ołowiu) lub 6 V (anoda platynowa). Zużycie energii dla procesu wynosi 2,5–3 kWh/kg nadchloranu sodu[5].
Zastosowanie
W laboratorium stosowany jest jako prekursor w syntezie innych nadchloranów. Z powodu jego higroskopijności znajduje niewielkie zastosowanie w pirotechnice. W napędach rakietowych może służyć jako źródło tlenu.
Przypisy
- ↑ a b c d e CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 90, Boca Raton: CRC Press, 2009, s. 4-91, ISBN 978-1-4200-9084-0 (ang.).
- ↑ sodium perchlorate (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-03-28].
- ↑ Sodium perchlorate (nr 410241) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2011-07-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Sodium perchlorate (nr 410241) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2011-07-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b Karl Heinz Büchel, Hans-Heinrich Moretto, Industrial Inorganic Chemistry, Weinheim–New York: Wiley-VCH, 2000, s. 172, DOI: 10.1002/9783527613328, ISBN 978-3-527-29849-5 (ang.).
Media użyte na tej stronie
Ball-and-stick model of the unit cell of potassium perchlorate, KClO4.
X-ray crystallographic data from D. Marabello, R. Bianchi, G. Gervasio and F. Cargnoni (2004). "An experimental (120 K) and theoretical electron-density study of KMnO4 and KClO4". Acta Cryst. A60: 494-501. DOI:10.1107/S0108767304015260..
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.chemical structure of sodium perchlorate
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.