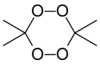
Nadtlenek acetonu
(cykliczny dimer) |
|
|
| Nazewnictwo |
|---|
| | Nomenklatura systematyczna (IUPAC) | 3,3,6,6-tetrametylo-1,2,4,5-tetraoksan | | Inne nazwy i oznaczenia | | APEX (z ang. acetone peroxide) |
|
| Ogólne informacje |
| Wzór sumaryczny | C6H12O4 |
| Masa molowa | 148,16 g/mol |
| Wygląd | biały krystaliczny proszek |
| Identyfikacja |
| Numer CAS | 1073-91-2 |
| PubChem | 536100 |
|
|
|
| Podobne związki |
| Podobne związki | HMTD |
Jeżeli nie podano inaczej, dane dotyczą
stanu standardowego (25 °C, 1000 hPa) |
Nadtlenek acetonu
(cykliczny trimer) |
|
|
| Nazewnictwo |
|---|
| | Nomenklatura systematyczna (IUPAC) | 3,3,6,6,9,9-heksametylo-1,2,4,5,7,8-heksaoksycyklononan | | Inne nazwy i oznaczenia | | TCAP (z ang. tri(cyclic acetone peroxide)), CTATP (z ang. cyclo(triacetonetriperoxide)), TATP (z ang. triacetonetriperoxide) |
|
| Ogólne informacje |
| Wzór sumaryczny | C9H18O6 |
| Masa molowa | 222,24 g/mol |
| Wygląd | biały krystaliczny proszek |
| Identyfikacja |
| Numer CAS | 17088-37-8 |
|
|
Jeżeli nie podano inaczej, dane dotyczą
stanu standardowego (25 °C, 1000 hPa) |
Nadtlenek acetonu
(cykliczny tetramer) |
|
|
| Nazewnictwo |
|---|
| | Nomenklatura systematyczna (IUPAC) | 3,3,6,6,9,9,12,12-oktametylo-1,2,4,5,7,8,10,11-oktaoksacyklododekan |
|
| Ogólne informacje |
| Wzór sumaryczny | C12H24O8 |
| Masa molowa | 296,15 g/mol |
| Wygląd | biały krystaliczny proszek |
| Identyfikacja |
| SMILES |
|---|
CC1(C)OOC(C)(C)OOC(C)(C)OOC(C)(C)OO1 |
|
|
|
Jeżeli nie podano inaczej, dane dotyczą
stanu standardowego (25 °C, 1000 hPa) |
Nadtlenek acetonu (peroksyaceton) – organiczny związek chemiczny, występujący głównie jako trimer nadtlenku acetonu, inicjujący, skrajnie niebezpieczny w użyciu i przygotowaniu materiał wybuchowy.
Związek ten został po raz pierwszy otrzymany w 1895 roku przez Richarda Wolffensteina[3].
Właściwości wybuchowe
Nadtlenek acetonu występuje w kilku formach, z których względnie trwała jest cykliczna forma trimeryczna (TCAP). Związek ten występuje też w cyklicznej i otwartej formie dimerycznej i jako wolny monomer, jednak są one bardzo niestabilne termodynamicznie i samorzutnie przechodzą w formę trimeryczną lub ulegają niekontrolowanemu, wybuchowemu rozkładowi jeszcze w czasie syntezy. Istnieje również forma tetrameryczna, trwalsza od trimerycznej, która jest otrzymywana inną metodą.
- Właściwości wybuchowe trimeru[4]:
- Wrażliwość na uderzenie: 0,3 J
- Wrażliwość na tarcie: 0,1 N
- Próba Trauzla: 250 cm³/10 g
- Prędkość detonacji: 5290 m/s (przy gęstości 1,2 g/cm³ i średnicy ładunku 6,3 mm)[5].
Wybuch małej ilości nadtlenku acetonu
Otrzymywanie
Cykliczny trimer (TCAP) można otrzymać przez reakcję acetonu z nadtlenkiem wodoru w środowisku kwaśnym. Syntezę wykonuje się przy zachowaniu bardzo ścisłych rygorów bezpieczeństwa, choć nawet w tych warunkach czasami zdarzają się wypadki. TCAP wybucha gwałtownie pod wpływem lekkiego nawet ogrzania lub potarcia. W trakcie przechowywania łatwo sublimuje do górnej części naczynia i samo otwarcie takiego naczynia może spowodować silną eksplozję. Produkcja TCAP jest zawsze obarczona wysokim ryzykiem.
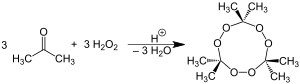
Reakcja syntezy trimeru nadtlenku acetonu

Reakcja syntezy tetrameru nadtlenku acetonu
[2]Przypisy
- ↑ a b Acetone peroxides, [w:] Basil T.B.T. Federoff Basil T.B.T. i inni, Encyclopedia of Explosives and Related Items, t. 1, Springfield, Virginia: National Technical Information Service, 1960, A41-A45 [dostęp 2019-07-23] (ang.).
- ↑ a b HengH. Jiang HengH. i inni, Tin Chloride Catalysed Oxidation of Acetone with Hydrogen Peroxide to Tetrameric Acetone Peroxide, „Journal of Chemical Research” (4), 1999, s. 288–289, DOI: 10.1039/a809955c (ang.).
- ↑ RichardR. Wolffenstein RichardR., Ueber die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd, „Chemische Berichte”, 28 (2), 1895, s. 2265-2269, DOI: 10.1002/cber.189502802208 (niem.).
- ↑ Rudolf Meyer, Josef Köhler, Axel Homburg: Explosives. Wyd. 6. Weinheim: Wiley-VCH, 2007, s. 343. ISBN 978-3-527-31656-4.
- ↑ Encyclopedia of Explosives and Related Items. Dover: Picatinny Arsenal, 1999, s. A44. OCLC 42241925.