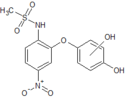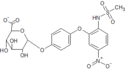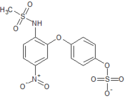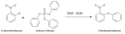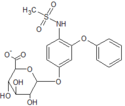Nimesulid
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | C13H12N2O5S | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 308,31 g/mol | ||||||||||||||||||||||||||||||||||
| Wygląd | żółtawy, krystaliczny proszek[1] | ||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
Nimesulid (łac. nimesulidum) – wielofunkcyjny organiczny związek chemiczny z grupy sulfonamidów, zbudowany ze szkieletu eteru difenylowego podstawionego grupą metanosulfonamidową i nitrową. Jest preferencyjnym inhibitorem cyklooksygenazy-2 (COX-2). Stosowany jako ogólnoustrojowy niesteroidowy lek przeciwzapalny o dodatkowym działaniu przeciwbólowym i przeciwgorączkowym[10].
Przy podaniu doustnym nimesulid wchłania się dobrze i szybko, jego działanie rozpoczyna się po około 15 minutach, maksymalny poziom we krwi osiąga po czasie 1–3 godzin. Lek metabolizowany jest w 99% w wątrobie, w której powstaje kilkanaście jego pochodnych, wydalanych głównie z moczem. W porównaniu do klasycznych niesteroidowych leków przeciwzapalnych wykazuje mniejszą liczbę działań ubocznych w zakresie górnego odcinka przewodu pokarmowego, natomiast możliwe są rzadkie przypadki ciężkich powikłań ze strony wątroby. Europejska Agencja Leków uznała w decyzji wydanej w 2012 roku, że w niektórych sytuacjach klinicznych korzyści ze stosowania nimesulidu przewyższają ryzyko, w związku z czym jest on w pewnych przypadkach podawany jako lek drugiego rzutu. Nie stwierdzono poważnych interakcji z innymi lekami, natomiast jego stosowanie razem z alkoholem może nasilać działania niepożądane, w szczególności wobec wątroby.
Historia
Wyniki badań z lat 60. XX wieku wskazujące na istotną rolę wolnych rodników w patofizjologii przewlekłych chorób zapalnych pozwalały przypuszczać, iż substancje pełniące funkcję zmiataczy wolnych rodników mogą prezentować nowy mechanizm działania przeciwzapalnego[11].
Historia odkrycia nimesulidu rozpoczyna się w 1969 roku w laboratorium koncernu 3M, w którym doktorzy George Moore, Karl F. Swingle oraz Bob Scherer (odkrywca kwasu meklofenamowego) wraz z zespołem pracowali nad nowymi pestycydami oraz substancjami przeciwzapalnymi. Nimesulid otrzymano podczas badań nad dwoma fluoroalkanosulfonanilidami: trimuflumidatem i diflumidonem[12]. Odkryty wówczas (2-fenoksy-4-nitro)trifluorometanosulfoanilid wykazywał działanie terapeutyczne na modelu zwierzęcym. W 1971 roku opracowano syntezę bezfluorowego analogu tego związku (2-fenoksy-4-nitro)metanosulfoanilidu i nadano mu nazwę roboczą „R-805”, zmienioną później na „nimesulid”. Dalsze badania były prowadzone w Riker Laboratories Inc. w Kalifornii[13]. W ich wyniku 8 października 1974 roku nimesulid został opatentowany w Stanach Zjednoczonych (nr patentu US 3.840.597). Za autorów wynalazku zostali uznani George Moore i Joseph Kenneth Harrington, natomiast właścicielem praw została Riker Laboratories Inc.[14] W przeprowadzonych wówczas badaniach klinicznych potwierdzono skuteczność przeciwbólową u pacjentów z reumatoidalnym zapaleniem stawów oraz zaobserwowano uszkodzenie wątroby przy bardzo wysokich dawkach leku (do 800 miligramów na dobę). W 1980 roku prawa do nimesulidu nabyła szwajcarska firma farmaceutyczna Helsinn Healthcare. Po przeprowadzeniu dalszych badań klinicznych oraz podstawowych badań nad mechanizmem działania leku, został on zarejestrowany po raz pierwszy w 1985 roku we Włoszech[15]. W kolejnych latach bezpośrednio lub przez udzielane licencje został wprowadzony na rynek w ponad 50 krajach Europy, Środkowej i Południowej Ameryki oraz Azji, z wyjątkiem Stanów Zjednoczonych, Wielkiej Brytanii i Niemiec[16] oraz Australii[15], gdzie nie podjęto próby wprowadzenia nimesulidu na rynek apteczny. Praw do zastosowań weterynaryjnych udzielono francuskiej firmie farmaceutycznej Virbac S.A.[17], po uzyskaniu światowej ochrony patentowej.
W drugiej połowie 1998 i pierwszych miesiącach 1999 roku pojawił się szereg doniesień o niekorzystnych skutkach ubocznych nimesulidu. Spowodowało to ograniczenie wskazań zarówno w zakresie wieku, jak i jednostek chorobowych, czasowe zawieszenie lub też wycofanie rejestracji w wielu krajach świata[18]. Ogółem w latach 1985–2000 zgłoszono 192 przypadki zdarzeń niepożądanych, z których 81 uznano za ciężkie[19].
Europejska Agencja Leków dokonała oceny nimesulidu dwukrotnie, w 2007 i 2010 roku, uznając w decyzji wydanej w 2012 roku, że korzyści ze stosowania ogólnoustrojowego leku w sytuacjach klinicznych, do których ograniczono jego stosowanie, przewyższają ryzyko[20].
Nazwa leku pochodzi od angielskiej nazwy chemicznej[21]: 4-nitro-2-phenoxymethanesulphonanilide.
Budowa cząsteczki a właściwości farmakologiczne
Nimesulid jest jedynym sulfonanilidem (sulfonowaną pochodną aniliny) w grupie niesteroidowych leków przeciwzapalnych. Pomimo że jest on jednocześnie sulfonamidem[22], nie wywołuje reakcji alergicznych u osób uczulonych na tę grupę związków[23]. Efekt biologiczny uzyskano poprzez podstawienie pierścienia w pozycji 4 grupą nitrową[13]. Grupa metylosulfonamidowa obecna w cząsteczce nimesulidu nie występuje w innych niesteroidowych lekach przeciwzapalnych, penetruje ona do drugiej kieszeni centrum receptorowego enzymu COX, co może wyjaśniać wyjątkowe preferencyjne działanie na COX-2, któremu towarzyszy wpływ na COX-1[10].
Otrzymywanie
Skala laboratoryjna
W skali laboratoryjnej syntezę można prowadzić w dwóch etapach. Procedurę rozpoczyna się od reakcji 2-fenoksyaniliny z chlorkiem metanosulfonowym, w wyniku której powstaje 2-fenoksymetanosulfoanilid.
W drugim etapie otrzymany 2-fenoksymetanosulfoanilid wprowadza się do 100% kwasu octowego, a następnie podczas podgrzewania dodawany jest 70% kwas azotowy. Po podgrzaniu mieszaninę dodaje się do wody i odfiltrowuje powstały osad. Po rekrystalizacji z etanolem uzyskuje się nimesulid w postaci delikatnie jasnobrązowego ciała stałego[15].
 Reakcja nitrowania 2-fenoksymetanosulfoanilidu do 4-nitro-2-fenoksyfenylometanosulfonamidu (nimesulidu)
Reakcja nitrowania 2-fenoksymetanosulfoanilidu do 4-nitro-2-fenoksyfenylometanosulfonamidu (nimesulidu)
Skala przemysłowa
Istnieje wiele metod syntezy nimesulidu na skalę przemysłową i nadal trwają prace nad uzyskaniem nowych metod nie zastrzeżonych w istniejących patentach[24].
W pierwszym etapie mieszaninę 2-chloronitrobenzenu i fosforanu trifenylu ogrzewa się w obecności wodorotlenku potasu oraz dimetyloformamidu (DMF) przez 1 godzinę. Po ostygnięciu do temperatury pokojowej dodaje się wodę, a następnie ekstrahuje eterem. Fazę organiczną suszy się bezwodnym siarczanem sodu i odparowuje pod zmniejszonym ciśnieniem, uzyskując produkt reakcji: 2-fenoksynitrobenzen.
 Synteza 2-fenoksynitrobenzenu. Wydajność: 93%
Synteza 2-fenoksynitrobenzenu. Wydajność: 93%
W drugim etapie przeprowadzana jest redukcja grupy nitrowej do aminowej. 2-Fenoksynitrobenzen dodawany jest do przygotowanej mieszaniny wody, sproszkowanego żelaza i kwasu octowego ogrzanej do temperatury 90–95 °C, następnie całość jest mieszana w tej samej temperaturze przez 3–4 godziny. Mieszaninę produktów reakcji alkalizuje się przy użyciu wody amoniakalnej, odfiltrowywuje na gorąco, przemywa wodą, a następnie ekstrahuje toluenem, do którego przechodzi otrzymana 2-fenoksyanilina.
W trzecim etapie do 2-fenoksyaniliny w chlorku metylenu i trietyloaminie dodawany jest stopniowo chlorek metanosulfonowy przez 3–4 godziny w temperaturze 0–5 °C. Po zatrzymaniu reakcji poprzez dodanie wody oddziela się fazę organiczną zawierającą mieszaninę 2-fenoksymetanosulfoanilidu i 2-fenoksymetanodwusulfoanilidu. Po przemyciu wodą, ekstrakcji z użyciem roztworem wodorotlenku sodu i zakwaszeniu uzyskiwany jest 2-fenoksymetanosulfoanilid.
 Sulfonowanie 2-fenoksyaniliny. Wydajność 2-fenoksymetanosulfoanilidu: 85%
Sulfonowanie 2-fenoksyaniliny. Wydajność 2-fenoksymetanosulfoanilidu: 85%
Czwarty etap syntezy to nitrowanie. 2-Fenoksymetanosulfoanilid jest rozpuszczany na ciepło w 100% kwasie octowym, a następnie dodaje się stopniowo 70% kwas azotowy przez ponad 15 minut, po czym mieszanina jest ogrzewana na łaźni parowej przez 4 godziny i wytrącana poprzez dodanie do wody. Osad zawierający dwunitrofenoksyfenylometanosulfonamid i nitrofenoksyfenylometanosulfonamid zostaje oddzielony przez filtrowanie. Krystalizacja z metanolu pozwala na uzyskanie czystego produktu docelowego (nimesulidu)[25].
 Nitrowanie 2-fenoksymetanosulfoanilidu. Wydajność 4-nitro-2-fenoksyfenylometanosulfonamidu (nimesulidu): 85%
Nitrowanie 2-fenoksymetanosulfoanilidu. Wydajność 4-nitro-2-fenoksyfenylometanosulfonamidu (nimesulidu): 85%
Właściwości
Właściwości fizyczne
Nimesulid jest słabo rozpuszczalny w wodzie (0,014 mg/ml), natomiast dobrze rozpuszcza się w acetonie, chloroformie, octanie etylu, słabiej w etanolu (3,32 mg/ml), PEG 400 i ich mieszaninie. Jego rozpuszczalność zwiększa się wraz ze wzrostem pH (1000 razy przy wzroście pH o 3). Rozpuszczalność nimesulidu w wodzie zwiększa się istotnie przy użyciu etanolu jako drugiego rozpuszczalnika. Nimesulid jest również rozpuszczalny w glikolu propylenowym i mieszaninie gliceryny z etanolem, które są uważane za bezpieczne przy podawaniu doustnym. Informacje te mogą być przydatne przy projektowaniu płynnych i pozajelitowych form leku[26]. Układ przestrzenny cząsteczki z odchylonym pod kątem 75° względem nitroaminosulfoanilidu podstawnikiem fenylowym w pozycji O5 jest stabilizowany przez wewnątrzcząsteczkowe wiązanie wodorowe pomiędzy grupą NH a atomem tlenu. Spójność kryształu nimesulidu jest wynikiem wzajemnych oddziaływań wiązania NH−O i sił van der Waalsa[27].
Właściwości chemiczne
Główną chemiczną własnością nimesulidu oraz jego głównego metabolitu hydroksynimesulidu jest potencjał antyoksydacyjny, przy czym w przypadku rodnika hydroksylowego OH•
hydroksynimesulid jest słabszym zmiataczem niż nimesulid, natomiast w przypadku rodnika ponadtlenkowego O•−
2 jest odwrotnie[28].
Pod wpływem światła ultrafioletowego nimesulid ulega hydrolizie na 2-fenoksy-4-nitroanilinę i kwas metanosulfonowy[29]:
- [C
12H
8NO
3]−NHSO
2CH
3 + H
2O + hν → [C
12H
8NO
3]−NH
2 + CH
3SO
3H
Pod wpływem prądu elektrycznego grupa nitrowa nimesulidu ulega redukcji do grupy nitrozowej[30]:
- [C
13H
12NO
3S]−NO
2 + e−
⇄ [C
13H
12NO
3S]−NO−
2- 2[C
13H
12NO
3S]−NO−
2 + 2H+
→ [C
13H
12NO
3S]−NO
2 + [C
13H
12NO
3S]−NO + H
2O - 2[C
Mechanizm działania

1 – centralny układ nerwowy,
2 – układ kostno stawowy,
3 – naczynia krwionośne,
IL-6 – interleukina 6,
MMP – metaloproteinazy,
COX – cyklooksygenaza,
NO – tlenek azotu,
eTHC – endokannabinoidy,
MAO – szlak przekaźnictwa monoaminoergicznego,
PSS – szlak przekaźnictwa cholinergicznego
Mechanizm działania niesteroidowych leków przeciwzapalnych
Podstawowy mechanizm działania niesteroidowych leków przeciwzapalnych odbywa się poprzez hamowanie cyklooksygenazy, enzymu przekształcającego kwas arachidonowy w prostaglandynę H2. Prostaglandyna H2 jest prekursorem wszystkich prostaglandyn – hormonów wywołujących rozszerzanie naczyń krwionośnych, zwiększanie przepuszczalności ściany naczyń krwionośnych oraz zwiększanie czułości receptorów bólu na bodźce mechaniczne i chemiczne (bradykinina, histamina, TNF-α, substancja P). Dwie formy cyklooksygenazy COX-1 i COX-2, kodowane przez dwa różne geny zlokalizowane w chromosomie 1 i chromosomie 9, podczas procesu zapalnego pozostają w równowadze i działając równolegle, aktywują wszystkie szlaki przemiany kwasu arachidonowego[10][31]. W przeciwieństwie do kwasu acetylosalicylowego, który poprzez acetylację seryny w centrum aktywnym trwale inaktywuje cyklooksygenazę[32], hamowanie cyklooksygenazy przez niesteroidowe leki przeciwzapalne jest odwracalne[22]. Niesterydowe leki przeciwzapalne oddziaływają również na poziomie centralnego układu nerwowego, naczyń krwionośnych i w miejscu zapalenia na endokannabinoidy, tlenek azotu oraz szlaki przekaźnictwa monoaminoergicznego i przywspółczulnego. Grupa niesterydowych leków przeciwzapalnych obejmuje nieselektywne, preferencyjne (do której należy nimesulid) i selektywne inhibitory cyklooksygenazy. [10][31]
Mechanizm działania nimesulidu
Nimesulid jest lekiem o złożonym mechanizmie działania:
- hamuje aktywność cyklooksygenazy[2] (10–20 razy COX-2 niż COX-1[32])
- hamuje wydzielanie histaminy z komórek tucznych i granulocytów zasadochłonnych
- zmiata rodniki hydroksylowe, rodniki tlenowe oraz hamuje wydzielanie kwasu podchlorawego oraz fagocytozę przez aktywowane granulocyty obojętnochłonne
- hamuje przyleganie oraz ekspresję receptorów granulocytów obojętnochłonnych
- hamuje fosfodiesterazę IV, czego następstwem jest zwiększenie wewnątrzkomórkowego poziomu c-AMP, co powoduje zmniejszenie produkcji lub wydzielania histaminy, leukotrienów, cytokin prozapalnych oraz uwalniania enzymów przez leukocyty
- hamuje produkcję czynnika aktywującego płytki przez różne komórki, w tym także aktywowane płytki krwi
- hamuje metaloproteinazy macierzy pozakomórkowej, które mogą powodować uszkodzenie proteoglikanów, kolagenu, a także innych elementów tkanki łącznej w stawach
- hamuje proces apoptozy w chondrocytach i innych komórkach tkanki łącznej u pacjentów z chorobą zwyrodnieniową stawów
- hamuje aktywność syntazy tlenku azotu, następowo produkcję tlenku azotu i powstającego z reakcji tlenku azotu z rodnikami hydroksylowymi nadtlenoazotynu, które są kluczowymi mediatorami w zapalnym uszkodzeniu tkanek
- aktywuje receptory dla glikokortykosteroidów, prowadząc do zwiększenia wpływu na komórki endogennych glikokortykosteroidów[21].
Pomimo iż nimesulid zaliczany jest do inhibitorów cyklooksygenazy preferencyjnie hamujących aktywność COX-2, ogólnie jest bardzo słabym inhibitorem cyklooksygenazy, a jego głównym mechanizmem działania jest hamowanie metaloproteinaz[22].
Farmakokinetyka
Podany doustnie dobrze, szybko i prawie całkowicie wchłania się z przewodu pokarmowego, podany doodbytniczo wolniej. Nie zaobserwowano różnic we wchłanianiu pomiędzy różnymi formami doustnymi. Dostępność biologiczna wynosi 99% przy podaniu doustnym[2] (80–100%)[8] i 54–64% przy podaniu doodbytniczym[9][2]. Po podaniu 100 mg doustnie maksymalne stężenie we krwi osiąga po 1–3 godzinach, po podaniu doodbytniczym 200 mg po 4–5 godzinach. W około 97,5% wiąże się z albuminami. Pomimo umiarkowanie niskiej objętości dystrybucji dobrze przenika do płynu stawowego[21], w którym jego poziom utrzymuje się o wiele dłużej niż we krwi[10], oraz płynów wysiękowych[2]. Czas półtrwania T0,5 wynosi 1,8–4,7 godziny dla leku i 3–9 godzin dla głównego metabolitu. Jest metabolizowany w wątrobie poprzez cytochrom P450.
Wydalany jest w 50,5–62,5% z moczem i 17,9–36,2% z kałem głównie w postaci glukuronianów i siarczanów. W postaci niezmienionej opuszcza organizm 1–3% leku. W przypadku zaburzonej funkcji nerek nie dochodzi do kumulowania się zarówno nimesulidu, jak i jego metabolitów. W przypadku zaburzonej funkcji wątroby dochodzi do 4–5-krotnego zmniejszenia eliminacji nimesulidu z organizmu[2].
Metabolizm

Nimesulid jest metabolizowany poprzez trzy podstawowe szlaki metaboliczne: rozkład cząsteczki na poziomie wiązania eterowego, redukcja grupy −NO
2} do −NH
2 oraz hydroksylacja pierścienia aromatycznego. Pozostałe metabolity są produktami współistniejącej hydroksylacji i redukcji, acetylacji grupy aminowej, sprzężania z kwasem glukuronowym lub sulfonowaniem hydroksylowanych metabolitów[34], jedynie 1–3% leku zostaje wydalone w stopniu niezmienionym[8].
Jedynym metabolitem obecnym w surowicy krwi[35] z ogółem zidentyfikowanych 16 metabolitów[10] nimesulidu (nazwanych M1 do M18) jest N-[2-(4-hydroksyfenoksy)-4-nitrofenylo]metanosulfonamid (hydroksynimesulid lub M1) mający również działanie przeciwzapalne i przeciwbólowe, jednakże słabsze niż lek, którego jest pochodną[36]. Został on zidentyfikowany również w moczu. Drugim ważnym metabolitem obecnym w moczu i kale jest M5, pozostałe metabolity znajdowane są w mniejszych stężeniach, a metabolity M2, M3 i M4 uważane są za pośrednie metabolity na szlaku biotransformacji nimesulidu.
| Metabolit | Wzór chemiczny | Obecność w moczu | Opis |
|---|---|---|---|
| M1 |  | 1,4% | ma aktywność terapeutyczną, jedyny istotny metabolit obecny w surowicy, powstaje z nimesulidu w wyniku hydroksylowania pierścienia fenylowego |
| M2 |  | brak | pośredni metabolit powstający w wyniku redukcji grupy NO2 do grupy NH2 |
| M3 |  | brak | pośredni metabolit powstający z metabolitu M2 poprzez hydroksylowanie pierścienia fenylowego |
| M4 |  | brak | pośredni metabolit powstający z metabolitu M2 poprzez acetylowanie grupy aminowej |
| M5 |  | brak | powstaje z metabolitu M3 poprzez acetylowanie lub z metabolitu M4 poprzez hydroksylowanie |
| M6 |  | brak | powstaje z nimesulidu poprzez rozpad wiązania eterowego |
| M7 |  | brak | powstaje z postulowanego metabolitu M2 w wyniku substytucji grupy aminowej grupą hydroksylową |
| M8 |  | 6,4% | powstaje z metabolitu M7 poprzez kondensację z kwasem glukuronowym |
| M9 |  | brak | powstaje z metabolitu M1 poprzez estryfikację grupy hydroksylowej resztą kwasu siarkowego |
| M10 |  | 14,6% | powstaje z metabolitu M1 poprzez kondensację z kwasem glukuronowym |
| M11 |  | 2,4% | powstaje z nimesulidu w wyniku hydroksylowania pozycji 2 lub 3 pierścienia fenylowego i kondensacji z kwasem glukuronowym |
| M12 |  | brak | powstaje z metabolitu M1 w wyniku kolejnego hydroksylowania pierścienia |
| M13 |  | brak | powstaje z metabolitu M7 poprzez estryfikację grupy hydroksylowej resztą kwasu siarkowego |
| M14 |  | 4,6% | powstaje z metabolitu M5 poprzez kondensację z kwasem glukuronowym |
| M15 |  | 2,3% | powstaje z metabolitu M12 poprzez kondensację z kwasem glukuronowym |
| M16 |  | 2,8% | powstaje z metabolitu M12 poprzez estryfikację grupy hydroksylowej resztą kwasu siarkowego |
| M17 |  | 5,1% | powstaje z metabolitu M2 poprzez kondensację z kwasem glukuronowym |
| M18 |  | 2,5% | powstaje z metabolitu M5 poprzez estryfikację grupy hydroksylowej resztą kwasu siarkowego |
Zastosowania
Wskazania
Nimesulid może być stosowany wyłącznie jako lek drugiego rzutu, w następujących wskazaniach[37][38][39][40]:
- leczenie ostrego bólu
- pierwotne bolesne miesiączkowanie.
W dniu 20 stycznia 2012 roku decyzją Komisji Europejskiej 2012/C 78/02[41] wykreślono z charakterystyki tego produktu leczniczego następujące wskazanie[42]:
- leczenie objawowe dolegliwości bólowych w przebiegu choroby zwyrodnieniowej stawów.
Zastosowania w trakcie badań
Cyklooksygenaza COX-2 jest nadmiernie produkowana w licznych nowotworach[43], a także hodowlach komórek nowotworowych, a prostaglandyny mają istotny wpływ na metabolizm komórek, ich proliferację, resorpcję kości oraz zdolność do tworzenia przerzutów przez nowotwory[44]. Obserwacje te leżą u podłoża badań zastosowania nimesulidu w poniższych wskazaniach:
- rak piersi bez receptorów estrogenowych – zapobieganie transformacji w ten typ nowotworu u kobiet z grupy wysokiego ryzyka. Grupę kobiet poddano rocznej terapii w trzech grupach: 100 mg nimesulidu, 20 mg simwastatyny, placebo. W roku 2013 badanie kliniczne jest w fazie obserwacji kobiet poddanych rocznej terapii[45].
- pierwotny chłoniak wysiękowy w przebiegu zespołu nabytego niedoboru odporności – badania w etapie przedklinicznym, stwierdzono pozytywny efekt cytotoksyczny na ludzkie linie komórkowe[46].
Choroba Alzheimera posiada wszystkie cechy choroby zapalnej, a badania epidemiologiczne sugerują wolniejsze pogarszanie się funkcji poznawczych u chorych przewlekle pobierających niesterydowe leki przeciwzapalne.
- Badania kliniczne sugerują neuroprotekcyjne działanie nimesulidu, przy nieznanym mechanizmie takiego oddziaływania – jednak pomimo poprawy u pojedynczych pacjentów nie stwierdzono statystycznie istotnej poprawy[47][48].
Interakcje
Nie stwierdzono istotnych interakcji nimesulidu, ale ponieważ hamuje on izoenzym CYP2C9 cytochromu P450 (chociaż nie jest jego silnym inhibitorem[49]), może dochodzić do zwiększenia stężenia w surowicy leków metabolizowanych w tym szlaku metabolicznym (heksobarbital, nordazepam, diazepam i prokwanil[50]).
- Acenokumarol – nie stwierdzono interakcji farmakokinetycznych. Ponieważ jednoczesne leczenie acenokumarolem i nimesulidem może zwiększać ryzyko krwawień, powinno być stosowane w sytuacjach niezbędnych klinicznie, wymaga częstszej kontroli poziomu INR i jest bezwzględnie przeciwwskazane u pacjentów z zaburzeniami krzepnięcia[8][37][38][40][39][51][52][53].
- Cyklosporyna – jednoczesne leczenie cyklosporyną i nimesulidem może nasilać nefrotoksyczne działanie cyklosporyny[8][37][38][40][39][51][52][53].
- Cymetydyna – nie stwierdzono interakcji farmakokinetycznych i farmakodynamicznych[54].
- Digoksyna – nie stwierdzono interakcji farmakokinetycznych i farmakodynamicznych[55]
- Furosemid – nimesulid powoduje zmniejszenie wchłaniania i biodostępności furosemidu oraz indukowanego przez furosemid wydalania sodu oraz potasu. Jednoczesne leczenie nimesulidem i furosemidem u pacjentów z niewydolnością krążenia i niewydolnością nerek wymaga zachowania szczególnej ostrożności[56][57].
- Glibenklamid – nie stwierdzono interakcji farmakokinetycznych i farmakodynamicznych[54].
- Kortykosteroidy – jednoczesne leczenie kortykosteroidami i nimesulidem może zwiększać ryzyko wystąpienia choroby wrzodowej żołądka, dwunastnicy oraz krwawień z przewodu pokarmowego[8][37][38][40][39][51][52][53].
- Kwas acetylosalicylowy – jednoczesne leczenie kwasem acetylosalicylowym i nimesulidem może zwiększać ryzyko choroby wrzodowej żołądka, dwunastnicy, krwawień (szczególnie z przewodu pokarmowego) i jest bezwzględnie przeciwwskazane u pacjentów z zaburzeniami krzepnięcia[8][37][38][40][39][51][52][53].
- Leki przeciwpłytkowe – jednoczesne leczenie lekami przeciwpłytkowymi (klopidogrel, dipirydamol) i nimesulidem może zwiększać ryzyko wystąpienia choroby wrzodowej żołądka, dwunastnicy oraz krwawień z przewodu pokarmowego[8][37][38][40][39][51][52][53].
- Metotreksat – podanie nimesulidu 24 godziny przed lub po podaniu metotreksatu może nasilić jego toksyczność poprzez zwiększenie jego stężenia w surowicy krwi[8][37][38][40][39][51][52][53].
- Niesterydowe leki przeciwzapalne – jednoczesne leczenie nimesulidem i innymi niesterydowymi lekami przeciwzapalnymi może zwiększać ryzyko krwawień i jest bezwzględnie przeciwwskazane u pacjentów z zaburzeniami krzepnięcia[8][37][38][40][39][51][52][53].
- Selektywne inhibitory zwrotnego wychwytu serotoniny – jednoczesne leczenie SSRI i nimesulidem może zwiększać ryzyko wystąpienia choroby wrzodowej żołądka, dwunastnicy oraz krwawień z przewodu pokarmowego[8][37][38][40][39][51][52][53].
- Teofilina – nie stwierdzono interakcji farmakokinetycznych i farmakodynamicznych[57].
- Warfaryna – nie stwierdzono interakcji farmakokinetycznych. Ponieważ jednoczesne leczenie warfaryną i nimesulidem może zwiększać ryzyko krwawień, powinno być stosowane w sytuacjach niezbędnych klinicznie, wymaga częstszej kontroli poziomu INR i jest bezwzględnie przeciwwskazane u pacjentów z zaburzeniami krzepnięcia[8][37][38][40][39][51][52][53].
- Węglan litu – ponieważ niesterydowe leki przeciwzapalne mogą zmniejszać wydalanie węglanu litu (co może prowadzić do zwiększenia jego stężenia w osoczu i wystąpienia objawów toksyczności), jednoczesne leczenie węglanem litu i nimesulidem wymaga wzmożonej kontroli poziomu litu we krwi[8][37][38][40][39][51][52][53].
- Wodorotlenek glinu – nie stwierdzono interakcji z wodorotlenkiem glinu w środkach zobojętniających treść żołądkową[58].
- Wodorotlenek magnezu – nie stwierdzono interakcji z wodorotlenkiem magnezu w środkach zobojętniających treść żołądkową[58].
Przeciwwskazania i środki ostrożności
Istnieją następujące przeciwwskazania stosowania leku i sytuacje, gdy zaleca się zachowanie ostrożności[8][37][38][40][39][51][52][53]:
- znana nadwrażliwość na nimesulid lub którykolwiek ze składników pomocniczych
- reakcje nadwrażliwości w wywiadzie (np. skurcz oskrzeli, nieżyt nosa, pokrzywka) na kwas acetylosalicylowy lub inne niesteroidowe leki przeciwzapalne
- objawy uszkodzenia wątroby wywołane podaniem nimesulidu w wywiadzie
- jednoczesna ekspozycja na substancje o potencjalnym działaniu uszkadzającym wątrobę
- uzależnienie od alkoholu, leków lub substancji odurzających
- czynna choroba wrzodowa żołądka lub dwunastnicy, przebyte, nawracające epizody choroby wrzodowej lub krwawień z przewodu pokarmowego, krwawienie do ośrodkowego układu nerwowego w wywiadzie oraz inne czynne krwawienia i choroby przebiegające z krwawieniem
- ciężkie zaburzenia krzepnięcia
- ciężkie zaburzenia czynności nerek
- zaburzenia czynności wątroby
- pacjenci z gorączką i (lub) objawami grypopodobnymi
- dzieci poniżej 12 lat
- trzeci trymestr ciąży i okres karmienia piersią.
Działania niepożądane
Działania niepożądane stwierdzone podczas badań klinicznych oraz późniejszych obserwacji[8][37][38][40][39][51][52][53]:
| Rodzaj zaburzenia | Częstość występowania | Działanie niepożądane |
|---|---|---|
| Krew i układ limfatyczny | rzadkie | niedokrwistość[i] |
| eozynofilia[i] | ||
| bardzo rzadkie | małopłytkowość | |
| pancytopenia | ||
| skaza krwotoczna | ||
| Układ odpornościowy | rzadkie | nadwrażliwość[i] |
| bardzo rzadkie | anafilaksja | |
| Metabolizm i odżywianie | rzadkie | hiperkaliemia[i] |
| Psychiczne | rzadkie | lęki[i] |
| niepokój[i] | ||
| koszmary senne[i] | ||
| Układ nerwowy | niezbyt częste | zawroty głowy |
| bardzo rzadkie | bóle głowy | |
| senność | ||
| zespół Reye’a | ||
| Wzrok | rzadkie | zamazane widzenie[i] |
| bardzo rzadkie | zaburzenia widzenia | |
| Słuch i błędnik | bardzo rzadkie | zawroty głowy |
| Serce | rzadkie | tachykardia[i] |
| Układ naczyniowy | niezbyt częste | nadciśnienie[i] |
| rzadkie | krwawienia[i] | |
| zmiany ciśnienia tętniczego[i] | ||
| uderzenia gorąca[i] | ||
| Układ oddechowy | niezbyt częste | duszność[i] |
| bardzo rzadkie | astma oskrzelowa | |
| skurcz oskrzeli | ||
| Żołądek i jelita | częste | biegunka[i] |
| nudności[i] | ||
| wymioty[i] | ||
| niezbyt częste | zaparcia[i] | |
| wzdęcia[i] | ||
| zapalenie błony śluzowej żołądka[i] | ||
| krwawienie z przewodu pokarmowego[42] | ||
| owrzodzenie i perforacja żołądka[42] | ||
| owrzodzenie i perforacja dwunastnicy[42] | ||
| bardzo rzadkie | bóle brzucha | |
| niestrawność | ||
| zapalenie jamy ustnej | ||
| smoliste stolce | ||
| Wątroba i drogi żółciowe | bardzo rzadkie | zapalenie wątroby |
| piorunujące zapalenie wątroby (włączając przypadki śmiertelne) | ||
| żółtaczka | ||
| cholestaza | ||
| Skóra i tkanka podskórna | niezbyt częste | świąd[i] |
| wysypka[i] | ||
| zwiększona potliwość[i] | ||
| rzadkie | rumień[i] | |
| zapalenie skóry[i] | ||
| bardzo rzadkie | pokrzywka | |
| obrzęk naczynioruchowy | ||
| obrzęk twarzy | ||
| rumień wielopostaciowy | ||
| zespół Stevensa-Johnsona | ||
| zespół Lyella | ||
| Nerki i drogi moczowe | rzadkie | bolesne oddawanie moczu[i] |
| krwiomocz[i] | ||
| zatrzymanie moczu[i] | ||
| bardzo rzadkie | niewydolność nerek | |
| skąpomocz | ||
| śródmiąższowe zapalenie nerek | ||
| Ogólne i miejscowe | niezbyt częste | obrzęki[i] |
| rzadkie | złe samopoczucie[i] | |
| osłabienie[i] | ||
| bardzo rzadkie | nadmierne obniżenie temperatury ciała | |
| Badania diagnostyczne | częste | zwiększenie aktywności enzymów wątrobowych[i] |
Dawkowanie
Nimesil jest lekiem przeciwbólowym dozwolonym do stosowania u osób dorosłych oraz dzieci powyżej 12 roku życia. Nimesulid może być podawany doustnie (kapsułki, tabletki, saszetki z proszkiem lub granulatem do zawiesiny), doodbytniczo (czopki)[20], domięśniowo[59] oraz zewnętrznie (maść). Postacie leku do stosowania doodbytniczego, domięśniowego oraz zewnętrznego są niedostępne w Polsce[60].
Osoby dorosłe oraz dzieci powyżej 12 roku życia
| Drogi podawania | Dawkowanie |
|---|---|
| Doustnie | |
| Doodbytniczo | |
| Zewnętrznie |
|
| Domięśniowo |
|
Pacjenci w podeszłym wieku
Nie ma konieczności dostosowywania dawki leku[8][37][38][40][39][51][52][53].
Dzieci
Leku nie należy stosować u dzieci poniżej 12 lat[8][37][38][40][39][51][52][53].
| Drogi podawania | Dawkowanie |
|---|---|
| Doustnie | |
| Doodbytniczo |
|
| Zewnętrznie |
|
Zaburzenia czynności nerek
Nie ma konieczności dostosowywania dawki nimesulidu u pacjentów z niewielką i umiarkowaną niewydolnością nerek[8][37][38][40][39][51][52][53]:
| Klirens kreatyniny | Dawkowanie |
|---|---|
| 30–80 ml/min | dawka bez zmian |
| <30 ml/min | nie stosować |
Zaburzenia czynności wątroby
Nimesulid jest przeciwwskazany przy zaburzeniach czynności wątroby[8][37][38][40][39][51][52][53].
Wpływ na prowadzenie pojazdów
Nie przeprowadzono badań klinicznych oceniających wpływ nimesulidu na prowadzenie pojazdów i obsługę urządzeń mechanicznych[37]. Lek może upośledzać zdolność prowadzenia pojazdów i obsługi urządzeń mechanicznych u pacjentów, u których wystąpi senność lub zawroty głowy[63].
Ciąża i laktacja
Nimesulidu nie należy stosować w ciąży i okresie karmienia piersią, u kobiet planujących zajść w ciążę należy stosować możliwie najmniejszą dawkę przez możliwie najkrótszy okres, w pierwszym i drugim trymestrze ciąży nie zaleca się stosowania poza przypadkami zdecydowanej konieczności i w takich przypadkach należy stosować możliwie najmniejszą dawkę przez możliwie najkrótszy okres. Ryzyko wystąpienia efektów ubocznych zwiększa się ze zwiększaniem dawki i czasu trwania leczenia[8][37][38][40][39][51][52][53].
W badaniach na zwierzętach wykazano, iż podawanie leków z tej grupy powodowało poronienie przed lub po zagnieżdżeniu się jaja płodowego, śmiertelność zarodka lub płodu oraz zwiększoną częstość występowania różnych wad płodu, włączając zaburzenia układu sercowo-naczyniowego[8][37][38][40][39][51][52][53].
I i II trymestr ciąży
Podczas I i II trymestru ciąży nimesulid może narażać płód na[8][37][38][40][39][51][52][53]:
- zwiększone ryzyko poronienia
- zwiększone ryzyko wad budowy układu sercowo-naczyniowego (z poniżej 1% do 1,5%)
- zwiększone ryzyko wytrzewienia
III trymestr ciąży
Podczas III trymestru ciąży nimesulid może narażać na[8][37][38][40][39][51][52][53]:
- działanie toksyczne na serce i płuca (z przedwczesnym zamknięciem przewodu tętniczego i nadciśnieniem płucnym)
- zaburzenia czynności nerek (z niewydolnością nerek z małowodziem)
- wydłużenie czasu krwawienia, działanie antyagregacyjne (nawet po zastosowaniu małych dawek)
- hamowanie skurczów macicy (z opóźnianiem lub przedłużaniem porodu).
Okres karmienia piersią
Nimesulidu nie należy stosować w okresie karmienia piersią ze względu na brak informacji o możliwości przenikania leku do ludzkiego mleka[8][37][38][40][39][51][52][53].
Sposób zażywania
- Tabletki należy przyjmować po posiłku przez okres maksymalnie 15 dni[8].
- Postacie do sporządzania zawiesiny doustnej: zawartość saszetki należy wsypać do 100 ml (około pół szklanki) przegotowanej wody, wymieszać i wypić[51]. Zażywać przez okres maksymalnie 15 dni[8].
Przedawkowanie
Brakuje specyficznych danych dotyczących postępowania w przedawkowaniu nimesulidu. Na nimesulid nie ma specyficznej odtrutki.
Objawami przedawkowania niesteroidowych leków przeciwzapalnych są: śpiączka, senność, nudności, wymioty oraz ból w nadbrzuszu, zwykle ustępujące po zastosowaniu właściwego leczenia. W rzadkich przypadkach może wystąpić krwawienie z przewodu pokarmowego, ostra reakcja anafilaktyczna, nadciśnienie tętnicze, ostra niewydolność nerek, zatrzymanie oddechu lub śpiączka.
Leczenie przedawkowania niesteroidowych leków przeciwzapalnych jest jedynie objawowe i podtrzymujące. Do czterech godzin od przyjęcia leku oraz przy zatruciu dużymi dawkami leku zalecane jest indukowanie wymiotów i podawanie węgla aktywnego w dawce u dorosłych pacjentów 60-100 gramów oraz stosowanie osmotycznych środków przeczyszczających. Wskazane jest monitorowanie funkcji wątroby i nerek.
Ze względu na duży stopień wiązania nimesulidu z białkami osocza wymuszona diureza, alkalizacja moczu, hemodializa oraz hemoperfuzja mogą okazać się nieskuteczne[8][37][38][40][39][51][52][53].
Preparaty
Unia Europejska
Preparaty zarejestrowane w Polsce[60]: Aulin[38], Aulin[64], AulinDol[65], Minesulin[39], Minesulin[40], Nimesil[37].
Preparaty zarejestrowane w innych krajach Unii Europejskiej[66]: Aflogen, Algimesil, Algolider, Algosulid, Algover, Amocetin, Antalgo, Antifloxil, Arencast, Areuma, Aulin, Aulin Beta, Auromelid, Beiond, Bioxidol, Chemisulide, Cliovyl, Delfos, Dimesul, Discorid, Doleside, Dolostop, Dolxtren, Domes, Donulide, Edemax, Edrigyl, Efridol, Elinap, Erlecit, Eudolene, Fansidiol, Fansulide, Fladalgin, Flaminide, Flamisul, Flogostop, Flolid, G-Revm, Gerilide, Guaxan, Idealid, Isartrox, Isodol, Jabasulide, Kartal, Laidor, Lalide, Lasazin, Ledolid, Ledoren, Lemesil, Lidenix, Lidersolv, Liezpat, Lovirem, Melicat, Melimont, Mesulid, Mesupon, Migraless, Min-A-Pon, Mosuolit, Multiformil, Myxina, Naofid, Nerelid, Neuride, Nexen, Niberan, Nide, Nidemol, Nimalge, Nimartin, Nimed, Nimedex, Nimegel, Nimelide, Nimenol, Nimesil, Nimesoral, Nimesul, Nimesulen E, Nimesulene, Nimesulid E UCB, Nimesulida, Nimexan, NIMS, Nisal, Noalgos, Noxalide, Omnibus, Oxetian, Polyfen, Pronidal, Remov, Resulin, Reumalide, Rhemid, Ribantil, Ristolzit, Ritamine, Rolaket, Scaflam, Solving, Specilid, Sudinet, Sulidamor, Sulide, Sulimed, Sulinime, Sulmedil, Teonim, Tranzicalm, Ventor, Vitolide, Volonten, Zulid.
Ameryka Południowa
Preparaty zarejestrowane w krajach Ameryki Południowej[67]:
- Brazylia – Cimelide, Deltalfan, Fasulide, Flogilid, Infalid, Maxsulid, Nimalgex, Nimesilam, Nimesubal, Nimesulida Biosintetica, Nimesulida Medley, Nisalgen, Nisulid, Scaflam, UQ Scalid
- Chile – Ainex, Aulin, Baine, Doloc, Nidolin, Nimepast, Nimesulida Bestpharma, Nimesulida Chemopharma, Nimesulida LCH, Nimesulida Master, Nimesulida Pasteur, Nimesulida Sanitas, Nimesyl, Nimex, Nisulid, Nisural
- Kolumbia – Ainedix, Ainex, Dolonime, Mesulid, Nidolon, Nimesulida Genfar, Nimesulida La Sante, Nimesulida MK, Penalgin, Scaflam
- Meksyk – Apolide, Cargespril, Defam, Degorflan, Dexlin, Eskaflam, Flamide, Flamozin, Igrexa, Inim, Kitedo Li, Lusemin, Meliden, Mesulid, Nilden, Nimepis, Nisuded, Nizurin, NMS, Quidofil, Redaflam, Semuplid, Severin, Sulidek, Sulidol, Sundir, UL Flam.
Zastosowanie w weterynarii
- ptaki – w kokcydiozie skraca okres produkcji oocyst, natomiast nie zmniejsza zmian patologicznych[68]
- konie – przeciwzapalnie w dawce 1,5 mg/kg m.c. zarówno dożylnie, jak i doustnie co 12 lub 24 godziny w zależności od stanu zwierzęcia, zachowując ostrożność ze względu obserwowany w tej dawce brak selektywności COX1/COX2 i związaną z tym możliwość wystąpienia objawów ubocznych związanych z inhibicją COX1[69]
- psy – przeciwgorączkowo, przeciwbólowo i przeciwzapalnie, w zapaleniach uszu, nosa, zatok, górnych i dolnych dróg oddechowych, zapaleniach kaletek stawowych[70][71], doustnie 5 mg/kg m.c. przez 3–5 dni z jedzeniem [72][73][74], pozajelitowo 3–5 mg/kg m.c.; ponieważ może powodować uszkodzenie wątroby i nerek u szczeniąt[70], nie stosować u szczeniąt poniżej czwartego miesiąca życia [72][73]
- koty – przeciwgorączkowo, przeciwbólowo i przeciwzapalnie, w zapaleniach uszu, nosa, zatok, górnych i dolnych dróg oddechowych, zapaleniach kaletek stawowych, pozajelitowo 3–5 mg/kg m.c.[70]; może powodować uszkodzenie wątroby i nerek u kociąt[70]
- bydło domowe – przeciwgorączkowo, przeciwbólowo i przeciwzapalnie, w zapaleniach uszu, nosa, zatok, górnych i dolnych dróg oddechowych, zapaleniach kaletek stawowych, niesztowicy, pryszczycy, zapaleniu wymienia, pozajelitowo 2–4 mg/kg m.c.; może powodować uszkodzenie wątroby i nerek u cieląt[70]
- kozy – przeciwgorączkowo, przeciwbólowo i przeciwzapalnie, w zapaleniach uszu, nosa, zatok, górnych i dolnych dróg oddechowych, zapaleniach kaletek stawowych, niesztowicy, pryszczycy, zapaleniu wymienia, pozajelitowo 2–4 mg/kg m.c.[70]
- owce – przeciwgorączkowo, przeciwbólowo i przeciwzapalnie, w zapaleniach uszu, nosa, zatok, górnych i dolnych dróg oddechowych, zapaleniach kaletek stawowych, niesztowicy, pryszczycy, zapaleniu wymienia, pozajelitowo 2–4 mg/kg m.c.[70]
- bawoły – przeciwgorączkowo, przeciwbólowo i przeciwzapalnie, w zapaleniach uszu, nosa, zatok, górnych i dolnych dróg oddechowych, zapaleniach kaletek stawowych, niesztowicy, pryszczycy, zapaleniu wymienia, pozajelitowo 2–4 mg/kg m.c.; może powodować uszkodzenie wątroby i nerek u cieląt[70].
Przypisy
- ↑ a b c d Farmakopea Polska IX, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2011, ISBN 978-83-88157-77-6.
- ↑ a b c d e f g Alberto Bernareggi, Clinical pharmacokinetics and metabolism of nimesulide, „InflammoPharmacology”, 9 (1–2), 2001, s. 81–99, DOI: 10.1163/156856001300248353, PMID: 9812177.
- ↑ a b c Nimesulide (51803-78-2), Chemical Book [dostęp 2013-09-05] (ang.).
- ↑ Nimesulide, [w:] DrugBank [online], University of Alberta, DB04743 (ang.).
- ↑ Nimesulide, [w:] ChemIDplus [online], United States National Library of Medicine [dostęp 2013-09-24] (ang.).
- ↑ Rainsford 2005 ↓, s. 13.
- ↑ Nimesulide, Santa Cruz Biotechnology, SC-200623 [dostęp 2013-09-03] (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac Nimesulid (opis profesjonalny), Medycyna Praktyczna Lekarze pacjentom baza leków [dostęp 2013-08-24].
- ↑ a b Rainsford 2005 ↓, s. 89.
- ↑ a b c d e f C.Mattia i inni, Nimesulid – 25 lat później, „Minerva Medica”, 101, 2010, s. 4, PMID: 21030939.
- ↑ Rainsford 2005 ↓, s. 3.
- ↑ Rainsford 2005 ↓, s. 4.
- ↑ a b Rainsford 2005 ↓, s. 5–6.
- ↑ Substituted 2-phenoxy alkane-sulfonanilides, patent US 3840597A [dostęp 2013-09-19] (ang.).
- ↑ a b c Rainsford 2005 ↓, s. 7.
- ↑ Q&A, The Original Nimesulide, Helsinn Healthcare [dostęp 2013-08-30] [zarchiwizowane z adresu 2013-10-02] (ang.).
- ↑ Rainsford 2005 ↓, s. 9.
- ↑ Nimesulide, „WHO Pharmaceuticals Newsletter”, 4, 2002, s. 12 [dostęp 2013-09-27].
- ↑ U.A. Boelsterli, Nimesulide and hepatic adverse effects: roles of reactive metabolites and host factors, „International Journal of Clinical Practice”, 128, 5th Congress of the European Association for Clinical Pharmacology and Therapeutics, 2002, s. 30–36, PMID: 12166617.
- ↑ a b Pytania i odpowiedzi dotyczące oceny leków zawierających nimesulid do stosowania ogólnoustrojowego, European Medicines Agency website [dostęp 2013-08-26].
- ↑ a b c K.D. Rainsford, Nimesulide – a multifactorial approach to inflammation and pain: scientific and clinical consensus, „Current Medical Research and Opinion”, 22 (6), 2006, s. 1161–1170, DOI: 10.1185/030079906X104849, PMID: 16846549.
- ↑ a b c Witold S. Gumułka, Nieopioidowe leki przeciwbólowe, leki stosowane w dnie oraz w leczeniu chorób reumatycznych, [w:] Farmakologia. Podstawy farmakoterapii, Wojciech Kostowski (red.), Zbigniew S. Herman (red.), wyd. 3, t. I, Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 3224–3257, ISBN 978-83-200-4185-9.
- ↑ Waldemar Janiec, Leszek Śliwiński, Barbara Nowińska, Niesteroidowe leki przeciwbólowe i przeciwbólowe oraz leki przeciwgorączkowe, [w:] Kompendium Farmakologii, Waldemar Janiec (red.), wyd. 2, Warszawa: Wydawnictwo Lekarskie PZWL, 2008, s. 249–267, ISBN 978-83-200-3944-3.
- ↑ Bioequivalence Study of Nimesulide 100 mg Tablets, [w:] ClinicalTrials.gov [online], National Institutes of Health, NCT01745614 [dostęp 2013-09-08] (ang.).
- ↑ Ashok Prasad i inni, A practical large scale synthesis of nimesulide – A step ahead, „Journal of Scientific and Industrial Research”, 64, 2005, s. 756–760.
- ↑ Neelam Seedher, Sonu Bhatia, Solubility enhancement of Cox-2 inhibitors using various solvent systems, „AAPS PharmSciTech”, 4 (3), 2003, s. 33, DOI: 10.1208/pt040333, PMID: 14621965, PMCID: PMC2750626.
- ↑ Rainsford 2005 ↓, s. 11–14.
- ↑ Rainsford 2005 ↓, s. 15–20.
- ↑ Petra Kovařı́ková, Milan Mokrý, Jiřı́ Klimeš, Photochemical stability of nimesulide, „Journal of Pharmaceutical and Biomedical Analysis”, 31 (4), 2003, s. 827–832, DOI: 10.1016/S0731-7085(02)00659-3, PMID: 12644210 [dostęp 2013-09-22] [zarchiwizowane z adresu 2013-09-28].
- ↑ J.A. Squella i inni, Electrochemical generation and interaction study of the nitro radical anion from nimesulide, „Pharmaceutical Research”, 16 (1), 1999, s. 161–164, DOI: 10.1023/A:1011950218824, PMID: 9950296.
- ↑ a b c May Hamza, Raymond A. Dionne, Mechanisms of Non-Opioid Analgesics Beyond Cyclooxygenase Enzyme Inhibition, „Current Molecular Pharmacology”, 2 (1), Bentham Science, 2009, s. 1–14, DOI: 10.2174/1874467210902010001, PMID: 19779578, PMCID: PMC2749259.
- ↑ a b Ryszard Korbut, Rafał Olszanecki, Farmakologia nieopioidowych leków przeciwbólowych, [w:] Medycyna bólu, Jan Dobrogowski (red.), Jerzy Wordliczek (red.), Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 336–349, ISBN 83-200-2842-6.
- ↑ Rainsford 2005 ↓, s. 83.
- ↑ Rainsford 2005 ↓, s. 82.
- ↑ Rainsford 2005 ↓, s. 87.
- ↑ M. Bianchi i inni, Plasma and Synovial Fluid Concentrations of Nimesulide and its Main Metabolite after a Single or Repeated Oral Administration in Patients with Knee Osteoarthritis, „The Journal of International Medical Research”, 34, 2006, s. 348–354, DOI: 10.1177/147323000603400402, PMID: 16989489.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y Nimesil (granulat) – Charakterystyka Produktu Leczniczego, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych [dostęp 2013-09-25].
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x Aulin (granulat) – Charakterystyka Produktu Leczniczego, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych [dostęp 2016-03-15].
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x Minesulin (proszek) – Charakterystyka Produktu Leczniczego, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych [dostęp 2013-09-25].
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x Minesulin (tabletki) – Charakterystyka Produktu Leczniczego, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych [dostęp 2013-09-25].
- ↑ Nimesulide containing medicinal products for systemic use, European Commission Public Health [dostęp 2013-08-25] (ang.).
- ↑ a b c d Aneks III Uaktualnienia do Charakterystyki Produktu Leczniczego i Ulotki dla pacjenta, European Commission Public Health [dostęp 2013-08-25].
- ↑ Maria Grazia Iachininoto i inni, Cyclooxygenase-2 (COX-2) Inhibition Constrains Indoleamine 2,3-Dioxygenase 1 (IDO1) Activity in Acute Myeloid Leukaemia Cells, „Molecules”, 18 (9), 2013, s. 10132–10145, DOI: 10.3390/molecules180910132, PMID: 23973990.
- ↑ K.D. Rainsford, Anti-Inflammatory Drugs of the 21st Century, [w:] Inflammation in the Pathogenesis of Chronic Diseases, R.E. Harris (red.), Springer, 2007 (Subcellular Biochemistry, t. 42), s. 3–27, DOI: 10.1007/1-4020-5688-5_1, ISBN 978-1-4020-5688-8.
- ↑ Matteo Lazzeroni i inni, Breast ductal lavage for biomarker assessment in high risk women: rationale, design and methodology of a randomized phase II clinical trial with nimesulide, simvastatin and placebo, „BMC Cancer”, 12, 2012, s. 578, DOI: 10.1186/1471-2407-12-575, PMID: 23216985, PMCID: PMC3522001.
- ↑ Arun George Paul, Neelam Sharma-Walia, Bala Chandran, Targeting KSHV/HHV-8 Latency with COX-2 Selective Inhibitor Nimesulide: A Potential Chemotherapeutic Modality for Primary Effusion Lymphoma, „PLoS One”, 6 (9), 2012, e24379, DOI: 10.1371/journal.pone.0024379, PMID: 21980345.
- ↑ Konstantina G. Yiannopoulou, Sokratis G. Papageorgiou, Current and future treatments for Alzheimer’s disease, „Therapeutic Advances in Neurogical Disorders”, 6 (1), 2013, s. 19–33, DOI: 10.1177/1756285612461679, PMID: 23277790, PMCID: PMC3526946.
- ↑ Rainsford 2005 ↓, s. 30.
- ↑ Diclac 100, czopki doodbytnicze 0,1 g, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Charakterystyki Produktów Leczniczych Refundowanych [dostęp 2013-09-24].
- ↑ Witold S. Gumułka, Nieopioidowe leki przeciwbólowe, leki stosowane w dnie oraz w leczeniu chorób reumatycznych, [w:] Farmakologia. Podstawy farmakoterapii, Wojciech Kostowski (red.), Zbigniew S. Herman (red.), wyd. 3, t. I, Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 158–159, ISBN 978-83-200-4185-9.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w Minesulin (nimesulid), Medycyna Praktyczna Lekarze pacjentom baza leków [dostęp 2013-09-05] [zarchiwizowane z adresu 2015-03-19].
- ↑ a b c d e f g h i j k l m n o p q r s t u v Nimesil (nimesulid), Medycyna Praktyczna Lekarze pacjentom baza leków [dostęp 2013-09-05].
- ↑ a b c d e f g h i j k l m n o p q r s t u v Aulin(nimesulid), Medycyna Praktyczna Lekarze pacjentom baza leków [dostęp 2013-09-05].
- ↑ a b Rainsford 2005 ↓, s. 108.
- ↑ Rainsford 2005 ↓, s. 113–114.
- ↑ E. Perucca, Drug interactions with nimesulide, „Drugs”, 46, 1993, s. 79–82, DOI: 10.2165/00003495-199300461-00015, PMID: 7506198.
- ↑ a b Rainsford 2005 ↓, s. 112.
- ↑ a b Rainsford 2005 ↓, s. 108–112.
- ↑ a b Nimulid Safeinject Nimesulide Injection, Panacea Biotec [dostęp 2013-09-03] (ang.).
- ↑ a b Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 16 kwietnia 2018 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej, „Dziennik Urzędowy Ministra Zdrowia”, 16 kwietnia 2018 [dostęp 2018-10-19] [zarchiwizowane z adresu 2019-11-23].
- ↑ a b c Jan K. Podlewski, Alicja Chwalibogowska-Podlewska, Leki Współczesnej Terapii, wyd. 20, t. 2, Warszawa: Medical Tribune Polska, 2005, s. 617, ISBN 978-83-60135-95-2.
- ↑ Rainsford 2005 ↓, s. 59.
- ↑ Pharmindex kompendium leków, Warszawa 2007, ISSN 1426-4269.
- ↑ Aulin (tabletki) – Charakterystyka Produktu leczniczego, Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych [dostęp 2016-03-15].
- ↑ AulinDol – Rejestr produktów leczniczych, Centrum Systemów Informacyjnych Ochrony Zdrowia [dostęp 2016-03-15] [zarchiwizowane z adresu 2018-10-20].
- ↑ List of referrals for human medicinal products Nimesulide, European Commission Public Health [dostęp 2013-09-16] (ang.).
- ↑ Vademecum.es [dostęp 2013-10-04] (hiszp.).
- ↑ Błażej Późniak, Marcin Świtała, Salicylany w farmakoterapii weterynaryjnej. Część II. Wskazania do stosowania u ptaków oraz działania niepożądane i toksyczność, „Życie Weterynaryjne”, 87, 2012, s. 1038–1041, ISSN 0026-4806.
- ↑ R. Villa i inni, Oral and intravenous administration of nimesulide in the horse: rational dosage regimen from pharmacokinetic and pharmacodynamic data, „Equine Veterinary Journal”, 39, 2007, s. 136–142, DOI: 10.2746/042516407X159123, PMID: 17378442.
- ↑ a b c d e f g h Nimovet Nimesulide Injection, Indian Immunologicals [dostęp 2018-04-29] [zarchiwizowane z adresu 2018-04-29] (ang.).
- ↑ S. Bonneau i inni, Analgesic efficacy of nimesulide in a canine osteoarthritis model, „Revue de Médecine Vétérinaire”, 156, 2005, s. 179–181 [dostęp 2013-09-22].
- ↑ a b Sulidene 50 mg tablet for dogs. Summary of Product Characteristics, The Heads of Medicines Agencies [dostęp 2013-08-26] (ang.).
- ↑ a b Sulidene 100 mg tablet for dogs. Summary of Product Characteristics, The Heads of Medicines Agencies [dostęp 2013-08-26] (ang.).
- ↑ P.L. Toutain i inni, A pharmacokinetic/pharmacodynamic approach vs. a dose titration for the determination of a dosage regimen: the case of nimesulide, a COX-2 selective nonsteroidal anti-inflammatory drug in the dog, „Journal of Veterinary Pharmacology and Therapeutics”, 24 (1), 2001, s. 43–55, DOI: 10.1046/j.1365-2885.2001.00304.x, PMID: 11348486.
Bibliografia
- Nimesulide. Actions and Uses, K.D. Rainsford (red.), Bazylea–Boston–Berlin: Birkhäuser Verlag, 2005, ISBN 978-3-7643-7068-8.
Linki zewnętrzne
- Nimesulide, Helsinn Healthcare [dostęp 2013-09-23] (ang.).
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Metabolit nimesulidu - M15.
Autor: Pnapora, Licencja: CC BY-SA 3.0
Chemical reaction: 2-phenoxymethanesulfonanilide to 4-Nitro-2-phenoxymethanesulfonanilide
Metabolit nimesulidu - M7.
Metabolit nimesulidu - M3.
Metabolit nimesulidu - M4.
Metabolit nimesulidu - M18.
Metabolit nimesulidu - M12.
Autor: Pnapora, Licencja: CC BY-SA 3.0
Nimesulide metabolic pathway.
Autor: Pnapora, Licencja: CC BY-SA 3.0
Otrzymywania 4-nitro-2-fenoksymetanosulfoanilidu (nimesulidu).
Metabolit nimesulidu - M1.
Metabolit nimesulidu - M10.
Autor: Pnapora, Licencja: CC BY-SA 3.0
Mechanizm działania niesteroidowych leków przeciwzapalnych
Autor: Pnapora, Licencja: CC BY-SA 3.0
Otrzymywanie 2-fenoksyaniliny
Metabolit nimesulidu - M14.
Strukturformel von Nimesulid
Metabolit nimesulidu - M13.
Metabolit nimesulidu - M11.
Metabolit nimesulidu - M17.
Metabolit nimesulidu - M9.
Metabolit nimesulidu - M2.
Autor: Pnapora, Licencja: CC BY-SA 3.0
Otrzymywanie 2-fenoksynitrobenzenu
Metabolit nimesulidu - M6.
Metabolit nimesulidu - M16.
Autor: Pnapora, Licencja: CC BY-SA 3.0
Otrzymywanie 2-fenoksymetanosulfoanilidu.
Metabolit nimesulidu - M8.
Autor: Pnapora, Licencja: CC BY-SA 3.0
Chemical reaction: 2-Phenoxyaniline to 2-phenoxymethanesulfonanilide
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Metabolit nimesulidu - M5.