Nitrowanie
Nitrowanie – reakcja chemiczna polegająca na wymianie (substytucji) atomu wodoru (lub rzadziej innego jednowartościowego podstawnika) w związku organicznym na grupę nitrową (−NO2). W wyniku nitrowania tworzą się związki nitrowe.
Nitrowanie związków aromatycznych
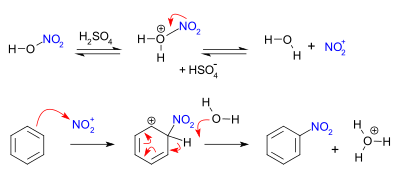
Nitrowanie związków aromatycznych zachodzi według mechanizmu substytucji elektrofilowej. W mieszaninie nitrującej, która jest typowym środkiem nitrującym, powstaje elektrofilowy kation nitroniowy (NO2+), który jest atakowany przez pierścień aromatyczny nitrowanego związku, np. benzenu:
Kwas siarkowy jest katalizatorem w reakcji nitrowania. Jego rola polega na tworzeniu jonu nitroniowego oraz absorpcji wody, obecnej w środowisku reakcji.
W zależności od warunków reakcji i proporcji mieszaniny nitrującej z powstałego nitrobenzenu mogą się następnie, w analogiczny sposób, tworzyć pewne ilości dinitrobenzenu i trinitrobenzenu. Nie da się przyłączyć więcej niż trzech grup nitrowych do pojedynczego pierścienia aromatycznego w drodze bezpośredniego nitrowania.
W wyniku nitrowania 9-fluorenonu (ketonowej pochodnej fluorenu, ![]() ), który zawiera 2 pierścienie aromatyczne, można otrzymać pochodną trinitrową[1] lub tetranitrową[2], zależnie od zastosowanych warunków nitrowania.
), który zawiera 2 pierścienie aromatyczne, można otrzymać pochodną trinitrową[1] lub tetranitrową[2], zależnie od zastosowanych warunków nitrowania.
Niektóre podstawniki (np. grupa aminowa lub hydroksylowa) znacznie ułatwiają podstawienie elektrofilowe, dlatego np. w wyniku działania mieszaniną nitrującą na fenol można łatwo otrzymać stosunkowo czysty trinitrofenol (kwas pikrynowy).
Nitrowanie związków alifatycznych
Nitrowanie alkanów przeprowadza się zwykle działając parami kwasu azotowego na nitrowany związek w temp. 300–500 °C.
Nitrowanie alkoholi
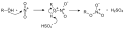
Nitrowaniem nazywa się też (niepoprawnie z chemicznego punktu widzenia) estryfikację mieszaniną nitrującą np. gliceryny lub celulozy, w wyniku której powstają odpowiednie azotany, noszące zwyczajowe nazwy, odpowiednio nitrogliceryna i nitroceluloza. Mechanizm „nitrowania” alkoholi:
Przypisy
- ↑ E.O. Woolfolk, Milton Orchin, 2,4,7-Trinitrofluorenone, „Organic Syntheses”, 28, 1948, s. 91, DOI: 10.15227/orgsyn.028.0091.
- ↑ Melvin S. Newman, H. Boden, 2,4,7-Tetranitrofluorenone, „Organic Syntheses”, 42, 1962, s. 95, DOI: 10.15227/orgsyn.042.0095.
Zobacz też
Media użyte na tej stronie
Skeletal model of fluorenone. Uses a normal pentagon for the bridge carbons.
(c) V8rik z angielskiej Wikipedii, CC BY-SA 3.0
Aromatic Nitration Mechanism
Nitration of an alcohol