Nowotwory jelita cienkiego
 Gruczolak cewkowo-kosmkowy | |
| ICD-10 | C17 |
|---|---|
| C17.0 | Dwunastnica |
| C17.1 | Jelito czcze |
| C17.2 | Jelito kręte |
| C17.3 | Uchyłek Meckela |
| C17.8 | Zmiana przekraczająca granice jednego umiejscowienia w obrębie jelita cienkiego |
| C17.9 | Jelito cienkie, umiejscowienie nieokreślone |
| ICD-10 | D13 |
| D13.2 | Dwunastnica |
| D13.3 | Inne i nieokreślone części jelita cienkiego |
| ICD-10 | D37 |
| D37.2 | Jelito cienkie |
Nowotwory jelita cienkiego (łac. neoplasma intestini tenuis) – choroby nowotworowe wywodzące się z jelita cienkiego. Stanowią 0,3% wszystkich guzów nowotworowych[1].
Nowotwory łagodne
Nowotwory łagodne jelita cienkiego[1][2]:
- mięśniak gładkokomórkowy (leiomyoma)
- gruczolak (adenoma)
- tłuszczak (lipoma)
- włókniak (fibroma)
- naczyniak krwionośny (haemangioma)
- nerwiakowłókniak (neurofibroma)
- hamartoma (hamartoma)
Mięśniak gładkokomórkowy
Stanowi około 30-35% nowotworów łagodnych jelita cienkiego[1]. Zwykle są to niewielkie guzy, najczęściej są bezobjawowe, ale mogą być przyczyną niedrożności lub krwawienia do przewodu pokarmowego z powodu martwicy guza[3]. Guzy poniżej 4 cm rzadko ulegają przemianie złośliwej, wymagają one różnicowania z GIST (guzami podścieliskowymi)[4].
Gruczolak
Stanowią około 20-25% łagodnych guzów jelita cienkiego. Dzieli się je na gruczolaki prawdziwe, gruczolaki kosmkowe i gruczolaki z gruczołów Brunnera[5]. Zwykle są to zmiany bezobjawowe; mogą jednak powodować krwawienie z przewodu pokarmowego lub niedrożność. Gruczolak ma pewien potencjał do złośliwienia i podobnie do gruczolaków jelita grubego gruczolaki kosmkowe charakteryzuje większa skłonność do złośliwienia[1].
Tłuszczak
Stanowi około 15% łagodnych guzów jelita cienkiego[1]. Zwykle występuje w jelicie krętym. Są to zmiany leżące śródściennie w błonie podśluzowej. Guz nie ma potencjału złośliwego, dlatego – gdy nie powoduje objawów – nie usuwa się go. Może być powodem wgłobienia jelita lub krwawienia, gdy dojdzie do jego owrzodzenia[6][5].
Naczyniaki
Stanowią około 5% nowotworów łagodnych jelita cienkiego. Najczęściej są zlokalizowane w jelicie czczym. Głównym objawem naczyniaka jest krwawienie do przewodu pokarmowego[7].
Hamartoma (odpryskowiak)
Zwykle stanowi składnik zespołu Peutza-Jeghersa. Poza najczęstszą lokalizacją w jelicie czczym i krętym mogą występować w okrężnicy i odbytnicy[5] oraz w żołądku[6]. Ze względu na wieloogniskowość zmian leczenie jest zarezerwowane dla zmian objawowych i powikłanych, stosuje się oszczędną resekcję[6]. Choć hamartoma jest uważana za zmianę łagodną, to w 3-6% przypadków obserwuje się przemianę gruczolakowatą[5].
Nowotwory złośliwe
Pierwotne nowotwory złośliwe jelita cienkiego:
- gruczolakorak (adenocarcinoma)
- rakowiak (carcinoid)
- chłoniaki (lymphoma)
- nowotwory podścieliskowe przewodu pokarmowego (GIST)[a]
- mięsaki (sarcoma)
Jelito cienkie jest rzadką lokalizacją przerzutów, klinicznie istotne przerzuty do tego narządu występują w 1-2% przypadków, choć w badaniu pośmiertnym występują znacznie częściej[8][9][10]. Zwykle pojawiają się w zaawansowanych stadiach choroby nowotworowej[8]. Najczęstszymi nowotworami przerzutowymi jelita cienkiego jest czerniak, rak jajnika, rak płuca, rak piersi[11].
Gruczolakorak
Jest to najczęstszy nowotwór złośliwy jelita cienkiego, stanowi około 30-40% nowotworów złośliwych jelita cienkiego[12][1][13][14]. Najczęściej jest zlokalizowany w dwunastnicy[12].
Rakowiak
Rakowiak stanowi około 30% nowotworów złośliwych jelita cienkiego[1][12]. Najczęściej jest zlokalizowany w jelicie krętym, a rzadziej w dwunastnicy[12].
Chłoniaki jelita cienkiego
Chłoniaki stanowią 15-20% nowotworów złośliwych jelita cienkiego, najczęściej są zlokalizowane w jelicie krętym[15]. Zwykle są to chłoniaki nieziarnicze z limfocytów B.
Najczęstsze typy chłoniaków jelita cienkiego[16]:
- rozlany chłoniak z dużych komórek B (DLBCL)
- chłoniak Burkitta (BL)
- chłoniak typu MALT (pozawęzłowy chłoniak strefy brzeżnej MALT)
- chłoniaki z komórek T, w tym enteropatyczny chłoniak T-komórkowy (EATL)
Chłoniaki jelita cienkiego objawiają się osłabieniem, spadkiem masy ciała, bólami brzucha, krwawieniem do przewodu pokarmowego, niedrożnością i perforacją jelita. W porównaniu z innymi typami nowotworów złośliwych częściej powodują niedrożność lub perforację jelita[17].
Ze względu na zróżnicowaną etiologię choroby chłoniak w obrębie jelita cienkiego może dawać wiele różnych objawów radiologicznych. Zwykle jest widoczny jako zwężająca jelito masa, często guzkowata lub polipowata, może tworzyć głębokie owrzodzenia i przetoki. Nierzadko jednocześnie szerzy się wewnątrzjelitowo i pozajelitowo. Jeśli rośnie obwodowo, to powoduje skrócenie długości jelita z pogrubieniem i zatarciem fałdów. Masa guza może stanowić czoło wgłobienia. Często jest widoczne tzw. tętniakowate poszerzenie światła jelita cienkiego spowodowane zniszczeniem ściany mięśniowej lub jego unerwienia. Tętniakowate poszerzenie nie jest spowodowane zwężeniem lub niedrożnością jelita, która w chłoniakach jelita cienkiego jest stosunkowo rzadka, mimo że guz często osiąga większą masę niż gruczolakorak. W tomografii komputerowej chłoniak tworzy masę o jednolitej gęstości, powoduje pogrubienie ściany jelita oraz rozdzielenie sąsiednich pętli jelita. Zmiany są bardziej jednolite i wykazują mniejsze wzmocnienie kontrastowe niż inne nowotwory złośliwe[18][19].
Mięsaki i nowotwory podścieliskowe przewodu pokarmowego (GIST)
Mięsaki stanowią 10-15% nowotworów złośliwych jelita cienkiego, rzadziej występuje mięśniakomięsak gładkokomórkowy[12]. Guzy charakteryzuje stosunkowo równomierna lokalizacja we wszystkich odcinkach jelita cienkiego[12]. Najczęstszym typem mięsaków występujących w jelicie cienkim są nowotwory podścieliskowe przewodu pokarmowego (guzy stromalne, GIST), których drugą najczęstszą lokalizacją po żołądku jest jelito cienkie. W porównaniu do guzów stromalnych zlokalizowanych w żołądku częściej okazują się złośliwe[18]. W porównaniu z innymi typami nowotworów złośliwych częściej powodują krwawienie z przewodu pokarmowego[17]. W tomografii komputerowej są widoczne jako gładka lub guzkowata zmiana, która może być owrzodziała. W guzie może występować region o obniżonej gęstości, martwica z lub bez poziomu płynu i powietrza, zwapnienia, może bezpośrednio szerzyć się na sąsiednie narządy[18].
Objawy
Większość nowotworów łagodnych jelita cienkiego jest bezobjawowa i są one przypadkowo znajdowane podczas badań diagnostycznych, zabiegów operacyjnych lub podczas autopsji. Zmiany łagodne zwykle są bezobjawowe, ale 75% guzów objawowych to nowotwory złośliwe[20]. Nowotwory jelita cienkiego najczęściej objawiają się niedrożnością jelit oraz ukrytym krwawieniem z przewodu pokarmowego. Niedrożność może być spowodowana przez wgłobienie się guza, szczególnie łagodnego. Niedrożność spowodowana przez łagodne guzy może być przepuszczająca. Z kolei nowotwory złośliwe charakteryzują się wzrostem obwodowym, który powoduje fiksację guza oraz zrosty, co często prowadzi do niedrożności. Perforacja jelita i jawne krwawienie są rzadkie w większości typów nowotworów jelita cienkiego. Nowotwór może być rozpoznany przez badanie palpacyjne[1].
Rozpoznanie
W diagnostyce nowotworów jelita cienkiego znajdują zastosowanie[19]:
- enterokliza TK
- enterokliza MR
Leczenie
Leczenie zmian łagodnych jest wskazane z uwagi na ryzyko powikłań, a także z uwagi na konieczność potwierdzenia w badaniu histopatologicznym łagodnego charakteru zmiany. Zwykle stosuje się odcinkową resekcję jelita[21].
Leczenie zmian złośliwych jest uzależnione od typu histopatologicznego guza i jego lokalizacji. Zwykle polega ono na szerokiej resekcji z wycięciem węzłów chłonnych. Lokalizacja zmian w dwunastnicy może wymagać wykonania pankreatoduodenektomii. W przypadku guzów typu GIST stosuje się imatynib[22].
Uwagi
- ↑ nie wszystkie GIST są nowotworami złośliwymi
Przypisy
- ↑ a b c d e f g h Norton i in. 2008 ↓, s. 977.
- ↑ I. Hatzaras, JA. Palesty, F. Abir, P. Sullivan i inni. Small-bowel tumors: epidemiologic and clinical characteristics of 1260 cases from the connecticut tumor registry.. „Arch Surg”. 142 (3), s. 229-35, Mar 2007. DOI: 10.1001/archsurg.142.3.229. PMID: 17372046.
- ↑ Gamal Mostafa, Cathey Lamont, Frederick L. Greene: Review of Surgery: Basic Science and Clinical Topics for ABSITE. Springer, 2006. ISBN 978-0387290805.
- ↑ Nicholas J. Talley: Jelito cienkie, jelito grube, trzustka (Gastroenterologia i hepatologia w praktyce klinicznej). Elsevier Urban & Partner, 2013. ISBN 978-83-7609-788-6.
- ↑ a b c d Townsend i in. 2013 ↓, s. 199.
- ↑ a b c Norton i in. 2008 ↓, s. 979.
- ↑ Townsend i in. 2013 ↓, s. 199-200.
- ↑ a b O. Yuksel, P. Uyar, TT. Sahin, B. Demirhan. Small bowel perforation due to metastatic lung squamous cell carcinoma. „Saudi Med J”. 28 (4), s. 631-3, Apr 2007. PMID: 17457493.
- ↑ L. Capasso, G. Iarrobino, R. D' Ambrosio, E. Carfora i inni. Surgical complications for gastric and small bowel metastases due to primary lung carcinoma. „Minerva Chir”. 59 (4), s. 397-403, Aug 2004. PMID: 15278035.
- ↑ Z. Lorenc, JJ. Starzewski, M. Jachymczyk. Metachronous tumor of the small intestine--rare cause of ileus in a patient after resection of colon cancer. „Wiad Lek”. 55 (3-4), s. 239-42, 2002. PMID: 12182011.
- ↑ PubCan, Secondary tumours of the small intestine [dostęp 2015-01-08] [zarchiwizowane z adresu 2014-09-11].
- ↑ a b c d e f SY. Pan, H. Morrison. Epidemiology of cancer of the small intestine.. „World J Gastrointest Oncol”. 3 (3), s. 33-42, Mar 2011. DOI: 10.4251/wjgo.v3.i3.33. PMID: 21461167.
- ↑ DeVita, Lawrence i Rosenberg 2008 ↓, s. 1187.
- ↑ Norton i in. 2008 ↓, s. 980.
- ↑ DeVita, Lawrence i Rosenberg 2008 ↓, s. 1199-1200.
- ↑ a b DeVita, Lawrence i Rosenberg 2008 ↓, s. 1189.
- ↑ a b c RM. Gore, UK. Mehta, JW. Berlin, V. Rao i inni. Diagnosis and staging of small bowel tumours. „Cancer Imaging”. 6, s. 209-12, 2006. DOI: 10.1102/1470-7330.2006.0031. PMID: 17208678.
- ↑ a b DeVita, Lawrence i Rosenberg 2008 ↓, s. 1189-1192.
- ↑ McCulloch 2007 ↓, s. 108.
- ↑ Townsend i in. 2013 ↓, s. 198.
- ↑ Townsend i in. 2013 ↓, s. 201-202.
Bibliografia
- Vincent T. DeVita, Theodore S. Lawrence, Steven A. Rosenberg: Devita, Hellman & Rosenberg's Cancer: Principles & Practice of Oncology. Wyd. 8. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7207-5.
- Jeffrey Norton, Philip S. Barie, Ralph R. Bollinger, Alfred E. Chang, Stephen Lowry, Sean J. Mulvihill, Harvey I. Pass, Robert W. Thompson: Surgery: Basic Science and Clinical Evidence (Norton: Surgery). Springer, 2008. ISBN 978-0-387-30800-5.
- Courtney M. Townsend, Daniel R. Beauchamp, Mark B. Evers, Kenneth L. Mattox: Chirurgia Sabistona. Elsevier Urban & Partner, 2013. ISBN 978-1-4160-3675-3.
- David Bartlett, Pragatheeshwar Thirunavukarasu, Matthew D. Neal: Surgical Oncology. JP Medical Ltd, 2011. ISBN 978-0071786102.
- Peter McCulloch: Morson and Dawson's Gastrointestinal Pathology. CRC Press, s. 2007. ISBN 978-1420086386.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Nephron, Licencja: CC BY-SA 3.0
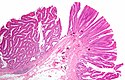
Low magnification micrograph of a tubulovillous adenoma, TVA. Surgical specimen. H&E stain.
TVAs are precancerous lesions that have a mixture a villous morphology and tubular morphology, where the villous component is <50% of the lesion, but greater or equal to 25% of the lesion.
TVAs have nuclear changes like those in tubular adenomas and villous adenomas:
- Nuclear elongation; elliptical nuclei,
- Nuclear crowding/pseudostratification.
Morphologic changes include:
- Loss of goblet cells,
- Hyperchromatic ("open") nuclei at the luminal surface.
Tubular morphology:
- Round gland-like structures.
Villous morphology:
- Long finger-like projections; similar in appearance to villi.
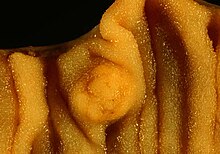
The photo shows the same case presented in Image:Multiple Carcinoid Tumors of the Small Bowel 1.jpg.
The medium close-up photo above shows a segmental small bowel resection en face, the long axis of the bowel oriented horizontally in the frame. One of the carcinoids is present centrally. Note that the tumor effaces the mossy, villous surface of the mucosa only to a mild degree.
The photos were taken with a Nikon FE2 and 50-something mm Nikkor macro lens with Elite ISO 100 daylight film and a blue color compensation filter. For the middle photo, I found that shading some of the illumination on one side helped to bring out the villous texture of the mucosa.
Photograph by Ed Uthman, MD. Public domain. Posted 28 Oct 99