Ochrona metali przed korozją
Ochrona metali przed korozją – działania zmierzające do zmniejszenia bezpośrednich i pośrednich strat wskutek korozji metali, czyli procesów niszczenia ich struktury pod wpływem środowiska (np. powietrze, gazy przemysłowe, woda słodka i morska, grunt, w tym gleba).
Działania są podejmowane na etapie[1][2]:
- projektowania urządzeń i instalacji – np. wybór materiałów konstrukcyjnych (np. stal kwasoodporna, stal żaroodporna), projektowanie urządzeń i instalacji (np. konstrukcja reaktorów i rurociągów, metody łączenia elementów, wybór systemu ochrony przeciwkorozyjnej)
- eksploatacji chronionych urządzeń i konstrukcji – np. osuszanie i oczyszczanie powierzchni narażonych na korozję, odnawianie izolacyjnych powłok ochronnych (np. malarskich), modyfikowanie składu środowiska (np. inhibitory), kontrola i regulacja systemów aktywnej elektrochemicznej ochrony przeciwkorozyjnej[3][4][5]
Aktywna ochrona przed korozją elektrochemiczną może polegać na stosowaniu odrębnych elektrod, umieszczanych w środowisku korozji, lub takich powłok metalicznych, które powodują katodową polaryzację metalu chronionego lub polaryzację anodową – w przypadkach, gdy chroniony metal ulega pasywacji. W przypadku stosowania odrębnych elektrod (katod lub anod) są stosowane systemy z elektrodami trwałymi, zasilane z zewnętrznego źródła napięcia, lub protektory – wymienialne elektrody z materiału korodującego w kontakcie z metalem chronionym (system bez zewnętrznego źródła napięcia)[1][4][5][6][7].
Przeciwdziałanie korozji chemicznej

Metodą zmniejszania strat spowodowanych korozją chemiczną jest stosowanie[8][9][10]:
- metali konstrukcyjnych o odpowiednio dobranym składzie chemicznym i strukturze, np. metale żaroodporne i żarowytrzymałe
- odpornych na działanie agresywnego środowiska powłok, np. malarskich lub metalicznych
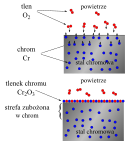
Chemiczna odporność metali konstrukcyjnych i powłok metalicznych na działanie agresywnego środowiska jest często spowodowana pasywacją – powstawaniem szczelnych warstw produktów reakcji z czynnikami agresywnymi (np. tlenków). Takie warstwy ochronne powstają np. na stopach aluminium lub stali zawierającej takie dodatki stopowe jak chrom, krzem, aluminium.
Przeciwdziałanie korozji elektrochemicznej



Prąd z zewnętrznego źródła polaryzuje anodowo i pasywuje fragmenty powierzchni w miejscach nieszczelności powłoki wewnętrznej ściany zbiornika
Możliwości ochrony metali przed korozją elektrochemiczną są bardziej zróżnicowane[4][5][6][9][10][11][12]. W przypadku dużych instalacji i urządzeń, np. sieci rurociągów podziemnych, stalowych mostów, zbrojenia budowli z żelbetu lub instalacji technologicznych w przemyśle chemicznym decyzje dotyczące metod ochrony są podejmowane w czasie ich projektowania. Dotyczą rodzaju stosowanych metali konstrukcyjnych (np. dodatki stopowe, sposoby obróbki cieplnej i cieplno–chemicznej) oraz metod ich ochrony biernej (np. powłoki ochronne) i czynnej (ochrona elektrochemiczna). W pierwszej kolejności opracowuje się sposoby zminimalizowania zagrożeń, związanych z powstawaniem ogniw korozyjnych.
Unikanie zróżnicowania potencjałów
Wśród działań, których celem jest uniknięcie powstawania ogniw korozyjnych (lub zmniejszenie prawdopodobieństwa ich powstawania) wymienia się:
- unikanie bezpośrednich połączeń metali o różnych potencjałach standardowych (np. stosowanie nieprzewodzących uszczelek między kołnierzami łączonych rurociągów, podkładek pod łby śrub, dielektrycznych smarów między gwintem śruby i otworu)
- stosowanie materiałów o jak najbardziej równomiernym rozkładzie naprężeń w sieci krystalicznej (np. likwidacja przez wyżarzanie naprężeń spowodowanych obróbką plastyczną)
- unikanie sytuacji, w których chroniona konstrukcja znajduje się w środowisku o zróżnicowanych właściwościach (np. unikanie powstawania zastoin osadów w rurociągach, gromadzenia się wody opadowej i pyłów w określonych miejscach konstrukcji poddanych oddziaływaniom atmosferycznym, układania rurociągów, kabli, zbrojeń w gruncie o właściwościach zróżnicowanych pod względem wilgotności, kwasowości lub stopnia napowietrzenia)
- unikanie zróżnicowania naprężeń w skali konstrukcji
- modyfikowanie środowiska korozji (np. wilgotność, temperatura, inhibitory korozji}[13]
Ochrona elektrochemiczna
Wyróżnia się grupy metod elektrochemicznej ochrony elektrolitycznej i galwanicznej.
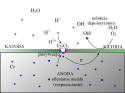
Ochrona elektrolityczna[5][6], np. rurociągów lub konstrukcji portowych, polega na stosowaniu zewnętrznego źródła napięcia, dzięki któremu metal chroniony staje się, opcjonalnie:
- — katodą ogniwa, na której zachodzą reakcje redukcji depolaryzatora (np. tlenu; nie zachodzi utlenianie, połączone z rozpuszczaniem chronionej części konstrukcji)
- — anodą ogniwa, na której zachodzą reakcje utleniania chronionego metalu, prowadzące do pasywacji (np. powstawanie szczelnych warstewek tlenków)
Ochrona galwaniczna (również katodowa lub anodowa) jest prowadzona bez zewnętrznego źródła napięcia. Polega na zapewnianiu kontaktu chronionej instalacji z metalami dodatkowo wprowadzonymi do obwodu (elektrodami ochronnymi).
W katodowej ochronie galwanicznej stosuje się elektrody ochronne, które są anodami w stosunku do metalu chronionego (protektory, np. cynkowe). Na chronionej powierzchni zachodzą katodowe reakcje redukcji depolaryzatora, nie powodujące zniszczeń. Zamierzonemu korozyjnemu zniszczeniu ulegają protektory, które są wymieniane na nowe.
Anodowa ochrona galwaniczna polega na dołączaniu elektrod, które są katodami w stosunku do metalu chronionego (są bardziej szlachetne). Na ich powierzchni redukuje się depolaryzator, a na powierzchni chronionej zachodzą anodowe reakcje utleniania metalu. Aby ochrona była skuteczna, muszą one prowadzić do powstania zwartych warstw tlenków lub innych produktów stałych (pasywacja).
Powłoki ochronne
Powłoki ochronne to warstwy materiałów, które są nakładane na powierzchnię wyrobów metalowych i niemetalowych w celu zabezpieczenia przed oddziaływaniem środowiska[1][2][3][14]. Są klasyfikowane według materiału powłoki, sposobu nakładania i innych kryteriów. Między innymi wyróżnia się grupy powłok:
- niemetalicznych (np. powłoki malarskie, warstwy tlenkowe i inne)
- metalicznych, w tym — powłoki katodowe (skuteczne pod warunkiem szczelności) oraz powłoki anodowe
Rodzajem powłok ochronnych są też warstwy adsorpcyjne, tworzone przez inhibitory — związki wprowadzane do środowiska korozji i adsorbujące się na powierzchni chronionego metalu. Z punktu widzenia ochrony przed korozją elektrochemiczną wyróżnia się inhibitory:
- anodowe
- katodowe
- anodowo—katodowe (ogólne)
Przypisy
- ↑ a b c Encyklopedia techniki; Metalurgia. Katowice: Wydawnictwo "Śląsk", s. 410, 514-515, seria: 1978.
- ↑ a b Encyklopedia techniki; Chemia. Warszawa: Wydawnictwo Naukowo–Techniczne, 1993, s. 361-365, 488, 582. ISBN 83-204-1312-5.
- ↑ a b Barbara Surowska: Wybrane zagadnienia z korozji i ochrony przed korozją. Lublin: Politechnika Lubelska, 2002, s. 1-143.
- ↑ a b c d Krystyna Moskwa, Bogusław Mazurkiewicz: Korozja i ochrona przed korozją. [w:] skrypt AGH [on-line]. www.chemia.odlew.agh.edu.pl. [dostęp 2011-04-20]. [zarchiwizowane z tego adresu (2007-04-21)].
- ↑ a b c d Maciej Markiewicz, Paweł Stochaj. Ochrona katodowa zbiorników za pomocą anod galwanicznych. „Nafta-Gaz”. LXVI (6), s. 49-499, 2010.06.10. (pol.).
- ↑ a b c Mieczysław Bartoszewski, Stefan F. Filipowicz. Wybrane zagadnienia ochrony katodowej rurociągów przed korozją. „Prace Instytutu Elektrotechniki”, s. 97-112, 2007. Politechnika Warszawska.
- ↑ "Leksykon naukowo-techniczny z suplementem". T. A-O. Warszawa: WNT, 1989, s. 485. ISBN 83-204-0969-1.
- ↑ Zakład Metaloznawstwa i Odlewnictwa: Struktury stopów żelaza o specjalnych właściwościach. [w:] Skrypt ZUT: Tworzywa metaliczne [on-line]. www.zmio.zut.edu.pl/. [dostęp 2015-07-11]. [zarchiwizowane z tego adresu (2012-10-30)].
- ↑ a b G. G. Wranglen: Podstawy korozji i ochrony metali. Warszawa: Wydawnictwo Naukowo-Techniczne, 1969.
- ↑ a b I.J. Klinow: Korozja i tworzywa konstrukcyjne. Warszawa: Wydawnictwo Naukowo-Techniczne, 1963.
- ↑ Gustaw Kortüm: Elektrochemia. Warszawa: Państwowe Wydawnictwo Naukowe, 1970.
- ↑ Marcel Pourbaix: Wykłady z korozji elektrochemicznej. Warszawa: Państwowe Wydawnictwo Naukowe, 1978.
- ↑ Wiedza; Przemysłowe środki smarne; Czasowa ochrona metali przed korozją; według http://www.elf.com.pl, adres obecnie niedostępny
- ↑ "Leksykon naukowo-techniczny z suplementem". T. P-Ż. Warszawa: WNT, 1989, s. 716-717. ISBN 83-204-0969-1.
Bibliografia
- Bob Cottis: The electronic journal for all aspects of corrosion. [w:] The Journal of Corrosion Science and Engineering [on-line]. Linki do artykułów dot. różnych aspektów korozji. [dostęp 2011-05-12]. (ang.).
Linki zewnętrzne
- Korozja gazowa. [w:] Skrypt UMCS [on-line]. www.ztch.umcs.lublin.pl. [dostęp 2015-02-11].
Media użyte na tej stronie
A Cathodic Protection Rectifier. All rights released by the photographer.
Autor:
- Depassivation_repassivation_inox.svg: Cdang
- derivative work: Joanna Kośmider (talk)
Activation (cracking of the oxide layer) et repassivation of a stainless steel.
Autor: Wizard191, Licencja: CC BY-SA 3.0
Steel weldment with hard chrome finish.
Autor: Anton, Licencja: CC BY-SA 3.0
Flugrost -- vor dem Reinigen / rust film -- before cleaning
Autor: Cafe Nervosa Derek Mawhinney, Corrosion Engineer, Licencja: CC BY-SA 3.0
Corrosion pit before and after abrasive blasting. The structure is a buried steel pipeline carrying natural gas.
Autor: Anton, Licencja: CC BY-SA 3.0
Flugrost -- nach dem Reinigen / rust film -- after cleaning
Zasady korozji galwanicznej (3)
Autor: Oryginalnym przesyłającym był Chetan z angielskiej Wikipedii, Licencja: CC BY-SA 2.5
Sacrificial anodes (light colored rectangular handle-shaped objects) mounted "on the fly" for corrosion protection of a metal jacket structure
Schematic illustration of cathodic protection system
Autor:
- Mecanisme_passivation_inox.svg: Cdang
- derivative work: Joanna Kośmider (talk)
Mechanism of passivation of stainless steel: the chromium atoms in the steel react with the dioxygen of the air to form a protective chromia layer.
Zasada elektrolitycznej ochrony anodowej