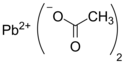
Octan ołowiu(II)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny | (CH 3COO) 2Pb | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | (AcO)2Pb | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molowa | 325,28 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | biały, krystaliczny proszek (trihydrat) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | 301-04-2 (bezwodny) 6080-56-4 (trihydrat) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 16685321 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inne aniony | azotan ołowiu(II) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inne kationy | octan sodu | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | octan ołowiu(IV), octan amonu | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||
Octan ołowiu(II), (CH
3COO)
2Pb – organiczny związek chemiczny, sól kwasu octowego i ołowiu na II stopniu utlenienia. Z powodu słodkiego smaku jest czasem nazywany cukrem ołowianym.
Otrzymywany jest najczęściej w reakcji tlenku ołowiu(II) (PbO) z kwasem octowym.
PbO + 2CH3COOH → (CH3COO)2Pb + H2O
Krystalizuje jako trójhydrat o wzorze (CH3COO)2Pb•3H2O. Jako dobrze rozpuszczalna sól ołowiu znajduje zastosowanie do syntezy innych jego związków, do wytwarzania papierków ołowiowych (do wykrywania siarczków i siarkowodoru) oraz w przemyśle tekstylnym i barwników.
Podobnie jak większość związków ołowiu jest silnie toksyczny. Zatrucia mają na ogół charakter przewlekły, po długotrwałym narażeniu może dojść do powstania ołowicy. Octan ołowiu wykazuje silne działanie mutagenne i uszkadza mechanizmy rozrodcze. Jest szczególnie niebezpieczny dla kobiet w ciąży, a zatrucie nim może doprowadzić do uszkodzeń płodu.
Przypisy
- ↑ a b c CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 4-70, ISBN 978-0-8493-0488-0 (ang.).
- ↑ a b Octan ołowiu(II) (ang.) w wykazie klasyfikacji i oznakowania Europejskiej Agencji Chemikaliów. [dostęp 2015-04-07].
- ↑ a b Karta charakterystyki produktu Alfa Aesar, 2010-07-12 (ang.) [dostęp 2011-03-17].
- ↑ Octan ołowiu(II), trihydrat (nr 316512) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Polski. [dostęp 2011-03-17]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Symbol of pollutants to the environment, according to the directive 67/548/EWG of 'European Chemicals Bureau (European Chemicals Agency).
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
(c) Dormroomchemist z angielskiej Wikipedii, CC BY 3.0
Lead(II)Acetate trihydrate crystals prepared from lead carbonate and aqueous acetic acid and crystallized through room temperature evaporation of the solution.