Omalizumab
| |||
| |||
| Identyfikacja | |||
| Inne nazwy i oznaczenia | Xolair, łac. omalizumabum | ||
| numer CAS | 242138-07-4 | ||
| DrugBank | DB00043 | ||
| Genetyka i fizjologia | |||
| Choroby | astma oskrzelowa | ||
| Klasyfikacja medyczna | |||
| ATC | R03DX05 | ||
| Stosowanie w ciąży | kategoria B[2][3] | ||
| Farmakokinetyka | |||
| Działanie | przeciwastmatyczne | ||
| Biodostępność | 62%[3] | ||
| Okres półtrwania | 26 dni[2] | ||
| Metabolizm | wątrobowy[4] | ||
| Wydalanie | z żółcią[4] | ||
| Uwagi terapeutyczne | |||
| Drogi podawania | podskórna | ||
| Objętość dystrybucji | 78±32 ml/kg m.c.[4] | ||
Omalizumab (łac. omalizumabum, nazwa handlowa Xolair[4]) – humanizowane, przeciwciało monoklonalne klasy IgG1/к, wytwarzane metodą inżynierii genetycznej w komórkach jajnika chomika chińskiego, stosowane w leczeniu astmy oskrzelowej oraz przewlekłej pokrzywki idiopatycznej.
Budowa i mechanizm działania
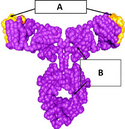
Omalizumab jest humanizowanym przeciwciałem monoklonalnym produkowanym przy użyciu technik inżynierii genetycznej w komórkach jajnika chomika chińskiego, które wiąże się z fragmentem Fc immunoglobuliny E[4][1]. Przeciwciało to składa się ze zrębu pochodzenia ludzkiego oraz wprowadzonego w niego regionu determinującego dopasowanie pochodzenia mysiego[4][1]. Omalizumab powoduje szybkie obniżenie poziomu immunoglobuliny E w osoczu krwi, co powoduje obniżenie aktywności komórek odpowiedzialnych za reakcję alergiczną (komórek tucznych, eozynofili, bazofili oraz komórek prezentujących antygen)[1].
Zastosowanie
- leczenie wspomagające, w celu poprawy kontroli ciężkiej, przewlekłej astmy alergicznej, u pacjentów, u których stwierdzono dodatni wynik testu skórnego lub reaktywność in vitro na całoroczne alergeny wziewne, częste objawy choroby występujące w ciągu dnia lub będące przyczyną wybudzeń w nocy oraz u których występują liczne ciężkie zaostrzenia astmy pomimo przyjmowania dużych dobowych dawek kortykosteroidów wziewnych w skojarzeniu z długo działającym ß-mimetykiem u pacjentów w wieku od 6 lat (Europa)[4]
- umiarkowana lub ciężka, przewlekła astma alergiczna, u pacjentów, u których stwierdzono dodatni wynik testu skórnego lub reaktywność in vitro na całoroczne alergeny wziewne, z objawami które nie są kontrolowane pomimo przyjmowania kortykosteroidów wziewnych (USA)[2]
- przewlekła pokrzywka idiopatyczna, u których objawy utrzymują się pomimo stosowania antagonistów receptora H1, u pacjentów w wieku od 12 lat (USA)[2]
Omalizumab jest dopuszczony do obrotu w Polsce (2018)[5] i jest dostępny dla pacjentów w ramach programu lekowego[6][7].
Działania uboczne
Omalizumab powoduje następujące działania uboczne u ponad 1% pacjentów: gorączka, reakcje z miejscu podania oraz u dzieci dodatkowo ból głowy i ból w nadbrzuszu[4].
Zobacz też
Przypisy
- ↑ a b c d M. Segal, JR. Stokes, TB. Casale. Anti-immunoglobulin e therapy.. „World Allergy Organ J”. 1 (10), s. 174-83, 2008. DOI: 10.1097/WOX.0b013e318187a310. PMID: 23282676 (ang.).
- ↑ a b c d XOLAIR (omalizumab) for injection, for subcutaneous use. (ang.). Agencja Żywności i Leków, 2003. [dostęp 2018-10-14].
- ↑ a b
 Jan K. Podlewski, Alicja Chwalibogowska-Podlewska: Leki współczesnej terapii online. Medical Tribune Polska. [dostęp 2018-10-14].
Jan K. Podlewski, Alicja Chwalibogowska-Podlewska: Leki współczesnej terapii online. Medical Tribune Polska. [dostęp 2018-10-14]. - ↑ a b c d e f g h Novartis: Xolair 75 mg proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań. Charakterystyka Produktu Leczniczego. Europejska Agencja Leków. [dostęp 2018-10-14].
- ↑ Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 16 kwietnia 2018 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej. Dziennik Urzędowy Ministra Zdrowia, 2018-04-16. [dostęp 2018-10-14].
- ↑ Iwona Damps-Kostańska, Kwalifikacja chorych na astmę ciężką do leczenia omalizumabem – przewodnik dla lekarza, „Alergia Astma Immunologia”, 20 (4), 2015, s. 215-217 [dostęp 2018-10-14].
- ↑ Ministerstwo Zdrowia, Programy lekowe Choroby nieonkologiczne - leczenie ciężkiej astmy alergicznej IGE zależnej oraz ciężkiej astmy eozynofilowej . [dostęp 2018-10-14].
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Autor: Jakob Voß, influenced by original art designed at PLoS, modified by Wikipedia users Nina and Beao, Licencja: CC0
Closed Access logo, derived from PLoS Open Access logo. Alternative version.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Manav Segal, Jeffrey R Stokes, Thomas B. Casale, Licencja: CC BY 2.5
Omalizumab structure (A) Murine CDRs (complementarity-determining region) (<5% of molecule) (B) IgG1κ human framework (>95% of molecule)
![(A) region determinujący dopasowanie (<5% cząsteczki) (B) zrąb pochodzenia ludzkiego immunoglobulina klasy IgG1/к (>95% cząsteczki)[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/27/Omalizumab.png/232px-Omalizumab.png)