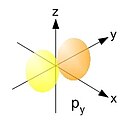
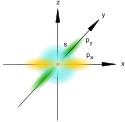
Orbital p
Orbital p – taki orbital, czyli falowa funkcja własna elektronu w polu oddziaływania jądra lub rdzenia atomowego, która odpowiada pobocznej liczbie kwantowej Od wartości głównej liczby kwantowej zależy energia elektronu, a od wartości magnetycznej liczby kwantowej – funkcja rozkładu określająca „gęstość ładunku” (kwadrat modułu funkcji falowej) w różnych punktach otoczenia jądra. Orbitale mają formę wzajemnie prostopadłych „obrotowych ósemek”, łącznie wypełniających sferę wokół jądra (podobnie jak orbital s). Radialny rozkład gęstości cechują maksima (w liczbie ). Najwyższe z nich występuje w odległości od jądra zbliżonej do wartości promienia odpowiedniej orbity Bohra.
Równanie Schrödingera i orbitale
Równanie Schrödingera wiąże funkcję falową z energią całkowitą Dla tzw. stanów stacjonarnych – takich, w których energia nie zmienia się w czasie – ma ogólną postać:
gdzie:
Rozwiązania otrzymanego równania mają sens fizyczny dla ściśle określonych wartości energii całkowitej („wartości własne” operatora) i odpowiadających im „funkcji własnych” – orbitali. W przypadku atomu wodoru lub „jonów (atomów) wodoropodobnych” całkowita energia układu jest wyrażana jako suma energii pędu elektronu wokół jądra i energii potencjalnej kulombowskich oddziaływań dwóch ładunków (zobacz równanie Schrödingera i orbitale). W czasie rozwiązywania równania stwierdza się (bez dodatkowych założeń), że ma ono sens tylko dla określonego zbioru liczb naturalnych – liczb kwantowych: głównej pobocznej i magnetycznej Jest to równoznaczne z wykazaniem, że energia elektronu, kwadrat momentu pędu i kota składowa momentu pędu są kwantowane. Każda z tak otrzymanych funkcji własnych [a] jest orbitalem. Orbitale przedstawia się jako iloczyny prostszych funkcji: i
Energia elektronu (wartość własna operatora) zależy od wartości a wartość funkcji własnej – od i Kwadrat bezwzględnej wartości modułu tej funkcji określa gęstość prawdopodobieństwa znalezienia elektronu w danym miejscu otoczenia jądra (zobacz: gęstość elektronowa).
W przypadku orbitali ( symbole ) gęstość elektronowa nie zależy od parametrów i (sferyczna „chmura elektronowa”). Rozkład radialny charakteryzuje się występowaniem maksimów. Dla każdego z tych orbitali gęstość jest największa w strefie tego maksimum, które leży najdalej od jądra.
Orbitale px, py, pz
Gdy poboczna liczba kwantowa gęstość elektronowa w otoczeniu jądra lub rdzenia atomowego zależy od parametrów i co sprawia, że chmura elektronowa nie jest sferyczna. Jej kształt zależy od pobocznej i magnetycznej liczby kwantowej ( i ).
Dla każdej wartości głównej liczby kwantowej poboczna liczba kwantowa może przyjmować wartości:
Dla każdej wartości pobocznej liczby liczba może przyjmować wartości, np.:
- gdy = 1 (orbital ), = 0, +1 lub -1 (inaczej: = 0, ±1; trzy możliwe wartości),
- gdy = 2 (orbital ), = 0, ±1, ±2 (5 wartości),
- gdy = 3 (orbital ), = 0, ±1, ±2, ±3 (7 wartości).
W przypadku orbitali dla każdej z trzech możliwych wartości liczby kwantowej otrzymuje się inną funkcję własną operatora energii, której odpowiada inny kształt chmury elektronowej. Kształt tej chmury jest wyjaśniany po zastąpieniu par funkcji i przez ich kombinacje liniowe.




Porównanie orbitali i
(przewiń galerię)
W przypadku orbitalu można zamiast funkcji i
zastosować funkcje i
Konsekwencją tej zamiany jest otrzymanie trzech ilorazów funkcji dla m = 0, +1 i –1:
Bezwzględne wartości funkcji są największe wzdłuż osi Wartości funkcji są dodatnie dla i ujemne dla Na płaszczyźnie funkcja ma wartość zero (płaszczyzna węzłowa).
Bezwzględne wartości funkcji są największe wzdłuż osi Wartości funkcji są dodatnie dla x > 0 i ujemne dla x < 0. Płaszczyzną węzłową jest
Bezwzględne wartości funkcji są największe wzdłuż osi Wartości funkcji są dodatnie dla i ujemne dla Płaszczyzną węzłową jest
Określając prawdopodobieństwo znalezienia elektronu w określonych punktach otoczenia jądra, bierze się pod uwagę wartości kwadratu modułu funkcji falowej (zgodnie z interpretacją Maxa Borna). Graficznym obrazem chmur elektronowych są bryły określane jako „obrotowe ósemki” lub „hantle”, wewnątrz których prawdopodobieństwo znalezienia elektronu wynosi np. 90%. Zależność gęstości tego prawdopodobieństwa od odległości od centralnego ładunku określa funkcja Nie jest ona zależna od a więc radialne funkcje rozmieszczenia na orbitalach mają kształt podobny do opisanego w odniesieniu do orbitalu s. Funkcje te cechuje występowanie maksimów w liczbie Oznacza to np. że w przypadku gdy:
- i (orbital 2p) występuje jedno maksimum gęstości chmury elektronowej,
- i (orbital 3p) – dwa maksima,
- i (orbital 5p) – cztery maksima.
W każdym przypadku najwyższym z maksimów jest to, dla którego przyjmuje największą wartość, jednocześnie w przybliżeniu odpowiadając promieniowi orbity Bohra.
Zobacz też
Uwagi
- ↑ Oznaczenia: – współrzędne punktu w biegunowym układzie współrzędnych.
- ↑ Trzy orbitale powinny wypełniać sferę, analogicznie jak orbital (przedstawiono formy zwężone, dla zachowania czytelności rysunku).
Bibliografia
- Heinz A. Staab: Wstęp do teoretycznej chemii organicznej. Warszawa: Państwowe Wydawnictwo Naukowe PWN, 1966, s. 7–12.
- Przykłady zastosowań równania Schrödingera; Widma cząsteczkowe; Fotochemia. W: Stanisław Bursa: Chemia fizyczna. Warszawa: Państwowe Wydawnictwo Naukowe PWN, 1979, s. 46–61. ISBN 83-01-00152-6.
- Antoni Basiński, Adam Bielański, Kazimierz Gumiński i inni: Chemia fizyczna. Wyd. 3. Warszawa: Państwowe Wydawnictwo Naukowe, 1966, s. 86–110.
Media użyte na tej stronie
Atomowe orbitale; 2. orbital s
Atomowe orbitale; 5. s+px+py+pz
Autor: Haade; derivative work: Marek M 11:05, 29 April 2011 (UTC), Licencja: CC BY 3.0
Ten plik został załadowany za pomocą narzędzia Commonist.
Autor: Nieznany, Licencja: CC-BY-SA-3.0
First few hydrogen atom orbitals; cross section showing color-coded probability density for different n=1,2,3 and l="s","p","d"; note: m=0
The picture shows the first few hydrogen atom orbitals (energy eigenfunctions). These are cross-sections of the probability density that are color-coded (black=zero density, white=highest density). The angular momentum quantum number l is denoted in each column, using the usual spectroscopic letter code ("s" means l=0; "p": l=1; "d": l=2). The main quantum number n (=1,2,3,...) is marked to the right of each row. For all pictures the magnetic quantum number m has been set to 0, and the cross-sectional plane is the x-z plane (z is the vertical axis). The probability density in three-dimensional space is obtained by rotating the one shown here around the z-axis.
Note the striking similarity of this picture to the diagrams of the normal modes of displacement of a soap film membrane oscillating on a disk bound by a wire frame. See, e.g., Vibrations and Waves, A.P. French, M.I.T. Introductory Physics Series, 1971, ISBN 0393099369, page 186, Fig. 6-13. See also Normal vibration modes of a circular membrane.Autor: Haade; derivative work: Marek M 11:05, 29 April 2011 (UTC), Licencja: CC BY 3.0
Ten plik został załadowany za pomocą narzędzia Commonist.
Atomowe orbitale; 4. s+px+py
Autor: Haade; derivative work: Marek M 11:05, 29 April 2011 (UTC), Licencja: CC BY 3.0
Ten plik został załadowany za pomocą narzędzia Commonist.
Atomowe orbitale; 1. osie
Atomowe orbitale; 3. s+px