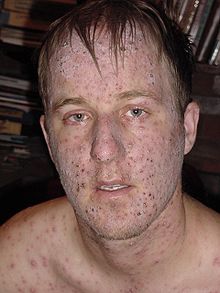
Ospa wietrzna
| varicella | |
 Dziecko chore na ospę wietrzną | |
| ICD-10 | B01 |
|---|---|
| B01.0 | Zapalenie opon mózgowych w ospie wietrznej (G02.2*) |
| B01.1 | Zapalenie mózgu w ospie wietrznej (G05.1*) |
| B01.2 | Zapalenie płuc w ospie wietrznej (J17.1*) |
| B01.8 | Ospa wietrzna z innymi powikłaniami |
| B01.9 | Ospa wietrzna bez powikłań |
 | |
| Czynnik chorobotwórczy | |
| Nazwa | |
|---|---|
| Epidemiologia | |
| Droga szerzenia | droga kropelkowa, kontakt bezpośredni |
| Występowanie | cały świat |
| Prawo | |
| Przymusowe leczenie | nie |
| Podlega zgłoszeniu WHO | nie |
Ospa wietrzna (łac. varicella) – choroba zakaźna wywołana pierwotnym zakażeniem wirusem ospy wietrznej i półpaśca (VZV). Reaktywacja zakażenia wirusem ospy wietrznej i półpaśca jest przyczyną ograniczonego zakażenia pod postacią półpaśca[1]. Choroba najczęściej pojawia się w wieku dziecięcym[2]. Głównym objawem jest występowanie charakterystycznej wysypki pojawiającej się po parodniowym okresie niecharakterystycznych objawów prodromalnych. Wysypka początkowo przybiera formę grudek ulegających przemianie w pęcherzyki, następnie powstają krostki, które po kilku dniach zasychają w strupy. Zmiany występują przede wszystkim w obrębie twarzy i tułowia. Charakterystyczny jest wielopostaciowy charakter zmian związany z występowaniem zmian w różnych etapach ich ewolucji. Przebieg choroby na ogół jest łagodny, ale mogą występować potencjalnie groźne powikłania infekcyjne wykwitów skórnych, ospowe zapalenie płuc i powikłania neurologiczne. Pierwotne zakażenie wirusem VZV w I trymestrze ciąży wiąże się z ryzykiem obumarcia płodu lub jego uszkodzenia pod postacią zespołu ospy wrodzonej[3]. Rozpoznanie choroby jest stawiane na podstawie obrazu klinicznego. U większości chorych wystarczającym leczeniem jest leczenie objawowe. Acyklowir znajduje zastosowanie w ciężkim przebiegu choroby lub w sytuacjach zwiększonego ryzyka powikłań[4].
Epidemiologia
Ospa wietrzna jest chorobą występującą na całym świecie i co roku rozpoznaje się około 60 milionów zakażeń[5]. W Polsce odnotowuje się około 100 000–200 000 przypadków zachorowań rocznie[5]. Do zachorowania może dojść w każdym wieku[5], ale choroba najczęściej występuje u dzieci w wieku wczesnoszkolnym[2]. 50–60% zakażeń stwierdza się pomiędzy 5.–9. rokiem życia[2] i do 90% zakażeń dochodzi przed 15. rokiem życia[5][2][6]. Około 98% dorosłych osób jest seropozytywna[7]. Szacuje się, że poniżej 5% dorosłych osób jest podatnych na zakażenie[6]. Choroba przebiega ciężej, wiążąc się z wyższym ryzykiem powikłań u niemowląt, dorosłych i osób z zaburzoną odpornością w porównaniu do zdrowych dzieci[6]. Zakażalność wirusa jest bardzo wysoka[5] i w kontaktach domowych transmisja wirusa na osoby podatne zachodzi u 90% przypadków[8][5]. W klimacie umiarkowanym obserwuje się sezonowość zachorowań ze szczytem w miesiącach zimowych[5][2]. Istnieje zróżnicowanie geograficzne występowania choroby i mniejsza zapadalność jest stwierdzana w krajach o klimacie tropikalnym, co prawdopodobnie wynika ze zmniejszonej zdolności inwazyjnej wirusa w takich warunkach[9][8] i w związku z tym w tych krajach stwierdza się większą podatność na zakażenie u dorosłych[8]. Odporność po zakażeniu występuje na całe życie[5]. Szacuje się, że ryzyko w ciągu całego życia pojawienia się reaktywacji zakażenia w postaci półpaśca wynosi 20%[7].
Etiologia
Ospa wietrzna spowodowana jest pierwotnym zakażeniem herpeswirusem VZV (Varicellae Zoster Virus)[10]. Człowiek jest jedynym rezerwuarem wirusa[11]. Źródłem zakażenia jest chory człowiek na ospę wietrzną, a rzadziej chory na półpasiec. Do zakażenia dochodzi drogą kropelkową lub poprzez bezpośredni kontakt, ewentualnie poprzez łożysko[12][10]. Wirus poprzez śluzówki górnych dróg oddechowych lub spojówki przenika do ustroju[11][12][13]. Początkowo wirus namnaża się układzie chłonnym górnych dróg oddechowych, przede wszystkim w migdałkach i tkankach limfatycznych tworzących pierścień Waldeyera[14]. Wirus wykazuje tropizm do limfocytów T[14]. Prawdopodobnie w kryptach migdałków wirus jest przenoszony z komórek nabłonkowych do limfocytów T, w których wirus posiada zdolność do namnażania i uwalniania zakaźnych wirionów[14][15]. Po około 3-4 dniach replikacji wnika do krwi, wywołując krótką pierwotną wiremię[5]. Wirus jest prawdopodobnie transportowany w obrębie komórek jednojądrzastych krwi obwodowej, przede wszystkim limfocytów T[11]. W następstwie wiremii wirus szerzy się do układu siateczkowo-śródbłonkowego, ulega w nim replikacji i po 10–21 dniach od zakażenia dochodzi do wtórnej wiremii[5]. Wirus do skóry jest transportowany w obrębie limfocytów T, początkowo zakażane są komórki śródbłonka naczyniowego kapilar skórnych[11], a następnie komórki wokół mieszka włosowego[14]. Szerzenie się wirusa z komórki do komórki jest hamowane przez zwiększenie wydzielania IFN-α i IFN-β, a w konsekwencji regulacji w górę czynników transkrypcyjnych STAT1 i NF-κB[14]. Wirus prowadzi do zmian cytopatycznych w obrębie skóry powodując powstanie komórek wielojądrowych, proliferację komórek naskórka, stopniowe pogrubienie naskórka i uszkodzenie błony podstawnej[16]. W sytuacji obniżenia odporności wiremia trwa dłużej, czego konsekwencją może być rozsiew wewnątrznarządowych ospy z zajęciem wątroby, płuc i ośrodkowego układu nerwowego. Po zakażeniu pierwotnym nie dochodzi do całkowitej eliminacji wirusa i pozostaje on w postaci latentnej w czuciowych (grzbietowych) zwojach nerwów rdzeniowych i czaszkowych. W warunkach obniżonej odporności może dojść do reaktywacji wirusa i rozwoju półpaśca[5].
Przebieg zakażenia

Okres wylęgania wirusa wynosi 10–21 dni, średnio 14 dni. Zakaźność dla otoczenia pojawia się od 24 do 48 godzin przed wystąpieniem wysypki i trwa do przyschnięcia pęcherzyków (średnio 7 dni)[5]. Pojawienie się charakterystycznej wysypki jest poprzedzone objawami prodromalnymi obejmującymi złe samopoczucie, gorączkę lub stan podgorączkowy, utratę apetytu, bóle głowy, bóle brzucha, bóle mięśniowe[5][13], zapalenie gardła i nieżyt nosa[3]. Objawy prodromalne zwykle poprzedzają o 1–2 dni pojawienie się wysypki, częściej występują u młodzieży i u dorosłych[5][3]. Możliwe jest występowanie przemijającego zaczerwienienia skóry[3].
Wysypka w ospie wietrznej początkowo przyjmuje formę plamek, a następnie swędzących zaczerwienionych grudek o średnicy około 5–10 mm, które po kilku godzinach przyjmują formę wypełnionego płynem surowiczym pęcherzyka[5][3]. W ciągu 2–3 dni pęcherzyki ulegają przemianie w krosty, a po 3–4 dniach przysychają w strupki[5][3].
Po zejściu wykwitów pozostają przemijające małe blizny i przebarwienia[3], trwałe blizny pozostają w przypadku nadkażenia wykwitów[5]. Ze względu na pojawianie się zmian skórnych rzutami, charakterystyczne jest występowanie wielopostaciowości (polimorfizmu) zmian (tzw. obraz gwieździstego nieba)[5][3]. W stanach upośledzonej odporności możliwe jest występowanie wykwitów krwotocznych[3]. Wykwity początkowo pojawiają się na twarzy i tułowiu, a następnie w mniejszym stopniu na kończynach[5][13]. Liczba wykwitów średnio osiąga różne nasilenie i może wahać się od 10 do 1500 zmian[13].
W 10–20% przypadków stwierdza się obecność drobnych wykwitów w obrębie błon śluzowych nosogardła, narządów płciowych, spojówek i rzadko w obrębie rogówki[5][3].
Wykwitom może towarzyszyć wysoka gorączka trwająca zwykle do 4 dni, świąd skóry, powiększenie węzłów chłonnych[5] i zapalenie gardła[3]. Bardzo rzadko ospa wietrzna przebiega w sposób bezobjawowy[5].
Zmiany podobne do ospy wietrznej u osób szczepionych
Wysypka podobna do ospy wietrznej u osób szczepionych może być wywołana przez VZV typu dzikiego, atenuowanego VZV stosowanego w szczepionce lub związanego z inną etiologią niż ospa wietrzna. Wysypki powstałe w ciągu 14 dni od szczepienia mogą być związane z VZV typu dzikiego, ponieważ ekspozycja na wirusa nastąpiła przed zaszczepieniem i wytworzeniem odporności. Wysypka występująca w ciągu 15–42 dni od szczepienia może być związana z VZV typu dzikiego lub VZV stosowanego w szczepieniu. Wynika to z możliwości zakażenia VZV typu dzikiego przed wytworzeniem się odporności po zaszczepieniu. Zaczerwienienie skóry może być następstwem działania niepożądanego szczepionki. Po okresie 42 dni od zaszczepienia wysypka jest związana z typem dzikim. Jedna dawka szczepionki chroni 97% zaszczepionych przez ospą wietrzną o ciężkim i umiarkowanym przebiegu oraz 85% chorych przed ospą o łagodnym przebiegu (obecnie zaleca się dwie dawki szczepionki). Przebieg zakażenia u chorych zaszczepionych zazwyczaj jest bezobjawowy lub skąpoobjawowy. Liczba wykwitów o charakterze plamisto-grudkowym jest niewielka, nie przekraczająca 50, pęcherzyki zwykle są nieobecne[17].
Powikłania ospy wietrznej
Ospa wietrzna zwykle przebiega w sposób łagodny, ale choroba może prowadzić do poważnych powikłań. Do najczęstszych powikłań należą wtórne zakażenia infekcyjne zmian skórnych, zapalenie płuc i powikłania neurologiczne[18]. U około 5% chorych powikłania ospy wymagają hospitalizacji[5].
- Infekcje bakteryjne
Wtórne bakteryjne zakażenia wykwitów skórnych są najczęstszym powikłaniem ospy wietrznej[4][18]. Najczęstszymi czynnikami etiologicznym są Staphylococcus aureus i Streptococcus pyogenes[4][19][18]. Zakażenia mogą przybierać postać liszajca, ropni, ropowicy, zapalenia tkanki łącznej (cellulitis), róży, płonicy przyrannej, gronkowcowego zespołu wstrząsu toksycznego, paciorkowcowego zespół wstrząsu toksycznego (STSS), martwiczego zapalenia powięzi oraz sepsy[20][4]. Wczesnym objawem zakażenia wykwitów jest zaczerwienie podstawy pęcherzyka. Nawrót gorączki po 3–4 dniach po pojawieniu się pierwszych wykwitów może być również przejawem zakażenia bakteryjnego[20].
- Zapalenie płuc
Ospowe (śródmiąższowe) zapalenie płuc jest jednym z najczęstszych i najpoważniejszych powikłań ospy wietrznej u dorosłych[4][21]. Szacuje się, że zmiany radiologiczne w przebiegu ospy wietrznej u dorosłych występują u około 3–16% chorych, ale objawy zapalenia płuc stwierdza się tylko u jednej trzeciej z nich[18]. Z kolei u zdrowych dzieci zapalenie płuc w przebiegu ospy wietrznej jest stosunkowo rzadko rozpoznawane w porównaniu do osób dorosłych[18]. Większe ryzyko rozwoju ospowego zapalenia płuc jest obserwowane u palaczy tytoniu, osób z upośledzoną odpornością. Wysoką śmiertelność obserwuje się u kobiet w II i III trymestrze ciąży[21][4].
Zapalenie płuc zwykle rozwija się po 1–6 dni po wystąpieniu wysypki[22]. Objawy ze strony układu oddechowego mogą występować w różnym nasileniu, od łagodnych do ostrej niewydolność oddechowej (ARDS)[21]. Zapalenie płuc manifestuje się gorączką, dusznością, przyspieszeniem oddechu (tachypnoe), kaszlem, może występować ból w klatce piersiowej i krwioplucie[22]. Ospowe zapalenie płuc wiąże się z bardzo wysoką śmiertelnością wynoszącą 10–30% u osób bez istotnych obciążeń zdrowotnych i przynajmniej 50% śmiertelnością u chorych z zaburzeniem odporności[21].
W przebiegu choroby możliwy jest rozwój wtórnego bakteryjnego zapalenia płuc. Najczęściej rozpoznaje się zakażenia o etiologii Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenzae. Zakażenia bakteryjne może stanowić następstwo ospowego (śródmiąższowe) zapalenia płuc lub rozwijać się niezależnie od tego procesu[4].
- Powikłania neurologiczne
Zakażenie wirusem VZV może wiązać się z powikłaniami neurologicznymi, których częstość szacuje się 1–3/100 000 przypadków[18]
Do najczęstszych powikłań neurologicznych zakażenia VZV należy zapalenie mózgu oraz zespół ataksji móżdżkowej. Rzadziej występuje poprzeczne zapalenie rdzenia kręgowego, aseptyczne zapalenie opon mózgowo-rdzeniowych, zespół Guillaina-Barrégo[18] i porażenie nerwów czaszkowych[5].
Zespół ataksji móżdżkowej jest stwierdzany z częstością 1 na 4 000 przypadków ospy wietrznej u dzieci[18][23]. Jest to najczęstsze powikłanie neurologiczne w tej grupie wiekowej[23]. Ataksja rozwija się w ciągu kilku dni od wystąpienia ospy, ataksji zwykle towarzyszą wymioty, ból głowy, oczopląs[18], dysmetria i dyzartria[23]. Choroba zwykle ustępuje samoistnie w ciągu 1–3 tygodni bez trwałych następstw[18].
Zapalenie mózgu jest najpoważniejszym powikłaniem ospy wietrznej. Najwyższe ryzyko zachorowania dotyczy dorosłych i niemowląt. Jest stwierdzane w 1–2 przypadków na 10 000 zachorowań na ospę wietrzną. Stwierdza się zaburzenia świadomości, gorączkę, bóle głowy, wymioty, drgawki, osłabienie lub wzmożenie odruchów ścięgnistych, występowanie odruchów patologicznych, porażenia, zaburzenia sensoryczne, ataksja, nadciśnienie tętnicze lub niedociśnienie tętnicze. W płynie mózgowo-rdzeniowym stwierdza się umiarkowaną pleocytozę limfocytową, zwykle poniżej 100 komórek/μl, umiarkowanie podwyższenie stężenie białka (50–100 mg/dl) i prawidłowe stężenie glukozy. Śmiertelność zapalenia mózgu wynosi 5%–10%, a trwałe następstwa dotyczą 10%–20% wyleczonych[18]
- Pozostałe
Rzadko w przebiegu ospy wietrznej dochodzi do zapalenia mięśnia sercowego, zapalenia stawów, zapalenia wątroby, cewkowo-śródmiąższowego zapalenia nerek i małopłytkowości[5].
Zespół ospy wrodzonej i ospa w trakcie ciąży
- Obraz kliniczny
Zakażenie ospą wietrzną u seronegatywnej matki wiąże się z ryzykiem transmisji wirusa na płód. Wystąpienie zespołu ospy wrodzonej w I i II trymestrze ciąży może doprowadzić do obumarcia płodu lub rozwoju zespołu ospy wrodzonej. W umiarkowanej strefie klimatycznej ze względu na powszechność zakażenia VZV w dzieciństwie, kliniczne zakażenie płodu jest rzadkie. Ocenia się, że zakażenie matki, która nie przebyła wcześniej zakażenia ospą wietrzną, we wczesnej ciąży wiąże się z 25% ryzykiem zakażenia płodu. Pojawienie się klinicznego zespołu ospy wrodzonej nie jest częste[20]. Zachorowanie na ospę przed 13. tygodniem ciąży wiąże się 0,7% ryzykiem wystąpienia zespołu ospy wrodzonej, z kolei pomiędzy 13. a 20. tygodniem ciąży ryzyko wynosi 2%[24][25]. Bardzo rzadko stwierdzane są przypadki zachorowań po 20. tygodniu ciąży, pojawiające się przed 28. tygodniem ciąży[20]. Przyjmuje się, że zachorowanie na ospę wietrzną po 20. tygodniu ciąży nie wiąże się z ryzykiem uszkodzenia płodu, ale we wczesnym okresie życia może pojawiać się półpasiec[3].
Zespół ospy wrodzonej charakteryzuje się obecnością głębokich blizn na skórze, zniekształceniami lub hipoplazją kończyn, zaburzeniami ośrodkowego układu nerwowego obejmującymi małogłowie, wodogłowie, upośledzenie umysłowe, drgawki, atrofię korowo-podkorową, wady oczu obejmujące zaćmę, zapalenie siatkówki i naczyniówki, małoocze oraz zaburzenia układu moczowego obejmujące wodonercze i pęcherz neurogenny. Często stwierdzana jest niska masa urodzeniowa[20].
Zachorowanie u matki na ospę wietrzną do 5 dni przed porodem i 2 dni po porodzie może prowadzić do zakażenia u noworodka o bardzo ciężkim przebiegu (ospa noworodkowa) z zapaleniem płuc, zapaleniem wątroby, zapaleniem mózgu i bardzo wysokiej śmiertelności[26]. Jest to związane z okresem wytwarzania przeciwciał IgG u matki, który jest zbyt krótki, aby umożliwiał bierne uodpornienie noworodka[25]. Konieczne jest podanie noworodkom swoistej immunoglobuliny VZIG[4]. Mimo podania VZIG 30–40% noworodków rozwija zakażenie, ale ryzyko powikłań jest znacznie mniejsze[25].
- Rozpoznanie
Rozpoznanie zespołu ospy wrodzonej jest stawiane na podstawie wywiadu ekspozycji na VZV i obrazu klinicznego. Możliwe jest stwierdzanie wirusowego DNA w próbkach tkanek noworodków za pomocą PCR. U niektórych noworodków przeciwciała w klasie IgM mogą być stwierdzane w krwi pępowinowej. Utrzymywanie się przeciwciał po 12–18 miesiącach u bezobjawowych noworodków i niemowląt wskazuje zakażenie wrodzone, podobnie pojawienie się półpaśca u dzieci do 1. roku życia bez wywiadu ospy wietrznej wskazuje na zakażenie wrodzone[20].
- Profilaktyka
U wszystkich kobiet w ciąży zaleca się ocenę odporności na VZV poprzez stwierdzenie w wywiadzie przebycie zakażenia, przebycie szczepienia przeciw VZV lub oznaczenie swoistych immunoglobulin w klasie IgG[25]. U seronegatywnych kobiet planujących ciążę zaleca się przeprowadzenia szczepienia przeciw VZV[25]. Szczepienie nie jest zalecane w trakcie ciąży i kobietom planującym ciążę w ciągu najbliższego miesiąca, ale nie zanotowano przypadku pojawienia się zespołu ospy wrodzonej u przypadkowo zaszczepionej kobiety w ciąży[25]. U kobiet seronegatywnych w trakcie ciąży zaleca się przeprowadzenie szczepienia ochronnego po porodzie[27][28].
W sytuacji stwierdzenia narażenia kobiety ciężarnej o nieznanym stanie odporności przeciwko ospie wietrznej wykonuje się badanie serologiczne. W przypadku ujemnego wyniku lub niemożliwości otrzymania wiarygodnego wyniku badania w ciągu 96 godzi od ekspozycji podaje się VZIG[25].
U kobiet w ciąży po ekspozycji na VZV zaleca się wykonanie USG w celu oceny płodu[25].
- Leczenie
Leczeniu kobiety w ciąży poddaje się wyłącznie z powikłanym przebiegiem ospy wietrznej, wówczas leczenie polega na podaniu acyklowiru. Acyklowir skraca długość trwania gorączki i łagodzi objawy zakażenia, ale musi być podany w ciągu 24 godzin od pojawienia się wysypki[25]. Acyklowir poprzez hamowanie replikacji wirusa może hamować przenikanie wirusa przez łożysko[29][30][25]. Nie zaobserwowano zwiększonego ryzyka powikłań związanego ze stosowaniem acyklowiru u kobiet w ciąży[31][25]. Jednak leku nie zaleca się w ramach profilaktyki kobiet w ciąży narażonych na kontakt z wirusem[25].
Uszkodzenia płodu związane z VZV nie postępują po porodzie, dlatego u noworodków z zespołem ospy wrodzonej nie stosuje się acyklowiru[20].
Rozpoznanie
Rozpoznanie ospy wietrznej jest stawiane na podstawie typowego obrazu klinicznego choroby i badania dodatkowe zwykle nie są potrzebne[32][3][33]. Badania pomocnicze znajdują zastosowanie u chorych z zaburzeniami odporności oraz u kobiet w ciąży, ponieważ w tej grupie chorych istotne jest wdrożenie leczenia przyczynowego[3]. Również mogą być przydatne w przypadku atypowego przebiegu choroby[32].
Za pomocą PCR możliwe jest stwierdzenie obecności materiału genetycznego wirusa z płynu z pęcherzyków[32]. Immunofluorescencja bezpośrednia pozwala na szybkie rozpoznanie obecności antygenów VZV w materiale ze zeskrobin z dna pęcherzyka[32].
Izolacja wirusa nie jest wykonywana rutynowo, ze względu na nietrwałość wirusa[34]. Hodowla wymaga kilkudniowego oczekiwania na wynik badania[32]. W materiale biologicznym pod mikroskopem stwierdza się efekt cytopatyczny, który jest podobny do wywołanego przez HSV. Stwierdza się wówczas wtręty jądrowe Cowdry typu A i syntytia. Syncytia są również stwierdzane podczas rozmazu Tzancka ze materiału ze zeskrobin z dna pęcherzyka[35].
Metody serologiczne nie nadają się do szybkiej diagnostyki[3]. Stwierdzenie swoistych przeciwciał przeciw VZV jest dowodem przebytego zakażenia i odporności na wirusa[3][32]. Czterokrotny wzrost miana przeciwciał IgG przemawia za ostrą infekcją[32]. Ocena przeciwciał IgM nie jest rutynowo stosowana w rozpoznawaniu i wykluczaniu zakażenia VZV, ponieważ komercyjne testy nie są wiarygodne, a ponadto kinetyka odpowiedzi z utworzeniem IgM nie jest dobrze określona[32].
W badaniach laboratoryjnych do 72 godzin od pojawienia się wysypki może występować leukopenia, po tym czasie może być stwierdzana względna lub bezwzględna leukocytoza. U części chorych obserwuje się niewielkie podwyższenie aktywności enzymów wątrobowych. U chorych z zajęciem ośrodkowego układu nerwowego w płynie mózgowo-rdzeniowym stwierdza niewielką pleocytozę, niewielkiego do umiarkowanego stopnia podwyższenie stężenia białka, a stężenie glukozy zwykle pozostaje w normie[32].
Leczenie
U chorych poniżej 12. roku życia z prawidłową odpornością i łagodnym przebiegu choroby stosuje się wyłącznie leczenie objawowe[4][33]. U wszystkich chorych zaleca się codzienną kąpiel z delikatnym osuszaniem skóry ręcznikiem[4][33]. W leczeniu gorączki stosuje się paracetamol. Nie zaleca się kwasu acetylosalicylowego (aspiryna) ze względu na ryzyko zespołu Reye’a[4][33]. W leczeniu świądu stosuje się leki przeciwhistaminowe I generacji. W razie potrzeby stosuje się leki przeciwbólowe[4].
Leczenie przyczynowe jest stosowane w przypadku ciężkiego przebiegu choroby, u chorych z zaburzeniami odporności, w przypadku powikłań oraz u chorych w grupie ryzyka wystąpienia powikłań ospy wietrznej. Lekiem pierwszego rzutu jest acyklowir, który podaje się doustnie pięć razy dziennie w dawce 800 mg u dorosłych oraz 80 mg/kg u dzieci w pięciu dawkach podzielonych przez kolejne 5–7 dni[33]. Korzyści z leczenia przyczynowego u osób bez ryzyka powikłań lub ciężkiego przebiegu choroby za pomocą acyklowiru są marginalne[36] i wobec wysokich kosztów leczenia i stosunkowo niewielkiego ryzyka powikłań w grupie zdrowych osób takie postępowanie nie jest zalecane[32].
W przypadku bardzo ciężkiego przebiegu ospy, powikłań lub upośledzenia odporności acyklowir podaje się dożylnie w dawce 10 mg/kg u dorosłych przez kolejne 7–10 dni, z kolei u dzieci w dawce 500 mg/m2 powierzchni ciała. U chorych z ciężkim upośledzeniem odporności dodatkowo podaje się swoistą immunoglobulinę (VZIG) w dawce 2 mg/kg masy ciała[33]. Podczas leczenia acyklowirem konieczne jest odpowiednie nawodnienie chorego, ponieważ acyklowir może krystalizować się w nerkach. Stosuje się wlew dożylny krystaloidów o objętości równej objętości leku i kontroluje się stężenie kreatyniny co 3 dni[4]. Leczenie jest najskuteczniejsze, gdy zostaje włączone w ciągu 24 godzin od pojawienia się wysypki[37][38], a korzyści kliniczne z leczenia acyklowirem są znaczne mniejsze, gdy leczenie zostanie podane w ciągu 24–72 godzin od pojawienia się wysypki[39].
Bardzo rzadko stwierdza się oporność na acyklowir, występującą głównie u chorych z zaburzeniami odporności, przede wszystkim u zakażonych HIV[32][40][41], co jest związane z częstymi nawrotami choroby i koniecznością wielokrotnego leczenia[32]. W przypadku stwierdzenia oporności na acyklowir podaje się foskarnet[42][43]. Istnieją ograniczone dowody na skuteczność cydofowiru[44][43] oraz widarabiny[45][46][43].
Zapobieganie
W prewencji zakażeń VZV stosuje się metody swoiste i nieswoiste. Do metod profilaktyki swoistej zalicza się szczepienie ochronne, immunoprofilaktykę bierną i profilaktykę farmakologiczną[4].
Szczepienie przeciw VZV zostało opracowane w 1974 roku, początkowo było stosowane w profilaktyce dzieci o wysokim ryzyku powikłań. W 1989 roku w Korei i Japonii zastosowano szczepionkę u zdrowych osób[47]. Szczepionka zawiera atenuowany wirus VZV typu Oka[33][48]. Szczepionka może być stosowana od 9. miesiąca życia. Dzieci do 12. roku życia są szczepione pojedynczą dawką preparatu, a po 12. roku życia dwoma dawkami podanymi w odstępie 4–8 tygodni[33]. Ponad 95% zaszczepionych jedną dawką szczepionki dzieci osiąga ochronny poziom przeciwciał[47][49].
Żywa ateuowana szczepionka stanowi zagrożenie dla chorych ze znacznie obniżoną odpornością[47], jednak szczepionka może być podana u dzieci z białaczką w okresie remisji oraz zakażonych HIV bez ciężkiego niedoboru odporności[33][47]. U osób z głęboko upośledzoną odpornością możliwe jest wystąpienie uogólnionego zakażenia po zaszczepieniu atenuowanym szczepem Oka[47][50][51][52].
Szczepienie jest szczególnie zalecane u chorych pozostających w bliskim kontakcie z osobą z niedoborem odporności, u chorych na ostrą białaczkę w okresie remisji (liczb limfocytów powyżej 1200/μl), u chorych przed zaplanowanym przeszczepieniem szpiku kostnego lub narządu, u kobiet planujących ciążę (ale nie w ciąży), osobom mającym zawodowy kontakt z dziećmi oraz u pracowników placówek opieki zdrowotnej[48]. Szczepienie jest przeciwwskazane w ciąży oraz ciężkim komórkowym lub humoralnym, pierwotnym albo nabytym niedoborze odporności, objawowym zakażeniu HIV lub przy odsetku limfocytów T CD4+ u dzieci poniżej 12. miesiąca życia <25% wartości właściwej dla wieku, w wieku 12.–35. miesięcy <20%, w wieku 36.–59. miesięcy <15%[53]. Należy unikać zajścia w ciążę w ciągu miesiąca od szczepienia[53].
Immunoprofilaktyce biernej za pomocą podania swoistej immunoglobuliny IVIG poddaje się noworodki, których matki zachorowały na ospę pomiędzy 5. dniem przed porodem do 2. dnia po porodzie oraz chorych nieszczepionych i nieprzechodzących ospy wietrznej z istotnym pierwotnym lub wtórnym niedoborem odporności komórkowej w ramach profilaktyki poekspozycyjnej[4]. U chorych z istotnym pierwotnym lub wtórnym niedoborem odporności komórkowej po kontakcie z chorym na ospę wietrzną, w przypadku niedostępności IVIG lub po 96 godzinach od ekspozycji, podaje się acyklowir w dawce 800 mg co 6 godzin od 7. dnia od ekspozycji przez kolejne 7 dni[4].
Metodą nieswoistą profilaktyki zakażenia VZV należy izolacja chorych. Transmisji zakażeniu bardzo trudno zapobiec ze względu na zakaźność chorych już na 24–48 godzin przed pojawieniem się wysypki. Chorych izoluje się do czasu przyschnięcia wszystkich wykwitów, a w przypadku wystąpienia wysypki plamisto-grudkowej u osoby szczepionej do czasu pojawiania się nowych wykwitów[54]. Osoby podatne na zakażenie po kontakcie z chorym na ospę wietrzną powinny być izolowane od 10. do 21. dnia od kontaktu (okres wylęgania choroby), ale w sytuacji gdy podano IVIG izolacja musi trwać od 10. do 28. dnia od kontaktu[55].
Przypisy
- ↑ Cianciara i Juszczyk 2007 ↓, s. 515-516.
- ↑ a b c d e Kaslow, Stanberry i Le Duc 2014 ↓, s. 972.
- ↑ a b c d e f g h i j k l m n o p Szczeklik i Gajewski 2014 ↓, s. 2271.
- ↑ a b c d e f g h i j k l m n o p Szczeklik i Gajewski 2014 ↓, s. 2272.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y Cianciara i Juszczyk 2007 ↓, s. 516.
- ↑ a b c Kliegman i in. 2015 ↓, s. 1579.
- ↑ a b Bolognia, Jorizzo i Schaffer 2012 ↓, s. 1328.
- ↑ a b c Long, Pickering i Prober 2012 ↓, s. 1036.
- ↑ Kaslow, Stanberry i Le Duc 2014 ↓, s. 973.
- ↑ a b SA. Pergam, AP. Limaye. Varicella zoster virus (VZV) in solid organ transplant recipients. „Am J Transplant”. 9 Suppl 4, s. S108-15, Dec 2009. DOI: 10.1111/j.1600-6143.2009.02901.x. PMID: 20070670.
- ↑ a b c d Kaslow, Stanberry i Le Duc 2014 ↓, s. 976.
- ↑ a b Szczeklik i Gajewski 2014 ↓, s. 2270.
- ↑ a b c d Kliegman i in. 2015 ↓, s. 1580.
- ↑ a b c d e L. Zerboni, N. Sen, SL. Oliver, AM. Arvin. Molecular mechanisms of varicella zoster virus pathogenesis. „Nat Rev Microbiol”. 12 (3), s. 197-210, Mar 2014. DOI: 10.1038/nrmicro3215. PMID: 24509782.
- ↑ Long, Pickering i Prober 2012 ↓, s. 1035.
- ↑ CC. Ku, J. Besser, A. Abendroth, C. Grose i inni. Varicella-Zoster virus pathogenesis and immunobiology: new concepts emerging from investigations with the SCIDhu mouse model. „J Virol”. 79 (5), s. 2651-8, Mar 2005. DOI: 10.1128/JVI.79.5.2651-2658.2005. PMID: 15708984.
- ↑ Kliegman i in. 2015 ↓, s. 1580-1581.
- ↑ a b c d e f g h i j k JW. Gnann. Varicella-zoster virus: atypical presentations and unusual complications. „J Infect Dis”. 186 Suppl 1, s. S91-8, Oct 2002. DOI: 10.1086/342963. PMID: 12353193.
- ↑ C. Aebi, A. Ahmed, O. Ramilo. Bacterial complications of primary varicella in children. „Clin Infect Dis”. 23 (4), s. 698-705, Oct 1996. PMID: 8909829.
- ↑ a b c d e f g Kliegman i in. 2015 ↓, s. 1582.
- ↑ a b c d E. Chiner, I. Ballester, I. Betlloch, J. Blanquer i inni. Varicella-zoster virus pneumonia in an adult population: has mortality decreased?. „Scand J Infect Dis”. 42 (3), s. 215-21, Mar 2010. DOI: 10.3109/00365540903428166. PMID: 20055724.
- ↑ a b AH. Mohsen, M. McKendrick. Varicella pneumonia in adults. „Eur Respir J”. 21 (5), s. 886-91, May 2003. PMID: 12765439.
- ↑ a b c E. Bozzola, M. Bozzola, AE. Tozzi, V. Calcaterra i inni. Acute cerebellitis in varicella: a ten year case series and systematic review of the literature. „Ital J Pediatr”. 40, s. 57, 2014. DOI: 10.1186/1824-7288-40-57. PMID: 24942129.
- ↑ G. Koren. Risk of varicella infection during late pregnancy. „Can Fam Physician”. 49, s. 1445-6, Nov 2003. PMID: 14649980.
- ↑ a b c d e f g h i j k l Alon Shrim, Gideon Koren, Mark H. Yudin, Dan Farine. Management of Varicella Infection (Chickenpox) in Pregnancy. „J Obstet Gynaecol Can”, 2012.
- ↑ Kliegman i in. 2015 ↓, s. 1581.
- ↑ KM. Bialas, GK. Swamy, SR. Permar. Perinatal cytomegalovirus and varicella zoster virus infections: epidemiology, prevention, and treatment. „Clin Perinatol”. 42 (1), s. 61-75, viii, Mar 2015. DOI: 10.1016/j.clp.2014.10.006. PMID: 25677997.
- ↑ KE. Shields, K. Galil, J. Seward, RG. Sharrar i inni. Varicella vaccine exposure during pregnancy: data from the first 5 years of the pregnancy registry. „Obstet Gynecol”. 98 (1), s. 14-9, Jul 2001. PMID: 11430950.
- ↑ GI. Henderson, ZQ. Hu, RF. Johnson, AB. Perez i inni. Acyclovir transport by the human placenta. „J Lab Clin Med”. 120 (6), s. 885-92, Dec 1992. PMID: 1453110.
- ↑ EJ. Landsberger, WD. Hager, JH. Grossman. Successful management of varicella pneumonia complicating pregnancy. A report of three cases. „J Reprod Med”. 31 (5), s. 311-4, May 1986. PMID: 3746781.
- ↑ JG. Spangler, JK. Kirk, MP. Knudson. Uses and safety of acyclovir in pregnancy. „J Fam Pract”. 38 (2), s. 186-91, Feb 1994. PMID: 8308511.
- ↑ a b c d e f g h i j k l Kliegman i in. 2015 ↓, s. 1584.
- ↑ a b c d e f g h i Cianciara i Juszczyk 2007 ↓, s. 517.
- ↑ Murray, Rosenthal i Pfaller 2011 ↓, s. 510.
- ↑ Murray, Rosenthal i Pfaller 2011 ↓, s. 509.
- ↑ LM. Dunkle, AM. Arvin, RJ. Whitley, HA. Rotbart i inni. A controlled trial of acyclovir for chickenpox in normal children. „N Engl J Med”. 325 (22), s. 1539-44, Nov 1991. DOI: 10.1056/NEJM199111283252203. PMID: 1944438.
- ↑ HM. Feder. Treatment of adult chickenpox with oral acyclovir. „Arch Intern Med”. 150 (10), s. 2061-5, Oct 1990. PMID: 2222091.
- ↑ MR. Wallace, WA. Bowler, NB. Murray, SK. Brodine i inni. Treatment of adult varicella with oral acyclovir. A randomized, placebo-controlled trial. „Ann Intern Med”. 117 (5), s. 358-63, Sep 1992. PMID: 1323943.
- ↑ DC. Choo, SK. Chew, EH. Tan, MK. Lim i inni. Oral acyclovir in the treatment of adult varicella. „Ann Acad Med Singapore”. 24 (2), s. 316-21, Mar 1995. PMID: 7653978.
- ↑ A. Sauerbrei, J. Taut, R. Zell, P. Wutzler. Resistance testing of clinical varicella-zoster virus strains. „Antiviral Res”. 90 (3), s. 242-7, Jun 2011. DOI: 10.1016/j.antiviral.2011.04.005. PMID: 21539861.
- ↑ MA. Jacobson, TG. Berger, S. Fikrig, P. Becherer i inni. Acyclovir-resistant varicella zoster virus infection after chronic oral acyclovir therapy in patients with the acquired immunodeficiency syndrome (AIDS). „Ann Intern Med”. 112 (3), s. 187-91, Feb 1990. PMID: 2297195.
- ↑ T. Hatchette, GA. Tipples, G. Peters, A. Alsuwaidi i inni. Foscarnet salvage therapy for acyclovir-resistant varicella zoster: report of a novel thymidine kinase mutation and review of the literature. „Pediatr Infect Dis J”. 27 (1), s. 75-7, Jan 2008. DOI: 10.1097/INF.0b013e3181598315. PMID: 18162946.
- ↑ a b c L. Strasfeld, S. Chou. Antiviral drug resistance: mechanisms and clinical implications. „Infect Dis Clin North Am”. 24 (2), s. 413-37, Jun 2010. DOI: 10.1016/j.idc.2010.01.001. PMID: 20466277.
- ↑ R. Snoeck, G. Andrei, E. De Clercq. Novel agents for the therapy of varicella-zoster virus infections. „Expert Opin Investig Drugs”. 9 (8), s. 1743-51, Aug 2000. DOI: 10.1517/13543784.9.8.1743. PMID: 11060773.
- ↑ T. Kamiyama, M. Kurokawa, K. Shiraki. Characterization of the DNA polymerase gene of varicella-zoster viruses resistant to acyclovir. „J Gen Virol”. 82 (Pt 11), s. 2761-5, Nov 2001. DOI: 10.1099/0022-1317-82-11-2761. PMID: 11602787.
- ↑ P. Reusser, C. Cordonnier, H. Einsele, D. Engelhard i inni. European survey of herpesvirus resistance to antiviral drugs in bone marrow transplant recipients. Infectious Diseases Working Party of the European Group for Blood and Marrow Transplantation (EBMT). „Bone Marrow Transplant”. 17 (5), s. 813-7, May 1996. PMID: 8733703.
- ↑ a b c d e O. Papaloukas, G. Giannouli, V. Papaevangelou. Successes and challenges in varicella vaccine. „Ther Adv Vaccines”. 2 (2), s. 39-55, Mar 2014. DOI: 10.1177/2051013613515621. PMID: 24757524.
- ↑ a b Szczeklik i Gajewski 2014 ↓, s. 2395.
- ↑ PJ. Provost, DL. Krah, BJ. Kuter, DH. Morton i inni. Antibody assays suitable for assessing immune responses to live varicella vaccine. „Vaccine”. 9 (2), s. 111-6, Feb 1991. PMID: 1647574.
- ↑ SS. Chaves, P. Haber, K. Walton, RP. Wise i inni. Safety of varicella vaccine after licensure in the United States: experience from reports to the vaccine adverse event reporting system, 1995-2005. „J Infect Dis”. 197 Suppl 2, s. S170-7, Mar 2008. DOI: 10.1086/522161. PMID: 18419393.
- ↑ O. Levy, JS. Orange, P. Hibberd, S. Steinberg i inni. Disseminated varicella infection due to the vaccine strain of varicella-zoster virus, in a patient with a novel deficiency in natural killer T cells. „J Infect Dis”. 188 (7), s. 948-53, Oct 2003. DOI: 10.1086/378503. PMID: 14513412.
- ↑ MJ. Levin, KM. Dahl, A. Weinberg, R. Giller i inni. Development of resistance to acyclovir during chronic infection with the Oka vaccine strain of varicella-zoster virus, in an immunosuppressed child. „J Infect Dis”. 188 (7), s. 954-9, Oct 2003. DOI: 10.1086/378502. PMID: 14513413.
- ↑ a b mp.pl: Varilrix. [dostęp 2016-04-16].
- ↑ Szczeklik i Gajewski 2014 ↓, s. 2272-2273.
- ↑ Szczeklik i Gajewski 2014 ↓, s. 2273.
Bibliografia
- Janusz Cianciara, Jacek Juszczyk: Choroby zakaźne i pasożytnicze. Lublin: CZELEJ, 2007. ISBN 978-83-60608-34-0.
- Robert M. Kliegman, Bonita F. Stanton, Joseph St. Geme, Nina Felice Schor, Richard E. Behrman: Nelson Textbook of Pediatrics. Elsevier Health Sciences, 2015. ISBN 978-1-4557-7566-8.
- Jean L. Bolognia, Joseph L. Jorizzo, Julie V. Schaffer: Dermatology. Elsevier Health Sciences, 2012. ISBN 978-0-7020-5182-1.
- Richard A. Kaslow, Lawrence R. Stanberry, James W. Le Duc: Viral Infections of Humans: Epidemiology and Control. Springer, 2014. ISBN 978-1-4899-7448-8.
- Sarah S. Long, Larry K. Pickering, Charles G. Prober: Principles and Practice of Pediatric Infectious Disease. Elsevier Health Sciences, 2012. ISBN 978-1-4377-2702-9.
- Andrzej Szczeklik, Piotr Gajewski: Interna Szczeklika 2014. Kraków: Medycyna Praktyczna, 2014. ISBN 978-83-7430-405-4.
- Patrick R. Murray, Ken S. Rosenthal, Michael A. Pfaller: Mikrobiologia. Elsevier, 2011. ISBN 978-83-7609-294-2.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Chickenpox.
Image on left shows approximate distribution of smallpox rash. Image on right shows approximate distribution of chickenpox rash.
Electron micrograph of a Varicella (Chickenpox) Virus. Varicella or Chickenpox, is an infectious disease caused by the varicella-zoster virus, which results in a blister-like rash, itching, tiredness and fever.
Autor: Sage Ross, Licencja: CC BY-SA 3.0
A pile of round white aciclovir tablets
Autor: unknown, Licencja: CC BY 4.0
This glass bottle contains immunoglobulin to fight against chickenpox. Immunoglobulin is a type of antibody found in blood plasma. Taken from donors recovering from chicken pox, immunoglobulin is injected into those who are at risk from the disease. These include premature babies, whose immune system would not be able to cope with the infection.
Chickenpox is a common and highly infectious childhood virus which many people experience. An attack gives most people life-long immunity. This sample was produced for the British Ministry of Health.
maker: Unknown maker
Place made: England, United Kingdom
Wellcome Images
Keywords: chicken pox; antibody; Immunoglobulins; virus; immunoglobulin; Viruses; bottle; Premature Birth; Plasma; Chickenpox
personal photo taken with own camera
Autor: user:Grook da oger, Licencja: CC BY-SA 4.0
chickenpox vesicles