Papierek wskaźnikowy
Papierek wskaźnikowy – kawałek bibuły najczęściej w kształcie paska, nasączony roztworem substancji chemicznej będącej indykatorem i wysuszony. Papierek wskaźnikowy po zwilżeniu roztworem wykrywanej substancji zmienia swoje zabarwienie jeżeli substancja ta znajduje się w badanym roztworze. Papierki wskaźnikowe stosuje się do wykrywania różnych substancji. Najpowszechniej stosowane są papierki uniwersalne do określania pH roztworu.
Papierki do określania pH roztworu
Papierek uniwersalny
Papierek do oznaczania pH roztworu. Po zwilżeniu roztworem badanym przyjmuje barwę pozwalającą określić przybliżoną wartość pH roztworu[1] z dokładnością do 1–2 jednostek pH[2]. Stosowane są papierki zarówno w pełnym zakresie pH (1–14), jak i zawężonych zakresach np. 1–10, a nawet w bardzo wąskich przedziałach skali o większej dokładności np. pH 2,0–4,0.
Papierek kongo
Papierek nasączony roztworem czerwieni kongo stosowany do wykrywania środowiska kwasowego. Zmiana barwy następuje w zakresie pH 3,0–5,2 z niebieskiej na czerwoną.
Papierek lakmusowy
Papierek nasączony roztworem lakmusu, stosowany jest do określania odczynu roztworu (pH). Papierki lakmusowe są coraz rzadziej stosowane, gdyż obecnie pH oznacza się przy pomocy papierków uniwersalnych lub pH-metrów. Wyróżnia się trzy rodzaje papierków lakmusowych: lakmusowy czerwony – do wykrywania odczynu zasadowego, lakmusowy niebieski – do wykrywania odczynu kwasowego oraz lakmusowy obojętny o barwie fioletowej do wykrywania zarówno odczynu kwasowego, jak i zasadowego (w środowisku kwasowym zmienia barwę na czerwoną, a w środowisku zasadowym na niebieską).
Inne papierki wskaźnikowe
Papierek jodoskrobiowy
Papierek nasączony roztworem jonów jodkowych oraz skrobi. Służy do wykrywania utleniaczy w roztworze zabarwiając się na kolor niebieski lub ciemnogranatowy. Pod wpływem utleniacza jony I−
utleniają się do pierwiastkowego jodu I
2, który tworzy z nadmiarem jonów jodkowych jon I−
3 (I−I−I−
). Ten zaś tworzy z amylozą oraz amylopektyną zawartą w skrobi barwny kompleks. Zasada działania papierka jodoskrobiowego jest podobna jak w próbie jodowej na wykrywanie skrobi[3].
Przykładowe zastosowania: Wykrywanie kwasu azotawego (HNO
2) generowanego in situ np. w reakcjach syntezy soli diazoniowych.
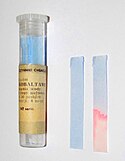
Papierek kobaltawy
Papierek nasączony bezwodnym roztworem soli kobaltu(II) (Co2+
) np. chlorku kobaltu(II) (CoCl
2) w bezwodnym rozpuszczalniku organicznym np. etanolu absolutnym (100%). Służy do wykrywania wilgoci w próbce. Bezwodne sole kobaltu mają barwę błękitno-niebieską. Pod wpływem wody kation Co2+ jest hydratowany przez sześć cząsteczek wody tworząc [Co(H
2O)
6]2+
o barwie różowej.
 |  |  |
| CoCl 2 bezwodny | CoCl 2·6H 2O | Papierki kobaltawe |
Papierek cyrkonowo-alizarynowy S
Papierek stosowany do wykrywania atomów fluoru w cząsteczce badanej substancji po stopieniu z sodem. Wynik próby jest pozytywny jeżeli po naniesieniu kropli zakwaszonej próbki na papierek zmienia on barwę z czerwonej na żółtą. Papierek cyrkonowo-alizarynowy S sporządza się zanurzając czystą bibułę w roztworze mieszaniny azotanu cyrkonu(IV) (Zr(NO
3)
4) w kwasie solnym. Po wysuszeniu bibułę zanurza się w roztworze sulfonianu sodu alizaryny, następnie płucze się go dokładnie wodą i pozostawia do wysuszenia[4].
Papierek ołowiowy
Służy do wykrywania jonów siarczkowych S2−
w roztworze.
Papierek palladowy
Służy do wykrywania CO.
Zobacz też
Przypisy
- ↑ Encyklopedia techniki. Chemia, Władysław Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, OCLC 33835352.
- ↑ Mały słownik chemiczny. Jerzy Chodkowski (red.). Wyd. 5. Warszawa: Wiedza Powszechna, 1976.
- ↑ Arthur Israel Vogel, Preparatyka organiczna, Warszawa: Wydawnictwa Naukowo-Techniczne, 2006, s. 886, ISBN 83-204-3152-2.
- ↑ Arthur Israel Vogel, Preparatyka organiczna, Warszawa: Wydawnictwa Naukowo-Techniczne, 2006, s. 1172–1173, ISBN 83-204-3152-2.
Linki zewnętrzne
Media użyte na tej stronie
Autor: Danielchemik, Licencja: CC BY-SA 3.0
Papierki do wykrywania wody w produktach ropy naftowej
Autor: W. Oelen, Licencja: CC BY-SA 3.0
Cobalt(II) chloride anhydrous
Autor: Parvathisri, Licencja: CC BY-SA 3.0
நீல மற்றும் சிவப்பு லிட்மசுத் தாள்