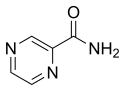
Pirazynamid
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||
| Wzór sumaryczny | C5H5N3O | ||||||||||||||||||||
| Masa molowa | 123,11 g/mol | ||||||||||||||||||||
| Wygląd | biały, krystaliczny, bezwonny proszek[3] | ||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||
| Numer CAS | 98-96-4 | ||||||||||||||||||||
| PubChem | 1046 | ||||||||||||||||||||
| DrugBank | DB00339 | ||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||
| Podobne związki | pirazyna, nikotynamid, benzamid | ||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||
| ATC | J04AK01 | ||||||||||||||||||||
| Stosowanie w ciąży | kategoria C[2]; według WHO można stosować (zgodnie z wytycznymi)[6] | ||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
Pirazynamid, pyrazynamid (łac. pyrazinamidum) – organiczny związek chemiczny, pochodna nikotynamidu o działaniu przeciwgruźliczym. Jeden z pięciu podstawowych leków w leczeniu gruźlicy, stosowany w pierwszej, najintensywniejszej fazie leczenia.
W wątrobie jest przekształcany do czynnego metabolitu – kwasu pirazynowego – który działa wyłącznie na prątki znajdujące się w makrofagach. Mechanizm tego działania jest jednak złożony i nie do końca poznany. Podejrzewa się, że pirazynamid po wniknięciu do komórki bakterii powoduje: obniżenie pH cytoplazmy, zaburzenia metabolizmu NAD oraz zaburzenia funkcji błony komórkowej. Pirazynamid jest stosowany wyłącznie w politerapii, razem z innymi lekami przeciwgruźliczymi. Najpoważniejszym objawem ubocznym jest uszkodzenie wątroby.
Historia
Pirazynamid został zsyntetyzowany po raz pierwszy przez Dalmera i Waltera w 1936 roku, na długo przed odkryciem jego działania na prątki gruźlicze[1]. Zainteresowanie tym lekiem pojawiło się w związku z badaniami prowadzonymi przez Chorine’a w 1945 roku. Wykazał on, że nikotynamid działa hamująco na różne szczepy Mycobacterium tuberculosis[7]. Obserwacja ta została potwierdzona w 1948 roku przez zespół McKenziego z amerykańskiej firmy farmaceutycznej Cyanamid[8]. Równocześnie, badania prowadzone w laboratoriach firm Lederle[9] i Merck[10] wykazały, że to właśnie pirazynamid jest pochodną nikotynamidu o najsilniejszym działaniu przeciwgruźliczym w testach na myszach. Badania te przyczyniły się również do odkrycia dwóch innych związków o działaniu przeciwgruźliczym: izoniazydu[11] i etionamidu[12]. Wprowadzenie PZA do leczenia przebiegało w nietypowy sposób. Nie prowadzono żadnych badań in vitro, a jedynie próby na zwierzętach, których rezultaty nie były jednoznaczne (niektóre badania wskazywały na brak aktywności przeciwgruźliczej pirazynamidu np. u świnek morskich)[13]. Po serii testów zwierzęcych, rozpoczęto próby kliniczne na ludziach, podczas których wykazano wysoką skuteczność pirazynamidu[14]. Pirazynamidem zainteresował się zespół pracowników jednego z laboratoriów na Cornell University pod kierownictwem Walsha McDermotta. Dzięki ich badaniom wyjaśniono paradoks niskiej aktywności pirazynamidu in vitro i jego wysoką aktywność in vivo (pirazynamid jest skuteczny jedynie przy kwaśnym pH, a takie środowisko obecne jest w zmienionych zapalnie tkankach, w wyniku obecności kwasu mlekowego[15]). Zespół McDermotta wykazał również, że za działanie przeciwgruźlicze odpowiada główny metabolit pirazynamidu – kwas pirazynowy[16].
Mechanizm działania
Mechanizm działania pirazynamidu jest najmniej poznany ze wszystkich leków stosowanych w leczeniu gruźlicy. Pirazynamid, jako prolek, wnika do komórki bakteryjnej głównie na drodze pasywnej dyfuzji (choć podejrzewa się, że pewną rolę odgrywa również aktywny transport leku przez pompę sodowo-potasową[17]). We wnętrzu bakterii ulega on przekształceniu przez enzym pirazynamidazę do postaci anionu kwasu pirazynowego (na ilustracji: POA−)[18]. Jon ten zostaje usunięty z komórki M. tuberculosis na drodze pasywnej dyfuzji, a następnie w kwaśnym środowisku jam gruźliczych zostaje zobojętniony przez jony wodorowe (H+)[19]. Jako obojętna elektrycznie cząsteczka, kwas pirazynowy (na ilustracji: HPOA) wnika z powrotem do komórki bakteryjnej, gdzie odłączają się od niego jony wodorowe i obniżają pH cytoplazmy, co inaktywuje wiele enzymów kluczowych dla procesów metabolicznych M. tuberculosis oraz, najprawdopodobniej, hamuje wbudowywanie metioniny w procesie syntezy białek oraz uracylu do RNA[17]. Ponadto wzrost stężenia jonów wodorowych wewnątrz komórki wpływa negatywnie na potencjał błony komórkowej oraz uszkadza kanały jonowe i tym samym zakłóca jej normalne funkcjonowanie. Nie wykazano, by pirazynamid wiązał się z jakimkolwiek składnikiem ściany komórkowej (w badaniach in vitro prowadzonych na lizacie otrzymanym z M. tuberculosis)[17]. Istnieje pogląd, iż przedstawiony mechanizm działania pirazynamidu nie jest specyficzny i dotyczy również innych słabych kwasów[1]. Podejrzewa się również, że kwas pirazynowy może być substratem w syntezie NAD i tym samym powodować powstawanie związku biochemicznie nieczynnego[1][20].

Wcześniejsza teoria dotycząca mechanizmu działania pirazynamidu zakładała, że związek ten jest inhibitorem syntazy kwasów tłuszczowych I (Fas-I, ang. fatty acid synthase-I)[22]. Badania laboratoryjne podają tę teorię w wątpliwość[23][24], choćby ze względu na fakt, iż nie wyizolowano, jak dotąd, szczepów bakterii opornych na pirazynamid, które posiadałyby mutacje w Fas-I[22].
Stosowanie pirazynamidu w pierwszych miesiącach terapii przeciwgruźliczej przyczynia się do szybszego powrotu do zdrowia oraz skraca ogólny czas leczenia[1]. Pirazynamid jest również używany w celach diagnostycznych przy hiperurykemii i hiperurykozurii, ze względu na to, iż jest inhibitorem URAT1 (ang. uric acid transporter)[25].

Aktywność przeciwbakteryjna
Pirazynamid jest aktywny jedynie wobec Mycobacterium tuberculosis complex (M. tuberculosis, M. africanum, M. microti, ale nie wobec M. bovis)[16][26][27]. MIC (najmniejsze stężenie hamujące) dla bakterii wrażliwych wynosi 5,25-50 μg/ml (przy pH 5,5)[28][29], podczas gdy Escherichia coli lub Mycobacterium smegmatis są niewrażliwe na stężenia leku przekraczające 2000 μg/ml przy tym samym pH[18][30]. W zależności od stężenia pirazynamidu we krwi (do 1000 μg/ml), zabiciu ulega maksymalnie 72% populacji bakterii[31]. W badaniach in vitro wykazano długi, utrzymujący się ponad 76 dni, efekt poantybiotykowy pirazynamidu[32]. Pirazynamid wykazuje synergizm z klarytromycyną wobec M. tuberculosis[33].
Oporność
Niewrażliwość na pirazynamid (ale nie na kwas pirazynowy) wiąże się w głównej mierze ze spadkiem aktywności pirazynamidazy i powoduje wystąpienie oporności krzyżowej na nikotynamid, ale nie na inne leki przeciwgruźlicze[16]. Wiąże się to z mutacją w genie pcnA kodującym wspomniany enzym[34]. Naturalna oporność na pirazynamid (np. u M. bovis) wiąże się z mutacją punktową w genie pcnA, gdzie w pozycji 169 cytozyna zastąpiona jest guaniną. Powoduje to zmianę aminokwasu w pirazynamidazie, z histydyny na kwas asparaginowy, w pozycji 57[35]. Oporność bakterii na pirazynamid opiera się również na mechanizmie pompy usuwającej lek z wnętrza komórki (ang. efflux)[30].
Synteza chemiczna
Synteza chemiczna pirazynamidu rozpoczyna się od reakcji o-fenylodiaminy z glioksalem, w wyniku której powstaje chinoksalina. Następnie, związek ten utlenia się nadmanganianem potasu, otrzymując kwas pirazyno-2,3-dikarboksylowy. Kwas ten ulega dekarboksylacji w trakcie ogrzewania – do kwasu pirazyno-2-karboksylowego, który poddaje się estryfikacji z metanolem (w obecności chlorowodoru). Reakcja otrzymanego estru z amoniakiem daje pirazynamid[36].

Farmakokinetyka
Pirazynamid jest szybko i całkowicie wchłaniany z przewodu pokarmowego. Maksymalne stężenie we krwi osiąga po 1–2 h, natomiast jego czynny metabolit – kwas pirazynowy – po 4–5 h. Pirazynamid przenika do płynu mózgowo-rdzeniowego oraz do wszystkich tkanek, osiągając tam 87-105% wartości stężenia w osoczu. Lek przenika również do makrofagów oraz do wydzieliny płucnej i oskrzelowej. Pirazynamid wiąże się z białkami osocza w 10–20% (kwas pirazynowy w 31%). Lek w niewielkim stopniu przenika przez łożysko i do mleka matki. Metabolizm pirazynamidu odbywa się głównie w wątrobie, gdzie jest on hydrolizowany, a następnie przekształcany przez oksydazę ksantynową do kwasu 5-hydroksypirazynowego, który jest głównym wydalanym metabolitem. Niewielkie ilości leku są hydrolizowane również w żołądku i pęcherzyku żółciowym. Okres półtrwania zależny jest od stopnia upośledzenia czynności nerek i wątroby:
- w przypadku chorych bez zaburzeń pracy tych narządów, czas ten wynosi 9–10 h dla pirazynamidu i około 12 h dla kwasu pirazynowego
- w przypadku chorych z zaburzeniami funkcjonowania tych narządów, okres półtrwania dla pirazynamidu wynosi 26 h, a dla kwasu pirazynowego – 22 h
W ciągu 24 h po podaniu doustnym, około 70% dawki pirazynamidu wydalane jest przez nerki (głównie w wyniku przesączania kłębuszkowego).
Wskazania
Wskazania[2]:
- w pierwszej, najintensywniejszej fazie leczenia gruźlicy w skojarzeniu z ryfampicyną i izoniazydem
- w leczeniu gruźlicy pozapłucnej oraz gruźlicy płuc opornej na ryfampicynę lub izoniazyd, zawsze w skojarzeniu z innymi lekami przeciwgruźliczymi
Przeciwwskazania
- nadwrażliwość na substancję czynną
- niewydolność wątroby
- nadużywanie alkoholu lub choroba alkoholowa
- istniejąca dna moczanowa
- porfiria (stwierdzono związek między podawaniem pirazynamidu a występowaniem ostrych ataków tej choroby[37])
Ostrzeżenia specjalne
- Ze względu na to, iż pirazynamid już w dawkach terapeutycznych może powodować hepatotoksyczność, zaleca się monitorowanie stanu wątroby oraz nieprzekraczanie dziennej dawki 1,5 g. Należy również bacznie obserwować pacjentów leczonych pirazynamidem, u których stwierdzono w wywiadzie przebyte choroby wątroby.
- Pirazynamid hamuje nerkowe wydalanie kwasu moczowego. Należy monitorować jego stężenie we krwi, by w razie potrzeby wdrożyć odpowiednie leczenie zapobiegające wystąpieniu objawów dny.
- Zaleca się, by stosowanie pirazynamidu u dzieci ograniczone było wyłącznie do lecznictwa zamkniętego[38]. U osób dorosłych zaleca się rozpoczęcie terapii tym lekiem w lecznictwie zamkniętym, a następnie dalsze jej kontynuowanie pod nadzorem pulmonologa.
- Pirazynamid należy stosować ostrożnie w przypadku chorych z niewydolnością nerek i cukrzycą.
Interakcje
Leki stosowane w leczeniu dny moczanowej (probenecyd i allopurinol), podawane razem z pirazynamidem, mogą podwyższać stężenie jego głównego metabolitu – kwasu pirazynowego – we krwi, co zwiększa hiperurykemię, a także może przyczynynić się do wystąpienia objawów uszkodzenia wątroby. Nie zaleca się więc stosowania tych leków w celu obniżania podwyższonego poziomu kwasu moczowego we krwi u chorych leczonych pirazynamidem[39][40]. Pirazynamid może zmniejszać stężenie cyklosporyny, co z kolei może wpływać na stopień immunosupresji[41]. Niektóre badania wskazują na to, że zydowudyna znacznie obniża poziom pirazynamidu we krwi u chorych przyjmujących te dwa leki równocześnie[42]. Lewofloksacyna może nasilać działania niepożądane pirazynamidu[43][44].
Działania niepożądane
Hepatotoksyczność jest najpoważniejszym działaniem niepożądanym, w dużej mierze zależnym od dawki i czasu podawania[45]. Wydaje się, że stosowanie pirazynamidu razem z ryfampicyną i izoniazydem nie zwiększa prawdopodobieństwa wystąpienia tego objawu ubocznego, zwiększa je natomiast już istniejąca niewydolność wątroby lub inne jej choroby[38][46]. Zaobserwowano również mniejszą częstość występowania hepatotoksyczności u pacjentów otrzymujących pirazynamid w ramach początkowej, intensywnej fazy leczenia w porównaniu z pacjentami przyjmującymi ten lek w latentnej fazie choroby[3]. Hiperurykemia, występująca u chorych przyjmujących pirazynamid, wiąże się z hamowaniem wydalania kwasu moczowego przez główny metabolit leku – kwas pirazynowy[47]. Bezobjawowa hiperurykemia występuje u 52,2% pacjentów leczonych pirazynamidem, ryfampicyną i izoniazydem, w porównaniu z 5,4% w przypadku schematu leczenia bez pirazynamidu[46], i ustępuje po zakończeniu leczenia[38]. Podwyższony poziom kwasu moczowego, wywołany przez pirazynamid, może prowadzić do wystąpienia napadu dny moczanowej i/lub bólów stawów, ten objaw uboczny pojawia się jednak stosunkowo rzadko[48].
Do pozostałych objawów ubocznych leczenia pirazynamidem zaliczyć można:
- zaburzenia przewodu pokarmowego (nudności, wymioty, zaburzenia łaknienia)[49]
- niedokrwistość z niedoboru żelaza, niedokrwistość syderoblastyczna[50]
- trombocytopenia[51]
- skórne odczyny alergiczne (wysypka, świąd, pokrzywka)[52]
Bardzo rzadko mogą wystąpić: gorączka, światłowstręt, trudności w oddawaniu moczu, śródmiąższowe zapalenie nerek. Odnotowano również pojedyncze przypadki pelagry (objawy choroby ustąpiły po podaniu nikotynamidu)[53] oraz ostrego nadciśnienia tętniczego[54]. Istnieją również doniesienia o zaburzeniach psychicznych spowodowanych podawaniem pirazynamidu[55].
Dawkowanie
W najczęściej stosowanym schemacie leczenia gruźlicy u osób dorosłych pirazynamid podaje się w ilości 1,5 g w jednej dawce dobowej. U dzieci stosuje się pirazynamid w dawce od 20 do 30 mg/kg masy ciała, również w jednej dawce dobowej. Nie należy podawać dawki dobowej przekraczającej 2,0 g[56]. W przypadku chorych cierpiących na niewydolność nerek konieczne jest zmniejszenie dawki w zależności od klirensu kreatyniny (lub wydłużenie odstępu między kolejnymi dawkami)[57][58].
Objawy przedawkowania
Istnieją skąpe dane na ten temat. W jednym przypadku odnotowano zaburzenia czynnościowe wątroby, które ustąpiły samoistnie po zaprzestaniu terapii pirazynamidem[59]. Po stwierdzeniu przedawkowania należy zastosować leczenie podtrzymujące czynności życiowe, kontrolować funkcje wątroby oraz badać stężenie kwasu moczowego we krwi. W ciężkich przypadkach można przeprowadzić dializę.
Preparaty
- Pyrazinamid Farmapol – tabletki[2]
Uwagi
- ↑ Okres półtrwania jest uzależniony od wydolności nerek.
Przypisy
- ↑ a b c d e f Y. Zhang, D. Mitchison. The curious characteristics of pyrazinamide: a review. „Int J Tuberc Lung Dis”. 7 (1), s. 6–21, Jan 2003. PMID: 12701830.
- ↑ a b c d Indeks leków Medycyny Praktycznej 2009. Kraków: Wydawnictwo Medycyna Praktyczna, 2009. ISBN 978-83-7430-221-0.; Pyrazinamid Farmapol, Medycyna praktyczna dla lekarzy [dostęp 2018-11-18].
- ↑ a b c Sean C. Sweetman: Martindale: The Complete Drug Reference. Wyd. 36. Pharmaceutical Press, s. 320–322. ISBN 978-0-85369-840-1.
- ↑ a b c d e f g h i j k l R. Christopher Harmon: Pyrazinamide. W: xPharm: The Comprehensive Pharmacology Reference. Elsevier, 2008. DOI: 10.1016/B978-008055232-3.62492-4.
- ↑ a b CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, s. 3-472, 5-96, ISBN 978-1-4822-0867-2.
- ↑ Guidelines for the programmatic management of drug-resistant tuberculosis (emergency update 2008) (ang.). [dostęp 2010-04-18].
- ↑ V. Chorine. Action de l’amide nicotinique sur les bacilles du genre Mycobacterium. „Comp Rend Acad Sci (Paris)”. 220, s. 150–151, 1945.
- ↑ D. McKenzie, L. Malone. The effect of nicotinic acid amide on experimental tuberculosis of white mice. „J Lab Clin Med”. 33 (10), s. 1249–1253, Oct 1948. PMID: 18886322.
- ↑ L. Malone, A. Schurr, H. Lindh, D. McKenzie i inni. The effect of pyrazinamide (aldinamide) on experimental tuberculosis in mice. „Am Rev Tuberc”. 65 (5), s. 511–518, May 1952. PMID: 14924173.
- ↑ M. Solotorovsky, F.J. Gregory, E.J. Ironson, E.J. Bugie i inni. Pyrazinoic acid amide; an agent active against experimental murine tuberculosis. „Proc Soc Exp Biol Med”. 79 (4), s. 563–565, Apr 1952. PMID: 14920496.
- ↑ H.H. Fox. The chemical approach to the control of tuberculosis. „Science”. 116 (3006), s. 129–134, Aug 1952. PMID: 14950210.
- ↑ N. Rist, F. Grumbach, D. Libermann. Experiments on the antituberculous activity of alpha-ethylthioisonicotinamide. „Am Rev Tuberc”. 79 (1), s. 1–5, Jan 1959. PMID: 13606329.
- ↑ W. Steenken, E. Wolinsky. The antituberculous activity of pyrazinamide in vitro and in the guinea pig. „Am Rev Tuberc”. 70 (2), s. 367–369, Aug 1954. PMID: 13180876.
- ↑ R.L. Yeager, W.G. Munroe, F.I. Dessau. Pyrazinamide (aldinamide) in the treatment of pulmonary tuberculosis. „Trans Annu Meet Natl Tuberc Assoc”. 48, s. 178–201, 1952. PMID: 13038888.
- ↑ W. McDermott, R. Tompsett. Activation of pyrazinamide and nicotinamide in acidic environments in vitro. „Am Rev Tuberc”. 70 (4), s. 748–754, Oct 1954. PMID: 13197751.
- ↑ a b c K. Konno, F.M. Feldmann, W. McDermott. Pyrazinamide susceptibility and amidase activity of tubercle bacilli. „Am Rev Respir Dis”. 95 (3), s. 461–469, Mar 1967. PMID: 4225184.
- ↑ a b c Y. Zhang, M.M. Wade, A. Scorpio, H. Zhang i inni. Mode of action of pyrazinamide: disruption of Mycobacterium tuberculosis membrane transport and energetics by pyrazinoic acid. „J Antimicrob Chemother”. 52 (5), s. 790–795, Nov 2003. DOI: 10.1093/jac/dkg446. PMID: 14563891.
- ↑ a b Y. Zhang, A. Scorpio, H. Nikaido, Z. Sun. Role of acid pH and deficient efflux of pyrazinoic acid in unique susceptibility of Mycobacterium tuberculosis to pyrazinamide. „J Bacteriol”. 181 (7), s. 2044–2049, Apr 1999. PMID: 10094680.
- ↑ Y. Zhang, S. Permar, Z. Sun. Conditions that may affect the results of susceptibility testing of Mycobacterium tuberculosis to pyrazinamide. „J Med Microbiol”. 51 (1), s. 42–49, Jan 2002. PMID: 11800471.
- ↑ I. Toida. Effect of pyrazinamide on nicotinamide adenine dinucleotide glycohydrolase of tuberculous host. „Am Rev Respir Dis”. 107 (4), s. 648–655, Apr 1973. PMID: 4348945.
- ↑ Structure Summary, 3GBC, 80790. [dostęp 2010-04-23].
- ↑ a b O. Zimhony, J.S. Cox, J.T. Welch, C. Vilcheze i inni. Pyrazinamide inhibits the eukaryotic-like fatty acid synthetase I (FASI) of Mycobacterium tuberculosis. „Nat Med”. 6 (9), s. 1043–1047, Sep 2000. DOI: 10.1038/79558. PMID: 10973326.
- ↑ H.I. Boshoff, V. Mizrahi. Purification, gene cloning, targeted knockout, overexpression, and biochemical characterization of the major pyrazinamidase from Mycobacterium smegmatis. „J Bacteriol”. 180 (22), s. 5809–5814, Nov 1998. PMID: 9811635.
- ↑ H.I. Boshoff, V. Mizrahi. Expression of Mycobacterium smegmatis pyrazinamidase in Mycobacterium tuberculosis confers hypersensitivity to pyrazinamide and related amides. „J Bacteriol”. 182 (19), s. 5479–5485, Oct 2000. PMID: 10986252.
- ↑ K. Ichida, M. Hosoyamada, I. Hisatome, A. Enomoto i inni. Clinical and molecular analysis of patients with renal hypouricemia in Japan-influence of URAT1 gene on urinary urate excretion. „J Am Soc Nephrol”. 15 (1), s. 164–173, Jan 2004. PMID: 14694169.
- ↑ K. Fuursted. Comparison of growth and susceptibility testing of pyrazinamide in different Bactec media using strains of the M. tuberculosis complex. „APMIS”. 101 (2), s. 154–159, Feb 1993. PMID: 8489766.
- ↑ R. Bonicke. Present status of methods for the routine differentiation of various species of Mycobacterium. „Ann Soc Belg Med Trop (1920)”. 42, s. 403–439, Aug 1962. PMID: 13968795.
- ↑ K.D. Stottmeier, R.E. Beam, G.P. Kubica. Determination of drug susceptibility of mycobacteria to pyrazinamide in 7H10 agar. „Am Rev Respir Dis”. 96 (5), s. 1072–1075, Nov 1967. PMID: 4964643.
- ↑ L. Heifets. Susceptibility testing of Mycobacterium tuberculosis to pyrazinamide. „J Med Microbiol”. 51 (1), s. 11–12, Jan 2002. PMID: 11800467.
- ↑ a b Z. Sun, A. Scorpio, Y. Zhang. The pncA gene from naturally pyrazinamide-resistant Mycobacterium avium encodes pyrazinamidase and confers pyrazinamide susceptibility to resistant M. tuberculosis complex organisms. „Microbiology”. 143 (Pt 10), s. 3367–3373, Oct 1997. PMID: 9353938.
- ↑ L.B. Heifets, P.J. Lindholm-Levy. Is pyrazinamide bactericidal against Mycobacterium tuberculosis?. „Am Rev Respir Dis”. 141 (1), s. 250–252, Jan 1990. PMID: 2105072.
- ↑ J.M. Dickinson, D.A. Mitchison. Observations in vitro on the suitability of pyrazinamide for intermittent chemotherapy of tuberculosis. „Tubercle”. 51 (4), s. 389–396, Dec 1970. PMID: 4992755.
- ↑ N. Mor, A. Esfandiari. Synergistic activities of clarithromycin and pyrazinamide against Mycobacterium tuberculosis in human macrophages. „Antimicrob Agents Chemother”. 41 (9), s. 2035–2036, Sep 1997. PMID: 9303411.
- ↑ A. Scorpio, P. Lindholm-Levy, L. Heifets, R. Gilman i inni. Characterization of pncA mutations in pyrazinamide-resistant Mycobacterium tuberculosis. „Antimicrob Agents Chemother”. 41 (3), s. 540–543, Mar 1997. PMID: 9055989.
- ↑ A. Scorpio, Y. Zhang. Mutations in pncA, a gene encoding pyrazinamidase/nicotinamidase, cause resistance to the antituberculous drug pyrazinamide in tubercle bacillus. „Nat Med”. 2 (6), s. 662–667, Jun 1996. PMID: 8640557.
- ↑ a b Ruben S. Vardanyan: Synthesis of essential drugs. Amsterdam: Elsevier, 2006, s. 527–528. ISBN 978-0-444-52166-8.
- ↑ G.L. Treece, C.R. Magnussen, J.R. Patterson, D.P. Tschudy. Exacerbation of porphyria during treatment of pulmonary tuberculosis. „Am Rev Respir Dis”. 113 (2), s. 233–237, Feb 1976. PMID: 1247237.
- ↑ a b c M. le Bourgeois, J. de Blic, J. Paupe, P. Scheinmann. Good tolerance of pyrazinamide in children with pulmonary tuberculosis. „Arch Dis Child”. 64 (1), s. 177–178, Jan 1989. PMID: 2923471.
- ↑ T.F. Yü, J. Perel, L. Berger, J. Roboz i inni. The effect of the interaction of pyrazinamide and probenecid on urinary uric acid excretion in man. „Am J Med”. 63 (5), s. 723–728, Nov 1977. PMID: 930947.
- ↑ C. Lacroix, C. Guyonnaud, M. Chaou, H. Duwoos i inni. Interaction between allopurinol and pyrazinamide. „Eur Respir J”. 1 (9), s. 807–811, Oct 1988. PMID: 3229478.
- ↑ L.A. Jiménez del Cerro, F. Rivera Hernández. Effect of pyrazinamide on ciclosporin levels. „Nephron”. 62 (1), s. 113, 1992. PMID: 1436277.
- ↑ C.A. Peloquin, A.T. Nitta, W.J. Burman, K.F. Brudney i inni. Low antituberculosis drug concentrations in patients with AIDS. „Ann Pharmacother”. 30 (9), s. 919–925, Sep 1996. PMID: 8876848.
- ↑ T. Papastavros, L.R. Dolovich, A. Holbrook, L. Whitehead i inni. Adverse events associated with pyrazinamide and levofloxacin in the treatment of latent multidrug-resistant tuberculosis. „CMAJ”. 167 (2), s. 131–136, Jul 2002. PMID: 12160118.
- ↑ H.X. Lou, M.A. Shullo, T.P. McKaveney. Limited tolerability of levofloxacin and pyrazinamide for multidrug-resistant tuberculosis prophylaxis in a solid organ transplant population. „Pharmacotherapy”. 22 (6), s. 701–704, Jun 2002. PMID: 12066961.
- ↑ D.J. Girling. The role of pyrazinamide in primary chemotherapy for pulmonary tuberculosis. „Tubercle”. 65 (1), s. 1–4, Mar 1984. PMID: 6428014.
- ↑ a b D.L. Combs, R.J. O’Brien, L.J. Geiter. USPHS Tuberculosis Short-Course Chemotherapy Trial 21: effectiveness, toxicity, and acceptability. The report of final results. „Ann Intern Med”. 112 (6), s. 397–406, Mar 1990. PMID: 2155569.
- ↑ G.A. Ellard, R.M. Haslam. Observations on the reduction of the renal elimination of urate in man caused by the administration of pyrazinamide. „Tubercle”. 57 (2), s. 97–103, Jun 1976. PMID: 960228.
- ↑ T.P. Rao, J.K. Schmitt. Gout secondary to pyrazinamide and ethambutol. „Va Med Q”. 123 (4), s. 271, 1996. PMID: 8909152.
- ↑ E.J. Forget, D. Menzies. Adverse reactions to first-line antituberculosis drugs. „Expert Opin Drug Saf”. 5 (2), s. 231–249, Mar 2006. DOI: 10.1517/14740338.5.2.231. PMID: 16503745.
- ↑ R.A. Sharp, J.G. Lowe, R.N. Johnston. Anti-tuberculous drugs and sideroblastic anaemia. „Br J Clin Pract”. 44 (12), s. 706–707, Dec 1990. PMID: 2102203.
- ↑ R.K. MacCurdy, E.R. Simon. Thrombocytopenia and sideroblastic anemia with pyrazinoic acid amide (pyrazinamide) therapy. „Chest”. 57 (4), s. 378–381, Apr 1970. PMID: 5434719.
- ↑ D. Perdu, F. Lavaud, A. Prévost, F. Deschamps i inni. Erythema multiforme due to pyrazinamide. „Allergy”. 51 (5), s. 340–342, May 1996. PMID: 8836340.
- ↑ J. Jorgensen. Pellagra probably due to pyrazinamide: development during combined chemotherapy of tuberculosis. „Int J Dermatol”. 22 (1). s. 44–45. PMID: 6832880.
- ↑ J. Goldberg, F. Moreno, J. Barbara. Acute hypertension as an adverse effect of pyrazinamide. „JAMA”. 277 (17), s. 1356, May 1997. PMID: 9134939.
- ↑ P. R, R. Garg, S.K. Verma. Isoniazid- and ethambutol-induced psychosis. „Ann Thorac Med”. 3 (4), s. 149–151, Oct 2008. DOI: 10.4103/1817-1737.43083. PMID: 19561898.
- ↑ Charakterystyka Produktu Leczniczego Pyrazinamid (pol.). [dostęp 2010-04-18].
- ↑ API TB Consensus Guidelines 2006: Management of pulmonary tuberculosis, extra-pulmonary tuberculosis and tuberculosis in special situations. „J Assoc Physicians India”. 54, s. 219–234, Mar 2006. PMID: 16800350.
- ↑ G.H. Malik, A.S. Al-Harbi, S. Al-Mohaya, H. Al-Khawajah i inni. Eleven years of experience with dialysis associated tuberculosis. „Clin Nephrol”. 58 (5), s. 356–362, Nov 2002. PMID: 12425486.
- ↑ C.M. Nolan, R.E. Sandblom, K.E. Thummel, J.T. Slattery i inni. Hepatotoxicity associated with acetaminophen usage in patients receiving multiple drug therapy for tuberculosis. „Chest”. 105 (2), s. 408–411, Feb 1994. PMID: 7508362.
Bibliografia
- Farmakologia. Podstawy farmakoterapii. Podręcznik dla studentów medycyny i lekarzy. Wojciech Kostowski, Zbigniew S. Herman (red.). T. II. Warszawa: Wydawnictwo Lekarskie PZWL, 2008, s. 352–353. ISBN 978-83-200-3725-8.
- Sean C. Sweetman: Martindale: The Complete Drug Reference, 36th Edition. Pharmaceutical Press, s. 320–321. ISBN 978-0-85369-840-1.
- Indeks leków Medycyny Praktycznej 2009. Kraków: Wydawnictwo Medycyna Praktyczna, 2009. ISBN 978-83-7430-221-0.; Pyrazinamid Farmapol, Medycyna praktyczna dla lekarzy [dostęp 2018-11-18].
- Jan Kazimierz Podlewski, Alicja Chwalibogowska-Podlewska, Robert Adamowicz: Leki współczesnej terapii. Warszawa: Split Trading, 2005, s. 543–544. ISBN 83-85632-82-4.
- Pyrazinamid Farmapol. Charakterystyka produktu leczniczego, www.farmapol.pl.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
| ||||||||||||||||||||||||
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Struktura pirazynamidazy u M. tuberculosis
Mechanizm działania pirazynamidu
Synteza chemiczna pirazynamidu