Pląsawica Huntingtona
| chorea chronica hereditaria progressiva | |
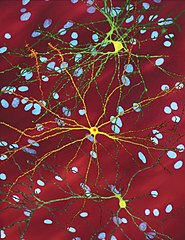 Neurony prążkowia z wtrętami huntingtyny | |
| ICD-10 | G10 |
|---|---|
| DiseasesDB | 6060 |
| OMIM | 143100 |
| MedlinePlus | 000770 |
| MeSH | D006816 |
Pląsawica Huntingtona lub choroba Huntingtona (łac. chorea chronica hereditaria progressiva, ang. Huntington's disease, chorea progressiva maior, HD) – choroba genetyczna ośrodkowego układu nerwowego objawiająca się zaburzeniami ruchowymi, zaburzeniami psychicznymi oraz otępieniem. Pląsawica Huntingtona ma przebieg postępujący. Początek zazwyczaj objawia się między 30. a 50. rokiem życia. Choroba występuje rodzinnie i dziedziczona jest autosomalnie dominująco. Wśród osób pochodzenia europejskiego występuje z częstością od 4 do 15 na 100000.
Historia
Nazwa choroby pochodzi od nazwiska amerykańskiego lekarza George'a Huntingtona, który dokładnie opisał ją w 1872[1]. Choroba znana była jednak wielu innym lekarzom przed Huntingtonem. Norweski lekarz Johan Christian Lund w 1860 roku przedstawił opis przypadków pląsawicy wśród mieszkańców wioski Setesdal w południowo-zachodniej Norwegii[2]. W Norwegii pląsawica Huntingtona do dziś znana jest także jako setesdalsrykkja.
Epidemiologia
Choroba ujawnia się w późnym wieku (na ogół u osób w wieku 30 - 50 lat). Młodzieńcza odmiana choroby (postać Westphala) dotyczy ludzi przed 20. rokiem życia. Od momentu rozpoznania średni czas przeżycia wynosi 15-20 lat[3]. Częstość występowania choroby Huntingtona szacuje się na 4-15:100000[4].
Etiologia
Przyczyną choroby jest mutacja w genie IT15 (huntingtin) kodującym białko huntingtynę, położonym na krótkim ramieniu chromosomu 4. Choroba dziedziczona jest w sposób autosomalny dominujący. Oznacza to, że statystycznie połowa potomstwa chorego na pląsawicę odziedziczy zmutowany allel powodujący chorobę. Zmutowany allel genu utrzymuje się w populacji ze względu na późne wystąpienie objawów choroby. Około 10% przypadków spowodowanych jest mutacją de novo[4]
Mutacja polega na ekspansji trójki nukleotydowej CAG (kodon oznaczający aminokwas glutaminę). Powoduje to, że w sekwencji aminokwasowej huntingtyny pojawia się długi ciąg glutamin. Jeśli powtórzeń trójki CAG jest więcej niż 35, mutacja staje się niestabilna i przy kolejnych podziałach komórkowych liczba powtórzeń się zwiększa. W związku z tym w kolejnych pokoleniach ciąg glutamin w białku jest coraz dłuższy, a co za tym idzie, objawy choroby pojawiają się wcześniej i są silniejsze. Takie zjawisko nazywa się antycypacją. W chorobie Huntingtona ekspansja trójnukleotydów jest znacząco większa przy przekazaniu mutacji od ojca.
Nieprawidłowe białko gromadzi się w komórkach nerwowych, powodując ich śmierć. Przypuszcza się, że neurotoksyczność zmutowanej huntingtyny wiąże się z dysfunkcją mitochondriów, jednak dokładny mechanizm patogenezy nie jest znany. Zmiany dotyczą przede wszystkim jądra ogoniastego, skorupy i kory mózgowej.
Rozpoznanie
Diagnozy dokonuje się na podstawie objawów klinicznych. W badaniach obrazowych (TK i MRI) stwierdza się poszerzenie układu komorowego mózgowia, z charakterystycznym obrazem komór bocznych, mających kształt „skrzydeł motyla”.
Badania genetyczne mogą dać odpowiedź, czy pacjent ma zmutowany allel genu, także zanim wystąpią objawy choroby. Możliwe są również genetyczne badania prenatalne.
Diagnostyka preimplantacyjna
Diagnostyka preimplantacyjna (PGD) pozwala wykryć mutację jeszcze przed implantacją zarodka w jamie macicy. W przypadku obecności mutacji, można zrezygnować z implantacji zarodka obciążonego tą jednostką chorobową[5].
Różnicowanie
Diagnostyka różnicowa pląsawicy Huntingtona obejmuje:
- inne choroby uwarunkowane genetycznie, takie jak:
- neuroakantocytoza
- choroba Wilsona
- typ 17 ataksji rdzeniowo-móżdzkowej
- choroba podobna do pląsawicy Huntingtona (HDL2);
- wtórne ruchy pląsawicze
- zakażenia i choroby autoimmunologiczne:
- działanie niepożądane leków (lewodopa, cholinolityki)
- zaburzenia metaboliczne i endokrynologiczne (m.in. pląsawica ciężarnych)
- choroby naczyniowe - objawy podobne do pląsawicy (hemibalizm, balizm) może dać np. udar niedokrwienny w okolicy jądra niskowzgórzowego.
Objawy i przebieg
Do objawów choroby Huntingtona należą:
- niekontrolowane ruchy (ruchy pląsawicze)
- pojawienie się drżenia rąk i nóg
- zmniejszenie napięcia mięśni (nie dotyczy postaci młodzieńczej, w której napięcie mięśni jest wzmożone)
- postępujące zaburzenia pamięci, otępienie
- zmiany osobowości
- drażliwość (38-73%)[6]
- apatia (34-76%)[6]
- lęk (34-61%)[6]
- obniżony nastrój (33-69%)[6]
- obsesje i kompulsje (10-52%)[6]
- objawy psychotyczne (omamy, urojenia) (3-11%)[6]
Przebieg jest powolny i postępujący. Z czasem pojawiają się zaburzenia mowy i połykania, a chory staje się uzależniony od pomocy innych ludzi. Zachłystowe zapalenie płuc spowodowane zaburzeniami połykania jest pierwszą przyczyną śmierci pacjentów z HD, odpowiadając za 85% zgonów[3]. W 9% przypadków przyczyną śmierci jest samobójstwo[7].
Leczenie
Jak na razie nie ma skutecznych metod leczenia tej choroby. Stosuje się jednak leczenie objawowe mające na celu złagodzenie zaburzeń ruchowych, objawów psychotycznych czy depresyjnych. W 2008 roku FDA zgodziła się na rejestrację tetrabenazyny w chorobie Huntingtona[7].
Przypisy
- ↑ Huntington G.. On Chorea. „Medical and Surgical Reporter of Philadelphia”. 26 (15), s. 317-321, 1872.
- ↑ J.C. Lund: Chorea Sti Viti i Saetersdalen. Uddrag af Distriktslæge J.C. Lunds Medicinalberetning for 1860. Beretning om Sundhedstilstanden m.m. i Norge i 1860, 137-138 (1860).
- ↑ a b Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom I. Andrzej Szczeklik (red.), Jerzy Alkiewicz, Kraków: Wydawnictwo Medycyna Praktyczna, 2005, ISBN 83-7430-031-0, OCLC 830805120.
- ↑ a b P. Dayalu, R.L. Albin. Huntington disease: pathogenesis and treatment. „Neurol Clin”. 33 (1), s. 101-114, 2015. DOI: 10.1016/j.ncl.2014.09.003. PMID: 25432725.
- ↑ ESHRE: Guidelines for FISH-based PGD. [dostęp 2021-04-25]. [zarchiwizowane z tego adresu (2012-04-02)].
- ↑ a b c d e f E. van Duijn, E.M. Kingma, R.C. van der Mast. Psychopathology in verified Huntington's disease gene carriers.. „J Neuropsychiatry Clin Neurosci”. 19 (4), s. 441-448, 2007. DOI: 10.1176/jnp.2007.19.4.441. PMID: 18070848.
- ↑ a b S. Frank. Treatment of Huntington's disease. „Neurotherapeutics”. 11 (1), s. 153-160, 2014. DOI: 10.1007/s13311-013-0244-z. PMID: 24366610.
Bibliografia
- Andrzej Szczeklik (red.): Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom II. Wydawnictwo Medycyna Praktyczna, 2005, s. 1939-1940. ISBN 83-7430-031-0.
- Neurologia. Podręcznik dla studentów medycyny. Wojciech Kozubski, Paweł P. Liberski (red.). Warszawa: Wydawnictwo Lekarskie PZWL, 2006, s. 254-255. ISBN 83-200-3244-X.
- Stwardnienie zanikowe boczne. W: Irena Hausmanowa-Petrusewicz, Janina Rafałowska: Choroby układu nerwowego. Wojciech Kozubski, Paweł P. Liberski (red.). Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 363-364. ISBN 83-200-2636-9.
- Elena Cattaneo, Dorotea Rigamonti, Chiara Zuccato. Zagadka pląsawicy Huntingtona. „Świat Nauki”. 2, s. 42-47, 2003.
Linki zewnętrzne
- HUNTINGTON DISEASE; HD w bazie Online Mendelian Inheritance in Man (ang.)
- Polskie Stowarzyszenie Choroby Huntingtona (pol.)
- Stanford University - A guide to the science of Huntington's disease
- Huntington's chorea w bazie Who Named It (ang.)
- HDBuzz - Wiadomości naukowe o chorobie Huntingtona, prostym językiem, napisane przez naukowców (pol.)
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Frank Gaillard, Licencja: CC BY-SA 3.0
Coronal FSPGR through the brain at the level of the caudate nuclei demonstrating marked reduced volume in keeping with the patient's known diagnosis of Huntington Disease. Image from Radiopaedia.org case here
Autor: Dr. Steven Finkbeiner, Gladstone Institute of Neurological Disease, The Taube-Koret Center for Huntington's Disease Research, and the University of California San Francisco, Licencja: CC BY 3.0
A montage of three images of single striatal neurons transfected with a disease-associated version of huntingtin, the protein that causes Huntington's disease. Nuclei of untransfected neurons are seen in the background (blue). The neuron in the center (yellow) contains an abnormal intracellular accumulation of huntingtin called an inclusion body (orange). Studies using an automated microscope and survival analysis demonstrated that neurons with disease-associated huntingtin that form inclusion bodies survive longer than those that do not, from press release [1], Attribution 'Dr. Steven Finkbeiner, Gladstone Institute of Neurological Disease, The Taube-Koret Center for Huntington's Disease Research, and the University of California San Francisco'



