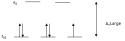
Przejście d-d
Przejście d-d – szczególny rodzaj przejścia elektronowego, w którym elektron przeskakuje z jednego poziomu d na inny, wyżej położony poziom d. Przejścia te zachodzą tylko dla kompleksów metali przejściowych.
Charakterystyka przejść
Orbital d jest pięciokrotnie zdegenerowany, w polu o symetrii kulistej. Jednak w polach o innych symetriach ma inną degenerację. W polu oktaedrycznym (najbardziej charakterystycznym dla kompleksów), orbital d dzieli się na dwa poziomy: jeden trójkrotnie zdegenerowany (niższa energia; typ symetrii T2g) i jeden dwukrotnie zdegenerowany (wyższa energia; typ symetrii Eg). Wielkość rozszczepienia orbitalu d określa parametr Δ. Zgodnie z zakazem Pauliego, na orbitalu d, może się zmieścić 10 elektronów. Kompleksy składają się z atomu centralnego i otaczających go ligandów. Zatem atom centralny mający od 1 do 9 elektronów, może wykazywać przejścia d-d.
W kompleksach oktaedrycznych, które mają trzy lub mniej elektronów, orbital d będzie obsadzony tylko na poziomie T2g. Jednak, gdy atom centralny posiada od 4 do 7 elektronów, to elektrony powinny być obsadzone w myśl reguły Hunda. Aczkolwiek nie zawsze tak się dzieje. Jeśli rozszczepienie poziomów T2g i Eg jest małe, to korzystniej energetycznie będzie, jeśli elektron znajdzie się na wyższym poziomie. Taką konfigurację nazywa się wysokospinową (high spin; HS). Jeżeli natomiast rozszczepienie poziomów T2g i Eg jest zbyt duże, to elektron znajdzie się na niższym poziomie, z przeciwnym spinem i sparuje jeden elektron. Taka konfiguracja nosi nazwę niskospinowej (low spin; LS). Konfiguracja zależy od rodzaju ligandów, jakie tworzą kompleks.
Konfiguracje od d1 do d9, stwarzają możliwość przejść elektronowych, poprzez pochłonięcie fotonu o częstości ν=Δ, które mają swoje odwzorowanie w widmie UV-Vis. Przejścia d-d są spinowo wzbronione dla kompleksów oktaedrycznych. Wynika to z reguły Laporte'a, która mówi, że przejścia parzyste (g→g) i nieparzyste (u→u) są niedozwolone. Taki rodzaj przejść występuje w kompleksach ze środkiem symetrii, np. w oktaedrycznych. Jednak dzięki obniżeniu symetrii i domieszkach przejść g→u, przejścia d-d następują i pasma są widoczne w widmie. Ich molowy współczynnik absorpcji – εmax jest rzędu 10. Dla symetrii tetraedrycznej, nie obowiązuje reguła Laporte'a, więc przejścia d-d są dozwolone – εmax rzędu 100-1000. W niektórych przypadkach przejść d-d, następuje zmiana liczby niesparowanych elektronów, co jest niezgodne z regułą wyboru, mówiącą o stałej multipletowości:
ΔS = 0
Reguła ta jest jednak naruszana dzięki sprzężeniu spinowo-orbitalnemu. Pasma absorpcji są wówczas bardzo słabe. Moc oscylatora jest rzędu 10-7, a εmax rzędu 0,1-1.
W widmach elektronowych, pasma są widoczne w zakresie od bliskiego ultrafioletu, do światła widzialnego.
Zobacz też
- Przejście CT
Bibliografia
- Zbigniew Kęcki: Podstawy spektroskopii molekularnej. Wyd. 3. Warszawa: Wydawnictwo Naukowe PWN, 1992, s. 193-196. ISBN 83-01-10503-8.
- Walenty Szczepaniak: Metody instrumentalne w analizie chemicznej. Wyd. 5. Warszawa: Wydawnictwo naukowe PWN, 2008, s. 67-69. ISBN 978-83-01-14210-0.
Media użyte na tej stronie
Showing the excitation of an electron to an unoccuoied higher energy d-orbital.
Autor: Offnfopt, reference image created by YanA, Licencja: CC0
High spin complex crystal field diagram
Low spin complex crystal field diagram
Autor: Ptjackyll, Licencja: CC0
Rozszczepienie orbitalu d w polu oktaedrycznym i tetraedrycznym