Przeszczepienie szpiku kostnego
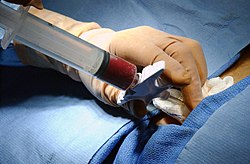
Przeszczepienie szpiku kostnego – zabieg polegający na podaniu pacjentowi preparatu zawierającego komórki macierzyste krwiotworzenia, które są w stanie odtworzyć układ krwiotwórczy pacjenta, który uległ poważnemu uszkodzeniu w czasie wcześniejszej chemioterapii lub radioterapii (przeszczepienie autogeniczne) albo zastąpić patologiczną hematopoezę chorego (np. w przebiegu białaczki) szpikiem osoby zdrowej (przeszczepienie allogeniczne).
Pod potocznym pojęciem „przeszczep szpiku” mieści się także przetoczenie macierzystych komórek hematopoetycznych wyizolowanych z krwi obwodowej, w czasie zabiegu zwanego leukaferezą, po ich wcześniejszym pobudzeniu (tak zwanej mobilizacji) z użyciem cytokin lub cytostatyków.
Przeszczepienie szpiku niekoniecznie musi być poprzedzone mieloablacją, czyli całkowitym zniszczeniem hematopoezy biorcy za pomocą chemioterapii lub radioterapii. Istnieje procedura zwana niemieloablacyjnym przeszczepieniem szpiku (ang. non-myeloablative stem cell transplantation, NST) lub przeszczepieniem szpiku z minimalnym kondycjonowaniem (miniallotransplantacja), w czasie której stosuje się jedynie odpowiednio silne leczenie immunosupresyjne (zapobiegające odrzuceniu przeszczepu), a za zniszczenie układu krwiotwórczego biorcy odpowiadają przeszczepione limfocyty dawcy.
Rodzaje procedur przeszczepienia
W zależności od źródła komórek
- przeszczepienie szpiku kostnego
- przeszczepienie komórek macierzystych izolowanych z krwi obwodowej
- przeszczepienie komórek macierzystych izolowanych z krwi pępowinowej
W zależności od dawcy materiału
- Przeszczepienie autogeniczne – polega na podaniu własnych komórek macierzystych z krwi obwodowej lub szpiku, pobranych od pacjenta przed zastosowaniem leczenia, które ma działanie mieloablacyjne (lub submieloablacyjne). Tego typu przeszczepy są generalnie bezpieczniejsze (nie ma choroby przeszczep przeciw gospodarzowi), można więc je wykonywać u pacjentów starszych (do 65 roku życia). Ze względu na ryzyko zanieczyszczenia przeszczepianego szpiku komórkami nowotworowymi oraz brak korzystnej reakcji przeszczep przeciw białaczce (graft versus leukemia – GvL), wyniki leczenia tą metodą białaczek i innych nowotworów hematologicznych są nieco gorsze niż dla przeszczepień allogenicznych. W ramach programów badawczych prowadzone są próby oczyszczania preparatów komórkowych z resztkowej populacji komórek nowotworowych. Można tego dokonywać na dwa sposoby: selekcji pozytywnej komórek macierzystych (najczęściej z wykorzystaniem przeciwciał monoklonalnych wobec antygenu CD34 za pomocą immunoabsorbcji magnetycznej) lub selekcji negatywnej, wykorzystującej różne metody eliminowania z preparatu komórkowego komórek nowotworowych (na przykład zastosowanie cytotoksycznych przeciwciał monoklonalych przeciw antygenom specyficznym dla komórek nowotworowych).
- Przeszczepienie syngeniczne (izogeniczne) – przeszczepienie szpiku lub komórek macierzystych z krwi obwodowej od bliźniaka homozygotycznego (jednojajowego). Nie występuje reakcja przeszczep przeciwko białaczce ani choroba przeszczep przeciw gospodarzowi.
- Przeszczepienie allogeniczne – przeszczep pochodzi od osoby niebędącej bliźniakiem homozygotycznym w stosunku do biorcy.
- od dawcy rodzinnego – w praktyce możliwe jest przeszczepienie szpiku jedynie od rodzeństwa, gdyż tylko wtedy występuje szansa na odpowiednią zgodność antygenów zgodności tkankowej (MHC). Przeszczepy od innych członków rodziny (rodziców, dzieci, innych krewnych) w praktyce możliwe są jedynie w małych zamkniętych populacjach, posiadających ujednoliconą pulę genową wskutek długotrwałego krzyżowania się osobników spokrewnionych. Najczęściej wystarcza zgodność w zakresie antygenów HLA-A, HLA-B (MHC klasa I) i HLA-DR (MHC klasa II). Oznacza to, że dawca i biorca muszą być zgodni w zakresie 6 alleli (dwie kopie każdego z wymienionych genów). Niekiedy, przy braku innego dawcy, dopuszcza się niezgodność w obrębie jednego allelu (tzw. mismatched familly donor).
- od dawcy niespokrewnionego – tego typu przeszczepienia wykonuje się w przypadku braku zgodnego dawcy rodzinnego. Dawcy niespokrewnionego szuka się w krajowych i zagranicznych bankach szpiku, które de facto są jedynie bazami danych zawierającymi informacje o potencjalnych dawcach i ich antygenach HLA. Proces wyszukiwania dawcy jest długotrwały i kosztowny, gdyż banki dysponują jedynie profilami antygenowymi uzyskanymi metodami o „małej rozdzielczości” i wstępnie wyznaczeni kandydaci na dawców wymagają dobadania. W Polsce za wyszukiwanie dawców niespokrewnionych odpowiada Poltransplant.
W zależności od zastosowanego leczenia przed przeszczepieniem (kondycjonowania)
- Przeszczepienie mieloablacyjne – poprzedzony terapią (chemioterapią lub radioterapią) która ma na celu zniszczenie resztkowej choroby nowotworowej (zabicie wszystkich komórek nowotworowych), ale „przy okazji” niszczy całkowicie układ krwiotwórczy biorcy. Przeszczepienie szpiku (autogeniczne lub allogeniczne) jest przede wszystkim potrzebne do tego, aby pacjent mógł przeżyć procedurę. Ze względu na toksyczność stosowanych w tym wskazaniu schematów chemioterapii (lub radioterapii) takie przeszczepy przeprowadza się jedynie u pacjentów młodszych (do 50 roku życia).
- Przeszczepienie niemieloablacyjne (poprzedzone „zredukowanym” kondycjonowaniem, NST) – podana chemioterapia (lub radioterapia) nie niszczy komórek nowotworowych ani układu krwiotwórczego biorcy. Jej zadaniem jest jedynie spowodowanie głębokiej immunosupresji, która uniemożliwia odrzucenie przeszczepu. Za „zniszczenie” układu krwiotwórczego biorcy i resztkowej choroby nowotworowej odpowiadają limfocyty T dawcy zawarte w przeszczepianym materiale. Ta metoda może być więc stosowana jedynie w przeszczepieniach allogenicznych. Pacjent przechodzi przez okres „chimeryzmu częściowego”, kiedy jego układ krwiotwórczy składa się z dwóch populacji komórek – własnych i pochodzących od dawcy. Dopiero osiągnięcie etapu „chimeryzmu całkowitego”, kiedy cała hematopoeza pochodzi od komórek macierzystych dawcy, oznacza przyjęcie się przeszczepu. Dopiero wówczas rozwija się również reakcja przeszczep przeciw białaczce albo reakcja przeszczep przeciw guzowi (graft versus tumour – GvT), która polega na tym, że pochodzące od dawcy limfocyty T eliminują resztkowe komórki nowotworowe. Celem wzmocnienia tej reakcji i przyspieszenia osiągnięcia całkowitego chimeryzmu, pacjentowi po przeszczepie podaje się infuzje limfocytów dawcy (donor lymphocyte infusion – DLI). Ze względu na mniej agresywne kondycjonowanie przeszczepy niemieloablacyjne mogą być wykonywanie u pacjentów nieco starszych (nawet do 65–70 roku życia). Ryzyko związane z chemioterapią i radioterapią jest mniejsze, jednak ryzyko choroby przeszczep przeciwko gospodarzowi takie samo, lub nawet wyższe (przy zastosowaniu DLI), jak przy tradycyjnym przeszczepieniu allogenicznym – dlatego nazywanie tej metody leczenia „miniallotransplantacją” jest błędne.
Wskazania do przeszczepienia
- Choroby nowotworowe:
- ostra białaczka szpikowa w pierwszej remisji (przeszczepienie allogeniczne u chorych z wysokim ryzykiem i autogeniczne u chorych z ryzykiem standardowym), kolejne remisje (przeszczepienie allogeniczne)
- ostra białaczka limfoblastyczna w pierwszej remisji (przeszczepienie autogeniczne u chorych z wysokim ryzykiem i allogeniczny u chorych z bardzo wysokim ryzykiem), kolejne remisje (przeszczepienie allogeniczne)
- przewlekła białaczka szpikowa jako element leczenia pierwszej linii (pierwsza faza przewlekła) u młodszych pacjentów (tylko allogeniczne)
- chłoniak Hodgkina nawrotowy lub oporny na leczenie (tylko autogeniczne)
- chłoniaki nieziarnicze o agresywnym przebiegu (np. DLBCL) w wypadku wznowy lub oporności na leczenie (przeszczepienie autogeniczne)
- szpiczak mnogi jako element leczenia pierwszej linii u młodych pacjentów (przeszczepienie autogeniczne)
- zespoły mielodysplastyczne (tylko przeszczepienie allogeniczne)
- guzy zarodkowe oporne na leczenie lub nawrotowe (tylko przeszczepienie autogeniczne)
- Inne wskazania hematologiczne (tylko przeszczepienie allogeniczne):
- ciężka postać anemii aplastycznej
- nocna napadowa hemoglobinuria
- mielofibroza (samoistne zwłóknienie szpiku)
- talasemia
- ciężka postać niedokrwistości sierpowatokrwinkowej
- Niektóre choroby autoimmunologiczne (przeszczepienie autogeniczne)
- Niektóre wady wrodzone (przeszczepienie allogeniczne)
Historia
Pierwsze syngeniczne przeszczepienie szpiku kostnego (u dziecka z anemią aplastyczną) wykonała w 1983 roku w Poznaniu Urszula Radwańska (ze współpracownikami)[1]. Pierwszego udanego allogenicznego przeszczepienia szpiku w Polsce dokonali Cezary Szczylik i Wiesław Jędrzejczak z Centralnego Szpitala Klinicznego Wojskowej Akademii Medycznej (obecnie Wojskowy Instytut Medyczny) w 1984 roku. W następnym roku ten sam zespół lekarzy przeprowadził pierwsze w Polsce autogeniczne przeszczepienie szpiku[2][3]. W 1997 roku Jerzy Hołowiecki w Katedrze i Klinice Hematologii i Transplantacji Szpiku w Katowicach dokonał pierwszego przeszczepu szpiku od dawcy niespokrewnionego[4].
Przypisy
- ↑ Przeszczepianie krwiotwórczych komórek macierzystych jako problem interdyscyplinarny.
- ↑ Joanna Sobiak, Przeszczepianie narządów i komórek krwiotwórczych – rys historyczny, „Nowiny Lekarskie”, 80, 2, 2011, s. 157–161 [zarchiwizowane z adresu 2015-01-04].
- ↑ Krystyna Bochenek, Dariusz Kortko Dobry zawód, wydanie I, 2006 rok, ISBN 83-240-0684-2.
- ↑ Mija 10 lat od pierwszego w Polsce przeszczepu szpiku od niespokrewnionego dawcy. PAP. [dostęp 2014-03-01]. [zarchiwizowane z tego adresu (2014-07-06)].
Bibliografia
- Anna Dmoszyńska (red.), Tadeusz Robak (red.): Podstawy hematologii. Lublin 2003, ISBN 83-88063-94-4.
- J. Apperley, E. Carreras, E. Gluckman, A Gratwohl, T. Masszi: Haemopoietic Stem Cell Transplantation. The EBMT Handbook. 2004 Revised Edition
- Jerzy Hołowiecki: Przeszczepianie szpiku i komórek krwiotwórczych z krwi obwodowej w nowotworach [W:] „Onkologia Kliniczna” pod red. M. Krzakowskiego, II wydanie rozszerzone, Warszawa, Borgis Wydawnictwo Medyczne, 2006, str. 271–329.
Linki zewnętrzne
- EBMT – the European group for Blood and Marrow Transplantation (ang.)
- Centralny Rejestr Niespokrewnionych Dawców Szpiku i Krwi Pępowinowej
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.A bone marrow harvest. Description from that page: 021204-N-0696M-180 Georgetown University Hospital, Washington, D.C. (Dec. 4, 2002) -- Surgeon Dr. Hans Janovich performs a bone marrow harvest operation on Aviation Electronics Technician 1st Class Michael Griffioen. The procedure consists of inserting a large-gauge syringe into an area of the hip and extracting the bone marrow. It is transfused into the recipient, and helps to recreate and replenish T-cells and the white and red blood cells killed while undergoing chemotherapy. Griffioen is assigned to the Pre-commissioning Unit Ronald Reagan (CVN 76) and was matched with an anonymous cancer patient through the Department of Defense Marrow Donor Program. U.S. Navy photo by Photographer’s Mate 2nd Class Chad McNeeley.

