Rak dróg żółciowych
| cholangiocarcinoma, carcinoma cholangiocellulare | |
 Rak dróg żółciowych w obrębie wątroby | |
| ICD-10 | C22 Nowotwór złośliwy wątroby i przewodów żółciowych wewnątrzwątrobowych |
|---|---|
| C22.1 | Rak przewodów żółciowych wewnątrzwątrobowych |
| ICD-10 | C24 Nowotwór złośliwy innych i nieokreślonych części dróg żółciowych |
| C24.0 | Drogi żółciowe zewnątrzwątrobowe |
| C24.1 | Brodawka większa dwunastnicy Vatera |
| C24.8 | Zmiana przekraczająca granice jednego umiejscowienia w obrębie dróg żółciowych |
| C24.9 | Drogi żółciowe, umiejscowienie nieokreślone |
Rak dróg żółciowych (łac. cholangiocarcinoma, carcinoma cholangiocellulare) – pierwotny nowotwór złośliwy pochodzenia nabłonkowego wywodzący się z błony śluzowej dróg żółciowych. Tradycyjnie wyróżnia się raka wewnątrzwątrobowych dróg żółciowych i raka zewnątrzwątrobowych dróg żółciowych, który może być dalej dzielony na postać wnękową i postać dystalną. Rak pęcherzyka żółciowego i rak brodawki Vatera ze względu na odmienności w zakresie etiologii, epidemiologii i leczenia są uznawane za osobne jednostki kliniczne.
Jest to stosunkowo rzadki nowotwór w krajach zachodnich i występuje on z częstością 1–2 zachorowań na 100 000 osób[1]. Czynnikami ryzyka tego raka są pierwotne stwardniające zapalenie dróg żółciowych, malformacje wątroby, zarażenia pasożytniczymi przywrami z gatunków Opisthorchis viverrini i Clonorchis sinensis oraz kontakt z thorotrastem (ditlenkiem toru), stosowanym niegdyś w diagnostyce radiologicznej. Objawami raka dróg żółciowych są żółtaczka, świąd skóry, ból i dyskomfort w brzuchu, utrata wagi, powiększenie wątroby i objaw Courvoisiera.
Kliniczne rozpoznanie choroby jest stawiane na podstawie badań obrazowych, a ostateczne rozpoznanie raka dróg żółciowych wymaga wykonanania badania histopatologicznego materiału uzyskanego drogą biopsji, wymazu szczoteczkowego lub preparatu pooperacyjnego. Radykalny onkologicznie zabieg chirurgiczny jest jedyną metodą pozwalającą na wyleczenie choroby. U części chorych po zabiegu można dołączyć adiuwantową chemioterapię, ale jej rola pozostaje nieustalona. W leczeniu choroby nieoperacyjnej i choroby z przerzutami wykorzystuje się chemioterapię opartą na pochodnych platyny, przede wszystkim na cisplatynie, w połączeniu z gemcytabiną.
Klasyfikacja
Raka dróg żółciowych (cholangiocarcinoma) tradycyjnie dzieli się na raka zewnątrzwątrobowych dróg żółciowych (raka z zewnątrzwątrobowych przewodów żółciowych, ang. extrahepatic cholangiocarcinoma, ECC) i raka wewnątrzwątrobowych dróg żółciowych (raka z wewnątrzwątrobowych przewodów żółciowych, ang. intrahepatic cholangiocarcinoma, ICC)[2].
Obecnie na podstawie lokalizacji nowotwór jest klasyfikowany[3][4][5][6]:
- rak wewnątrzwątrobowych dróg żółciowych,
- rak zewnątrzwątrobowych dróg żółciowych:
- górny, postać wnękowa (guz Klatskina),
- dolny, postać obwodowa.
Przewody żółciowe drugiego rzędu stanowią granicę pomiędzy rakiem wewnątrzwątrobowych dróg żółciowych a guzem Klatskina[5]. W definicji UICC granicę pomiędzy guzem Klatskina a rakiem zewnątrzwątrobowych dróg żółciowych wyznacza przewód pęcherzykowy[5][7]. Definicja WHO określa guz Klatskina jako guz wywodzący się z prawego lub lewego przewodu wątrobowego, ich połączenia albo najbliższej okolicy połączenia, nie obejmując okolicy ujścia przewodu pęcherzykowego[7].
Rak pęcherzyka żółciowego jest nowotworem złośliwym obejmującym pozawątrobową część dróg żółciowych, ale ze względu na odmienności etiologii, epidemiologii i leczenia rak pęcherzyka żółciowego jest uważany za osobną jednostkę kliniczną[6][8]. Rak brodawki Vatera z podobnych przyczyn również jest wydzielany jako osobna jednostka kliniczna[7].
Najczęstszą postacią jest postać wnękowa. Rak wewnątrzwątrobowych dróg żółciowych stanowi 8% przypadków choroby, 50% w obrębie wnęki wątroby (guz Klatskina), 42% rak zewnątrzwątrobowych dróg żółciowych[6][9].
Ze względu na lokalizację w stosunku do połączenia obu przewodów wątrobowych raki dróg żółciowych zostały podzielone na pięć typów (klasyfikacja Bismutha). Opracowano jeszcze bardziej złożone klasyfikacje, ale nie znajdują one większego zastosowania klinicznego[10].
| Typ | Opis |
| Typ I | Guz przewodu wątrobowego wspólnego lub żółciowego wspólnego nie dochodzący do miejsca połączenia prawego i lewego przewodu wątrobowego |
| Typ II | Guz dochodzący i wciągający miejsce połączenia prawego i lewego przewodu wątrobowego |
| Typ IIIa | Guz naciekający miejsce połączenia obu przewodów wątrobowych i wciągający prawy przewód wątrobowy |
| Typ IIIb | Guz naciekający miejsce połączenia obu przewodów wątrobowych i wciągający lewy przewód wątrobowy |
| Typ IV | Guz naciekający prawy i lewy przewód wątrobowy i miejsca połączenia drugorzędowych przewodów wewnątrzwątrobowych, postacie wieloogniskowe |
Objawy kliniczne
Początkowo przebieg choroby jest skryty i choroba przebiega bezobjawowo[12]. Występowanie objawów raka dróg żółciowych zwykle jest związane ze znacznym zaawansowaniem choroby[13]. Prezentowane objawy są niespecyficzne i zależą od lokalizacji guza[12][14].
Kluczowym objawem raka zewnątrzwątrobowych dróg żółciowych jest żółtaczka zaporowa (cholestatyczna) z odbarwieniem stolca i ściemnieniem moczu. Jest ona pierwszym objawem choroby u 90% chorych z rakiem zewnątrzwątrobowych dróg żółciowych[14][15]. Żółtaczka może mieć charakter narastający, początkowo pojawia się bez towarzyszących dolegliwości bólowych[15], choć u części chorych współwystępuje z nią ból brzucha[12].
Żółtaczce często towarzyszy świąd skóry, który występuje u 66% chorych[3][16][17]. U 10% chorych[13] w wyniku zablokowania przepływu żółci i kolonizacji bakteryjnej może dojść zapalenia dróg żółciowych objawiającym się wysoką gorączką, dreszczami, nudnościami, wymiotami i bólem brzucha[18][12].
Późnymi objawami choroby są ciągły ból brzucha, osłabienie, złe samopoczucie, utrata masy ciała, kacheksja, nudności, wymioty i wodobrzusze[15][19]. Ból i dyskomfort w brzuchu występuje u 30–50% chorych, typowo jest objawem nowotworu zlokalizowanego w wątrobie, pojawia w okolicy podżebrowej, najczęściej cechuje się tępym charakterem[3][13]. U 20% chorych występuje gorączka[3][16]. U 25–40% chorych w badaniu fizykalnym stwierdza się powiększenie wątroby, a u 10% chorych wyczuwalna obecność guza w jamie brzusznej[3]. Czasem bywa obecny objaw Courvoisiera polegający na stwierdzeniu w badaniu palpacyjnym powiększonego, niebolesnego pęcherzyka żółciowego, objaw pojawia się w przypadku lokalizacji guza poniżej ujścia przewodu pęcherzykowego[15][18]. Czasem u całkowicie bezobjawowych chorych na rozpoznanie choroby naprowadzają stwierdzone nieprawidłowe wyniki badań laboratoryjnych[12].
Czynniki ryzyka
Do czynników ryzyka zachorowania na raka dróg żółciowych należy:
- Infestacja (zakażenie) przywrami Clonorchis sinensis (Tajlandia, Laos, Malezja)[20][21], Opisthorchis viverrini (Japonia, Korea, Wietnam)[20][22].
- Wrodzone anomalie dróg żółciowych.
- Choroba Carolego i torbielowatość przewodów żółciowych (ryzyko rozwoju raka dróg żółciowych szacuje się na 15%, ale po radykalnym leczeniu chirurgicznym torbielowatości przed 20. rokiem życia ryzyko spada do ryzyka w populacji ogólnej[23][24]).
- Pierwotne stwardniające zapalenie dróg żółciowych (PSC); czynnikami zwiększającymi prawdopodobnie ryzyko raka dróg żółciowych u chorych z PSC są palenie papierosów, nadużywanie alkoholu oraz dysplazja lub rak jelita grubego w wywiadzie[25].
- Ekspozycja na substancje rakotwórcze występujące w środowisku: PCV, nitrozoaminy, toluen, pochodne benzenu, dioksyny.
- Palenie papierosów[26][27].
- Kamica dróg żółciowych, zwłaszcza wtórna do przewlekłych stanów zapalnych.
- Gruczolaki dróg żółciowych (ang. bile duct adenoma)[28].
- Brodawczakowatość przewodów żółciowych (ang. multiple biliary papillomatosis)[28].
- Niedobór alfa1-antytrypsyny[29].
- Wrzodziejące zapalenie jelita grubego[28][30].
- Infekcja HIV i AIDS[31][32][33].
- Donoszono o przypadkach cholangiocarcinoma u pacjentów z zespołem Lyncha II[34][35].
- Historycznie Thorotrast (radioaktywny środek kontrastujący stosowany w radiologii)[36].
Mimo to wiele przypadków raków dróg żółciowych występuje u pacjentów bez znanych czynników ryzyka[32].
Epidemiologia
| Kraj | IC (M/K) | EC (M/K) |
|---|---|---|
| USA | 0,60 / 0,43 | 0,70 / 0,87 |
| Japonia | 0,23 / 0,10 | 5,87 / 5,20 |
| Australia | 0,70 / 0,53 | 0,90 / 1,23 |
| Anglia i Walia | 0,83 / 0,63 | 0,43 / 0,60 |
| Szkocja | 1,17 / 1,00 | 0,60 / 0,73 |
| Francja | 0,27 / 0,20 | 1,20 / 1,37 |
| Włochy | 0,13 / 0,13 | 2,10 / 2,60 |

U ludzi rak dróg żółciowych jest stosunkowo rzadkim nowotworem. Szacuje się, że stanowi około 3% nowotworów układu pokarmowego[5], jest to drugi co do częstości nowotwór wątroby po raku wątrobowokomórkowym[38].
Zapadalność na chorobę rośnie z wiekiem, zwykle jest stwierdzany u osób po 65. roku życia[3][39][40]. Choroba rzadko występuje u chorych przed 40. rokiem życia[12]. Rak dróg żółciowych jest częstszy u mężczyzn niż u kobiet[41].
Zapadalność na raka dróg żółciowych u ludzi wykazuje znaczne zróżnicowanie geograficzne i waha się 0,2–96/100 000 u mężczyzn i 0,1–38/100 000 u kobiet[40]. Choroba najczęściej występuje w krajach wschodnioazjatyckich, a najwyższe ryzyko zachorowania występuje w północnej części Tajlandii, które jest niemal 100-krotnie większe niż w krajach zachodnich[38][42]. Wysokie ryzyko zachorowania dotyczy również Chin, Korei i Japonii[43][40].
Liczne badania dowodzą rosnącej zapadalności na ten nowotwór w ostatnich dekadach i tendencja wzrostowa jest zauważalna w krajach Ameryki Północnej, Europy, Azji oraz Australii[37][44][45][46][47][48]. Przyczyny tego zjawiska są niejasne. Być może częściowo przyczyną jest postęp w technikach badań obrazowych pozwalających na postawienie właściwego rozpoznania, aczkolwiek częstość niektórych czynników ryzyka, takich jak infekcje HIV, również wzrosła w tym przedziale czasowym[49].
W Polsce na 2011 roku na raka zewnątrzwątrobowych dróg żółciowych zachorowało 350 kobiet i 270 mężczyzn, co odpowiada zapadalności odpowiednio 0,8/100 000 i 0,9/100 000. Nie ma dokładnych danych dotyczących raka wewnątrzwątrobowych dróg żółciowych, szacuje się, że liczba zachorowań nie przekracza 200 przypadków rocznie u obu płci[50].
Histopatologia
Rak dróg żółciowych jest drugim pod względem częstości nowotworem złośliwym wątroby u ludzi i stanowi około 15% pierwotnych nowotworów złośliwych tego narządu, choć faktycznie różnice tego odsetka bardzo różnią się geograficznie i w pewnych regionach rak dróg żółciowych stanowi zdecydowaną większość nowotworów złośliwych wątroby u ludzi[51]. Najczęstszym typem histopatologicznym u ludzi jest gruczolakorak, zwykle o dobrym lub średnim zróżnicowaniu (niski G1 i pośredni G2 stopień złośliwości histologicznej[4][52]).
Rak wewnątrzwątrobowych dróg żółciowych
Rak może wywodzić się z każdej części wewnątrzwątrobowych dróg żółciowych. Makroskopowo tworzy kilka odmiennych typów wzrostu. Najczęstszy z nich występujący u około 65% chorych o typie masy(mass-forming type) makroskopowo tworzy szare, szarobiałe, twarde, dobrze odgraniczone, lite zmiany[53]. Rzadziej (6% przypadków) obserwuje się infiltrację wzdłuż naczyń wrotnych powodującą zwężenie zajętych dróg żółciowych i poszerzenie ich powyżej zmiany z zapaleniem dróg żółciowych (typ nacieku okołoprzewodowego, periductal infiltrating type). Rak rzadko (4% przypadków) może wzrastać wewnątrz dróg żółciowych, tworząc polipowatą lub brodawkowatą zmianę wewnątrz światła poszerzonego przewodu żółciowego (typ wzrostu wewnątrzprzewodowego, intraductal-growing type). Mieszany typ wzrostu (mixed pattern) jest drugim najczęściej obserwowanym wzorcem[54].
Rak wewnątrzwątrobowych dróg żółciowych wykazuje tendencję do szerzenia się przez naciekanie miąższu wątroby, a także struktury wrotne oraz wzdłuż dróg żółciowych[53]. Już na wczesnym etapie rozwoju choroby stwierdza się inwazję naczyń krwionośnych, co sugeruje wczesną obecność przerzutów.
W porównaniu do raka wątrobowokomórkowego częściej występują przerzuty do regionalnych węzłów chłonnych. Szerzenie się naczyniami krwionośnymi skutkuje powstawaniem przerzutów odległych, przede wszystkim do płuc, a także do kości, nadnerczy, nerek, śledziony i trzustki[53]. Rzadko stwierdza się intensywne rozprzestrzenianie się w wątrobie wzdłuż przewodów żółciowych[55].
- Gruczolakorak
Jest to najczęstszy podtyp histologiczny raka wewnątrzwątrobowych dróg żółciowych, wykazuje znaczną zmienność cech histologicznych i stopnia złośliwości. Na wczesnym etapie choroby częstym obrazem jest dość jednolity wzór rurowy, może być obecny wzór sznurowy i brodawkowaty. Komórki mogą być małe lub duże, sześcienne albo walcowate, ale również bywają pleomorficzne. Większość komórek posiada bladą, eozynofilną cytoplazmę, czasem komórki mogą posiadać obfitą zawartość cytoplazmy, przypominając komórki kubkowe[55].
Typowy jest obfity desmoplastyczny zrąb[56][55]. Komórki Ito (komórki gwieździste, komórki okołozatokowe) są włączone do utkania guza i produkując macierz pozakomórkową prowadzą do włóknienia wątroby. Zwykle centralna część guza jest mocno zwłókniała i ubogokomórkowa, podczas gdy w obwodowej części guza jest stwierdzana bardziej nasilona proliferacja komórek nowotworowych[55].
- Rak gruczołowo-płaskonabłonkowy i płaskonabłonkowy
Są to podtypy spotykane w zaawansowanych przypadkach raka dróg żółciowych. Rak gruczołowo-płaskonabłonkowy jest to początkowo „czysty” gruczolakorak zawierający istotną ilość elementu płaskonabłonkowego, a rak płaskonabłonkowy pojawia się w późniejszym etapie choroby i zawiera głównie komponent płaskonabłonkowy[57].
- Cholangiolocellular carcinoma
Jest to podtyp zbudowany z małych, regularnych struktur rurowych przypominające kanały Heringa[57].
- Rak śluzowy
Jest to nowotwór zawierający znaczną ilość mucyn, dominuje składnik pozakomórkowy w postaci śluzu. Komórki są rozdęte i zawierają znaczną ilość śluzu otoczone dużymi pozakomórkowymi polami śluzu[57].
- Rak sarkomatoidalny
Jest to podtyp, którego utkanie przypomina mięsaka wrzecionowatokomórkowego, włókniakomięsaka lub niezróżnicowanego mięsaka pleomorficznego. Nowotwór może cechować się bardziej agresywnym przebiegiem[57].
- Rak sygnetowatokomórkowy
Jest to bardzo rzadki podtyp zbudowany z rozdętych komórek z dużymi wodniczkami z mucynami[57].
- Rak śluzowo-naskórkowy
Jest to podtyp zbudowany z wyraźnie przerośniętych jasnych komórek o groniastym lub rurowym wzorze[57].
Rak zewnątrzwątrobowych dróg żółciowych
Rak zewnątrzwątrobowych dróg żółciowych jest klasyfikowany na typ guzkowy, polipowaty, włóknisty i rozlany. Typ guzkowy i włóknisty wykazują tendencję do szerokiego naciekania sąsiadujących tkanek[58]. Typ włóknisty charakteryzuje się intensywną reakcją desmoplastyczną[52]. Jest stwierdzany w 70% przypadków guza Klatskina, powoduje okrężne zwężenie przewodów żółciowych oraz szerzenie się podłużne i promieniście wokół przewodu żółciowego, wywołując zwłóknienie otaczających tkanek[59]. Typ guzkowy cechuje się obecnością twardego guzka wystającego z przewodu żółciowego. Typ brodawkowy stwierdza się u około 10% chorych, częściej występuje w dystalnej części przewodów żółciowych[59]. Wzrastając wewnątrz przewodów żółciowych, powoduje wczesne zablokowanie przepływu żółci i pojawienie się objawów choroby[52].
- Gruczolakorak (rak gruczołowy)
W zewnątrzwątrobowych drogach żółciowych najczęściej stwierdza się gruczolaki o dobrym i umiarkowanym zróżnicowaniu. Są zbudowane z długich lub krótkich cewkowych gruczołów utworzonych przez atypowe komórki nowotworowe o różnej wysokości: od sześciennych do walcowatych. W obrębie komórek i gruczołów obecne są mucyny. Około jedna trzecia dobrze zróżnicowanych gruczolaków wykazuje obecność ognisk różnicowania jelitowego zawierających komórki kubkowe i endokrynne[60].
Podtypami gruczolakoraka jest brodawkowaty rak gruczołowy, gruczolakorak śluzowy, gruczolakorak typu jelitowego, gruczolakorak typu dołeczków żołądkowych i gruczolakorak jasnokomórkowy[61].
- Rak sygnetowatokomórkowy
Jest to podtyp charakteryzujący się obecnością wewnątrzplazmatycznej mucyny przemieszczającej jądro komórkowe w kierunku obwodowym, zwykle jest obecna znaczna ilość zewnątrzkomórkowej mucyny[62].
- Rak gruczołowo-płaskonabłonkowy
Jest to nowotwór składający się z komponentu gruczołowego i płaskonabłonkowego, zwykle jest to nowotwór umiarkowanie zróżnicowany[63].
- Rak płaskonabłonkowy
Jest to nowotwór składający się wyłącznie z komponentu płaskonabłonkowego. W słabo zróżnicowanych guzach wrzecionowate komórki mogą być mylone z mięsakami[63].
- Rak niezróżnicowany
Typowa jest nieobecność struktur gruczołowych, wyróżnia się cztery warianty tego podtypu[63]:
- spindle and giant cell type,
- undifferentiated carcinoma with osteoclast-like giant cells,
- small cell type,
- nodular or lobular type.
Patogeneza
Komórka, z której wywodzi się rak przewodów żółciowych nie jest znana, choć badania wskazują na pluripotencjalną wątrobową komórkę macierzystą[64][65][66]. Prawdopodobnie rak przewodów żółciowych rozwija się etapami; od wczesnej hiperplazji i metaplazji, przez dysplazję, aż do raka inwazyjnego, podobnie jak to przebiega w przypadku raka jelita grubego[67]. Uważa się, że w progresji odgrywa znaczenie przewlekłe zapalenie oraz obstrukcja przewodów żółciowych[67][68][69].
Podobnie jak w przypadku innych nowotworów przewodu pokarmowego, za nowotworzenie w komórkach nabłonka dróg żółciowych odpowiada prawdopodobnie szereg mutacji w protoonkogenach i genach supresorowych, aczkolwiek komórkowe mechanizmy prowadzące do neoplazji w nabłonku przewodów żółciowych są stosunkowo słabo poznane. Donoszono o stwierdzeniu mutacji w onkogenach K-ras, c-myc, c-neu, c-erb, c-met i genach supresorowych TP53 i bcl-2 w komórkach nowotworów dróg żółciowych[70][71][72][73].
Historia naturalna
Rak dróg żółciowych jest wolno rosnącym nowotworem. Choroba rozwija się skrycie, głównym jej objawem jest żółtaczka[15]. Objaw może być wynikiem zewnętrznego ucisku dróg żółciowych przez guz albo wewnątrzprzewodowego typu wzrostu guza[15]. Postać wnękowa i obwodowa raka dróg żółciowych zwykle prowadzi do zablokowania ich światła. Zaleganie żółci sprzyja namnażaniu się flory bakteryjnej, co może doprowadzić do zapalenia dróg żółciowych[74][75].
Nowotwór miejscowo szerzy się za pomocą naczyń chłonnych i krwionośnych, wzdłuż nerwów i dróg żółciowych[52][76]. W wyniku miejscowego szerzenia dochodzi do zajęcia wątroby, trzustki, dwunastnicy, żołądka, jelita grubego i ważnych struktur naczyniowych, w tym żyły wrotnej oraz tętnicy wątrobowej wspólnej[77]. Zajęcie lokalnych węzłów chłonnych jest częste w raku dróg żółciowych. W raku wewnątrzwątrobowych dróg żółciowych przerzuty w lokalnych węzłach chłonnych są obserwowane w 50–60% przypadków choroby, zwykle pojawiają się w węzłach więzadła wątrobowo-dwunastniczego, okołoaortalnych, tylnej grupy węzłów trzustki i grupy tętnicy wątrobowej wspólnej. Zajęcie węzłów chłonnych w postaci wnękowej stwierdza się u około 50% chorych, najczęściej są to przerzuty do węzłów okołopęcherzykowych, węzłów wzdłuż żyły wrotnej, grupy węzłów tętnicy wątrobowej wspólnej i trzustkowo-dwunastniczych. Przerzuty węzłowe w postaci dystalnej są obserwowane u 55% chorych, są to głównie węzły trzustkowo-dwunastnicze, tętnicy wątrobowej wspólnej, więzadła wątrobowo-dwunastniczego i węzły okołoaortalne[52]. Zajęcie węzłów okołoaortalnych często jest związane z naciekiem miąższu trzustki[52]. Przerzuty odległe pojawiają się w chorobie zaawansowanej miejscowo[77]. Zwykle są stwierdzane w odległych węzłach chłonnych oraz płucach, rzadziej także w otrzewnej, kościach, nadnerczach i nerkach[78]. Chorzy umierają najczęściej w wyniku lokalnego szerzenia się nowotworu i niewydolności wątroby lub ropnego zapalenia dróg żółciowych[79].
Rozpoznanie
Kliniczne (radiologiczne) rozpoznanie choroby jest stawiane na podstawie badań obrazowych, w których podstawowe znaczenia ma tomografia komputerowa oraz rezonans magnetyczny. Ostateczne rozpoznanie choroby jest stawiane na podstawie badania histopatologicznego lub cytologicznego materiału pobranego w biopsji lub preparatu pooperacyjnego[80]. U chorych z operacyjnym guzem ostateczne rozpoznanie histopatologiczne nie jest konieczne do wdrożenia leczenia chirurgicznego, które wówczas jest stawiane na podstawie badań obrazowych (rozpoznanie kliniczne)[81].
Badania obrazowe
- Ultrasonografia
Badanie ultrasonograficzne (USG) jest często stosowane we wstępnej diagnostyce żółtaczki zaporowej[82][83]. Badanie może uwidocznić poszerzenie wewnątrzwątrobowych lub zewnątrwątrobowych dróg żółciowych, co w przypadku nieuwidocznienia kamieni żółciowych może sugerować obecność masy zwężającej ich światło[84]. W raku wewnątrzwątrobowych dróg żółciowym mogą być widoczne poszerzenia prawego lub lewego przewodu wątrobowego bez widocznej masy nowotworowej. Rzadziej może być widoczne guzowate, nieregularne zwężenia światła przewodu żółciowego lub polipowata masa. Guzy w zewnątrzwątrobowych drogach żółciowych, w tym we wnęce, są trudne do wykrycia w ultrasonografii[85].
- Tomografia komputerowa (TK)

Tomografia komputerowa może wykazać poszerzenie dróg żółciowych i masę nowotworową, pogrubienie ścian przewodu żółciowego lub wewnątrzprzewodową masę nowotworową[85]. Przed podaniem środka kontrastującego guz jest bardzo słabo widoczny. Guz jest słabo unaczyniony, dlatego nie ulega wzmocnieniu kontrastowemu, ale jest lepiej widoczny na tle dobrze unaczynionej wątroby[84]. Tomografia komputerowa służy do oceny zaawansowania choroby oraz operacyjności choroby, w tym do oceny zajęcia lokalnych węzłów chłonnych, obecności przerzutów odległych oraz zajęcia ważnych naczyń krwionośnych[84].
- Rezonans magnetyczny (MRI)
Rezonans magnetyczny, szczególnie cholangiografia rezonansu magnetycznego, jest rozważany jako badanie z wyboru w diagnostyce raka dróg żółciowych[85]. Metaanaliza wykazała, że MRI wykazuje wysoką, przekraczającą 90%, czułość i swoistość[85][86][87]. Badanie znajduje szczególne zastosowanie w ocenie lokalnego zaawansowania guza, zajęcia miąższu wątroby, lokalnych węzłów chłonnych i obecności przerzutów odległych[88].
- Pozytonowa tomografia emisyjna (PET)
Pozytonowa tomografia emisyjna znajduje zastosowanie w ocenie zaawansowania choroby w diagnostyce obecności przerzutów odległych[84].
Endoskopia

- Endoskopowa cholangiopankreatografia wsteczna (ERCP, ECPW)
Endoskopowa cholangiopankreatografia wsteczna jest pomocna w ustaleniu obecności i rodzaju przeszkody w drogach żółciowych, umożliwia pobranie wycinka lub wymazu szczoteczkowego, co może pozwolić na ustalenie rozpoznania histopatologicznego przed operacją[84][80]. Metoda umożliwia implantację stentów lub protez do dróg żółciowych pozwalających na odbarczenie dróg żółciowych i ustąpienie uciążliwego świądu i żółtaczki[85][89].
- Ultrasonografia endoskopowa (EUS)
Ultrasonografia endoskopowa jest stosowana głównie w celu wykonania celowanej biopsji cienkoigłowej podejrzanej zmiany w celu dostarczenia materiału do badania histopatologicznego i ustalenia rozpoznania histopatologicznego[88].
Laparoskopia
U części chorych do oceny zaawansowania choroby oraz operacyjności może być przydatna laparoskopia, która pozwala ponadto na pobranie wycinka do badania histopatologicznego[90][91].
Markery nowotworowe
W diagnostyce raka dróg żółciowy pewną rolę pełnią markery nowotworowe: CA 19-9, CA 125 i CEA. Markery nie są swoiste dla raka dróg żółciowych i ich podwyższone stężenia jest obserwowane w innych chorobach nowotworowych i nienowotworowych[4].
CA 19-9 ma największe znaczenie w diagnostyce raka dróg żółciowych[92]. Stężenie CA 19-9 jest podwyższone w ponad 75% przypadków raka dróg żółciowych[93]. Badanie daje fałszywie dodatnie wynik przy różnych chorobach dróg żółciowych[94]. Marker ma niekorzystne znaczenie rokownicze[95][96] i bywa używany w monitorowaniu skuteczności leczenia[95]. Podwyższone stężenie CA 125 obserwuje się u 40–50% chorych[97]. Marker może być przydatny w diagnostyce różnicowej nienowotworowych i nowotworowych przyczyn niedrożności dróg żółciowych[97]. Podwyższone stężenie CEA towarzyszy 30% przypadkom raka dróg żółciowych[4]. Czułość badania w różnych pracach wynosi 33–84%, a swoistość 33–100%[85]. Jednoczesna ocena stężenia CA 19-9 i CEA podwyższa skuteczność diagnostyczną badań[98].
Badania laboratoryjne
U chorych z rakiem dróg żółciowych często mogą być stwierdzane cechy cholestazy ze zwiększeniem stężenia fosfatazy alkalicznej (ALP, FA) gamma-glutamylotranspeptydazy (GTTP) oraz bilirubiny z przewagą bilirubiny sprzężonej[80][3]. Może być obecna podwyższona aktywność aminotransferazy asparaginianowej (ASPAT) i aminotransferazy alaninowej (ALAT)[3].
Leczenie
Leczenie choroby zlokalizowanej
- Leczenie raka wewnątrzwątrobowych dróg żółciowych
Rak wewnątrzwątrobowych dróg żółciowych wykazuje tendencje do tworzenia wewnątrzwątrobowych zmian satelitarnych[99]. Całkowita chirurgiczna resekcja zmiany z zachowaniem odpowiedniego marginesu chirurgicznego jest jedyną metodą pozwalającą na wyleczenie[100]. Jednak większość chorych ze względu na zaawansowanie choroby nie kwalifikuje się do leczenia zabiegowego[100]. Celem leczenia chirurgicznego jest usunięcie całego guza pierwotnego. Operacyjność i zakres operacji jest podyktowany względami anatomicznymi, które determinują techniczną możliwość wykonania zabiegu. Zwykle ze względu na znaczne zaawansowanie choroby i dużą masę guza konieczne jest wykonanie lobektomii (usunięcie płata wątroby)[101][102]. Występowanie wewnątrzwątrobowych zmian satelitarnych nie wyklucza możliwości leczenia radykalnego onkologicznie, o ile zmiany nie zajmują przeciwległego płata. Zajęcie obu płatów zwykle uniemożliwia leczenie radykalne, podobnie występowanie pozawątrobowych ognisk choroby zwykle stanowi przeciwwskazanie do radykalnego leczenia chirurgicznego[101]. Uzasadniona jest resekcja węzłów chłonnych wzdłuż żyły wrotnej (limfadenektomia), ponieważ umożliwia dokładną ocenę zaawansowania choroby[102], ale nie wykazano korzyści terapeutycznych z takiego postępowania[103][104][105][106].
- Niechirurgiczne leczenie miejscowe raka wewnątrzwątrobowych dróg żółciowych
W małych seriach badań oceniono skuteczność ablacji prądem o częstotliwości fal radiowych (ang. radiofrequency ablation, RFA)[107][108], przezcewnikowej chemioembolizacji tętniczej (ang. transcatheter arterial chemoembolisation, TACE)[109][110], TACE z wykorzystaniem cząstek opłaszczonych doksorubicyną (ang. drug-eluting bead TACE, DEB-TACE)[111][112][113], przeztętniczej radioembolizacji z 90Y (ang. transarterial radioembolization, TARE)[114][115][116][114] oraz chemioterapii podawanej do tętnicy wątrobowej[117][118][119].
W badaniu na 17 chorych stwierdzono, że leczenie za pomocą RFA wywoływało medianę przeżycia wolnego od progresji choroby (PFS) wynoszącą 32 miesiące i medianę przeżycia całkowitego (OS) 38,5 miesiąca[107]. W badaniu na 37 chorych z rakiem dróg żółciowych leczonych przezcewnikową chemioembolizacją tętniczą za pomocą cisplatyny, doksorubicyny albo mitomycyny C lub przezcewnikową embolizacją tętniczą za pomocą lipidolu albo alkoholu poliwinylowego stwierdzono przydatność metody w kontroli miejscowej choroby i zaobserwowano medianę czasu do progresji (TTP) wynoszącą 8 miesięcy i medianę przeżycia całkowitego 20 miesięcy[109]. W badaniu klinicznym wykazano, że DEB-TACE z użyciem irynotekanu wykazuje podobną skuteczność jak systemowa chemioterapia za pomocą gemcytabiny lub oksaliplatyny i wykazuje przewagę nad TACE z użyciem mitomycyny C. Mediana przeżycia całkowitego chorych leczonych DEB-TACE z zastosowaniem irynotekanu wynosiła 11 miesięcy, a leczonych ogólnoustrojową chemioterapią z użyciem gemcytabiny lub oksaliplatyny 11 miesięcy[111]. W innym małym badaniu stwierdzono przewagę DEB-TACE nad ogólnoustrojową chemioterapią z użyciem programu FOLFOX lub gemcytabiny[112]. W badaniu klinicznym na 17 chorych zaobserwowano martwicę przynajmniej połowy guza u 77% leczonych przeztętniczą radioembolizacją z 90Y oraz medianę przeżycia całkowitego wynoszącą 14,9 miesięcy[114].
- Rak zewnątrzwątrobowych dróg żółciowych
Leczenie chirurgiczne postaci wnękowej jest złożone i wymaga resekcji en block przynajmniej jednego płata wątroby, wycięcie fragmentu zewnątrzwątrobowych dróg żółciowych i limfadenektomii obejmującej okołowrotne węzły chłonnej[120]. Zazwyczaj konieczna jest rozszerzona prawostronna lub lewostronna hepatektomia[4]. Wybór typu zabiegu zależy od przewagi lokalizacji guza, prawostronna hemihepatektomia jest preferowana również przy guzach położonych centralnie[121]. Typowo zmiany typu I, II i IIIa według klasyfikacji Bismutha wymagają prawostronnej hepatektomii, a zmiany IIIb lewostronnej hepatektomii[122]. Prawostronna rozszerzona hemihepatektomia polega na usunięciu prawej połowy wątroby, dolnego fragmentu segmentu IV, tkanek wnęki wątroby oraz płata ogoniastego[4]. Lewostronna rozszerzona hemihepatektomia polega na usunięciu lewej części wątroby, tkanek wnęki wątroby i części płata ogoniastego[4][121]. Przeciwwskazaniami do operacji jest naciek drugorzędowych dróg żółciowych, zajęcie obu przewodów żółciowych, naciek lub zamknięcie pnia żyły wrotnej, obustronny naciek na odgałęzienia tętnicy wątrobowej lub żyły wrotnej, jednostronny naciek na odgałęzienie tętnicy wątrobowej z przeciwstronnym poszerzeniem przewodów żółciowych, zajęcie otrzewnej lub podejrzenie w badaniach obrazowych zajęcia węzłów chłonnych poza więzadłem wątrobowo-dwunastniczym[4][122]. Po radyklanej resekcji w postaci wnękowej obserwuje się 20–42% odsetek przeżyć pięcioletnich[121][123].
U wybranych chorych przeszczepienie wątroby jest metodą leczenia lokalnie zaawansowanej postaci wnękowej raka dróg żółciowych (bez zajęcia węzłów chłonnych i bez przerzutów odległych)[124]. Po przeszczepieniu wątroby z powodu raka dróg żółciowych obserwuje się 25–42% odsetek przeżyć pięcioletnich[124].
Operacyjne leczenie postaci dystalnej nieobejmującej prawego lub lewego przewodu wątrobowego, który często zajmuje wewnątrztrzustkową część dróg żółciowych polega na pankreatoduodektomii z usunięciem okołoaortalnych węzłów chłonnych. Bardzo rzadko guz występuje na ograniczonym obszarze dróg żółciowych, co pozwala na ich ograniczoną resekcję bez pankreatoduodenektomii[125]. Odsetek pięcioletniego przeżycia po operacji resekcji postaci dystalnej zewnątrzwątrobowych dróg żółciowych wynosi 16–52%[121][123].
Leczenie uzupełniające po zabiegu chirurgicznym
Rola adiuwantowej (uzupełniającej) chemioterapii w leczeniu raka dróg żółciowych jest nieustalona[124][126]. Może stanowić opcję dla leczenia chorych z granicznie resekowalnym guzem[126].
Zalecenia NCCN z rakiem wewnątrzwątrobowych dróg żółciowych proponują leczenie adiuwantowe w zależności od radykalności przeprowadzonej operacji[127]:
- w przypadku resekcji R0 chorzy mogą być wyłącznie obserwowani onkologicznie lub może być podana chemioterapia oparta na fluoropirymidynach (5-fluorouracyl, kapecytabina) lub gemcytabinie,
- w przypadku resekcji z mikroskopowym naciekiem raka (resekcja R1) lub zajęcia lokalnych węzłów chłonnych chorzy mogą być leczeni za pomocą chemioterapii opartej na cisplatynie, fluoropirymidynach lub gemcytabinie albo chemioradioterapii opartej na fluoropirymidynach,
- w przypadku resekcji z pozostawieniem choroby rezydualnej (resekcja R2) chorzy mogą być leczeni za pomocą chemioterapii opartej na fluoropirymidynach lub gemcytabinie albo chemioradioterapii opartej na fluoropirymidynach lub wykorzystuje się niechirurgiczne leczenie miejscowe.
Zalecenia NCCN u chorych z rakiem zewnątrzwątrobowych dróg żółciowych proponują leczenie adiuwantowe w zależności od radykalności przeprowadzonej operacji[128]:
- w przypadku resekcji R0 chorzy mogą być wyłącznie obserwowani onkologicznie lub może być podana chemioterapia oparta na fluoropirymidynach (5-fluorouracyl, kapecytabina) lub gemcytabinie albo leczeni chemioradioterapią opartą na fluoropirymidynach,
- w przypadku resekcji R1 i R2 lub zajęcia lokalnych węzłów chłonnych chorzy mogą być poddani chemioradioterapii opartej na fluoropirymidynach i następnie chemioterapii opartej na fluoropirymidynach lub gemcytabinie albo leczeni za pomocą samodzielnej chemioterapii opartej na fluoropirymidynach w przypadku zajęcia węzłów chłonnych.
W retorspektywnym przeglądzie oceniającym leczenie adiuwantowe 157 chorych z rakiem dróg żółciowych lub pęcherzyka żółciowego zaobserwowano, że leczenie nieznacząco statystycznie wydłuża przeżycie całkowite[129]. Również w przeglądzie statystycznym i metaaanalizie na 6712 chorych z rakiem dróg żółciowych lub pęcherzyka żółciowego stwierdzono nieistotnie statystycznie wydłużenie przeżycia całkowitego[130]. W badaniu III fazy u chorych z pozawątrobowym rakiem dróg żółciowych lub pęcherzyka żółciowego stwierdzono poprawę odsetka pięcioletnie przeżycia wolnego od choroby (DFS) u chorych z rakiem pęcherzyka żółciowego, nie zaobserwowano istotnych statystycznie korzyści z leczenia adiuwantowego u chorych z rakiem dróg żółciowych[131].
W retrospektywnym badaniu na 168 chorych z rakiem zewnątrzwątrobowych dróg żółciowych stwierdzono, że chemioradioterapia może poprawić lokalną kontrolę choroby i poprawić przeżycie całkowite w porównaniu do samodzielnego leczenia chirurgicznego[132]. Inne badania wskazują na korzyści z chemioradioterapii u chorych z wysokim ryzykiem nawrotu choroby: resekcji z mikroskopowym naciekiem raka (resekcja R1) oraz przerzutami w lokalnych węzłach chłonnych (cecha N+ klasyfikacji TNM)[133][134][135].
Leczenie choroby lokalnie zaawansowanej i przerzutowej
Chemioterapia jest jedyną metodą o udowodnionym wpływie na rokowanie u chorych z nieoperacyjnym, nawrotowym i przerzutowym rakiem dróg żółciowych[136]. Paliatywna chemioterapia powoduje wydłużenie przeżycia całkowitego i poprawę jakości życia chorych[137][138][139].
W zbiorczej analizie 104 badań na 2810 chorych stwierdzono, że chorzy otrzymujący kombinację gemcytabiny i pochodnej platyny (cisplatyna, oksaliplatyna) osiągają wyższe odsetki odpowiedzi obiektywnej i kontroli choroby[140].
Połączenie gemcytabiny z cisplatyną jest standardem leczenia nieoperacyjnego lub przerzutowego raka dróg żółciowych[141][142][143]. Pozostałe schematy oparte na gemcytabinie (gemcytabina z oksaliplatyną, gemcytabina z kapecytabiną, monoterapia gemcytabiną) lub fluoropirymidynach (kapecytabina z cisplatyną, kapecytabina z oksaliplatyną, 5-fluorouracyl z cisplatyną, 5-fluorouracyl z oksaliplatyną, monoterapia 5-fluorouracylem lub kapecytabiną) mają niższy stopień zaleceń (stopień 2A) ze względu na przeprowadzone wyłącznie badania II fazy[144]. U chorych z przeciwwskazaniami do leczenia cisplatyną stosuje się połączenie gemcytabiny z 5-fluorouracylem lub monoterapię gemcytabiną[143].
W badaniu na 410 chorych wykazano przewagę połączenia gemcytabiny z cisplatyną nad gemcytabiną stosowaną w monoterapii, chorzy leczeni połączeniem osiągnęli wyższe mediany przeżycia wolnego od progresji (PFS) i przeżycia całkowitego (OS) niż leczeniu gemcytabiną w monoterapii[145]. Podobne wyniki uzyskano w późniejszym badaniu japońskim[146]. W badaniu 40955 EORTC stwierdzono, że połączenie cisplatyny i 5-fluorouracylu wywoływało wyższy odsetek odpowiedzi i dłuższe przeżycie całkowite niż 5-fluorouracyl w wysokiej dawce[147]. W innym badaniu połączenie mitomycyny C z kapecytabiną wykazało przewagę nad połączeniem mitomycyny C z gemcytabiną, wywołując dłuższe przeżycie wolne od progresji choroby (PFS) i przeżycie całkowite (OS)[148].
Leczenie paliatywne
Celem leczenia paliatywnego jest poprawa jakości życia chorego oraz łagodzenie uciążliwych objawów choroby, szczególnie świądu, żółtaczki i bólu. Często konieczny jest drenaż dróg żółciowych umożliwiający zmniejszenie nasilenia żółtaczki i świądu. Zmniejszenie zalegania żółci w drogach żółciowych może być osiągnięte przez endoskopowe umieszczenie stentu do dróg żółciowych, poprzez drenaż przezskórny lub operacyjny. Ból jest leczony nieopioidowymi i opioidowymi lekami przeciwbólowymi[149].
Rokowanie
Generalnie w raku dróg żółciowych rokowanie jest bardzo złe, a przeżycie całkowite chorych jest stosunkowo krótkie[150][151][152]. U większości chorych rak jest rozpoznawany w stadium zaawansowanym, u 60% chorych raka dróg żółciowych stwierdza się w stadium IV i u 20% w stadium III[153]. Tylko u około 10% chorych może być wykonany radykalnie onkologicznie zabieg chirurgiczny[153]. Mediana przeżycia chorych od rozpoznania wynosi około 24 miesiące, a pięcioletnie przeżycie chorych nie przekracza 10%[5].
| Stadium kliniczne | Rak wewnątrzwątrobowych dróg żółciowych | Rak zewnątrzwątrobowych dróg żółciowych |
| Lokalne | 15 | 30 |
| Regionalne | 6 | 24 |
| Uogólnione | 2 | 2 |
Klasyfikacja TNM
Klasyfikacja TNM jest systemem oceny zaawansowania klinicznego nowotworu.
| Guz pierwotny – cecha T | |
| Tx | Nie można ocenić guza pierwotnego |
| T0 | Nie stwierdza się guza pierwotnego |
| Tis | Rak in situ (rak wewnątrzprzewodowy) |
| T1 | Pojedynczy guz nienaciekający naczyń (żyły wrotnej, co najmniej jednej żyły wątrobowej oraz dowolnego żylnego naczynia wewnątrzwątrobowego) |
| T2a | Pojedynczy guz naciekający naczynia |
| T2b | Kilka guzów nienaciekających lub naciekających naczynia |
| T3 | Guz przechodzący poza otrzewną trzewną lub bezpośrednio naciekający przez ciągłość okoliczne struktury pozawątrobowe |
| T4 | Guz naciekający okołoprzewodowo (wzrost guza w postaci rozlanego naciekania okołoprzewodowego wzdłuż przewodów wewnątrzwątrobowych) |
| Zajęcie okolicznych węzłów chłonnych – cecha N | |
| Nx | Nie można ocenić okolicznych węzłów chłonnych |
| N0 | Nie stwierdza się przerzutów w okolicznych węzłach chłonnych |
| N1 | Obecne są przerzuty w regionalnych węzłach chłonnych |
| Przerzuty odległe – cecha M | |
| Mx | Nie można określić obecności przerzutów odległych |
| M0 | Nie stwierdza się przerzutów odległych |
| M1 | Obecne przerzuty odległe |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M |
| 0 | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| III | T3 | N0 | M0 |
| IVa | T4 | N0 | M0 |
| dowolne T | N1 | M0 | |
| IVb | dowolne T | dowolne N | M1 |
| Guz pierwotny – cecha T | |
| Tx | Nie można ocenić guza pierwotnego |
| T0 | Nie stwierdza się guza pierwotnego |
| Tis | Rak in situ |
| T1 | Rak ograniczony do przewodu żółciowego, naciek nowotworu przechodzi do warstwy mięśniowej lub tkanki włóknistej |
| T2a | Rak penetruje poza ścianę dróg żółciowych do otaczającej tkanki tłuszczowej |
| T2b | Naciek przyległego miąższu wątroby |
| T3 | Jednostronny naciek gałęzi żyły wrotnej lub tętnicy wątrobowej |
| T4 | Naciek żył wrotnej lub obustronny naciek jej gałęzi, tętnicy wątrobowej wspólnej, obustronny naciek przewodów żółciowych drugiego rzędu, jednostronny naciek przewodów żółciowych drugiego rzędu z przeciwstronnym zajęciem żyły wrotnej czy tętnicy wątrobowej |
| Zajęcie okolicznych węzłów chłonnych – cecha N | |
| Nx | Nie można ocenić okolicznych węzłów chłonnych |
| N0 | Nie stwierdza się przerzutów w okolicznych węzłach chłonnych |
| N1 | Przerzuty w regionalnych węzłach chłonnych, w tym węzłów wzdłuż przewodu pęcherzykowego, przewodu żółciowego wspólnego, tętnicy wątrobowej i żyły wrotnej |
| N2 | Przerzuty w węzłach chłonnych okołoaortalnych, okolicy żyły głównej, tętnicy krezkowej górnej lub pnia trzewnego |
| Przerzuty odległe – cecha M | |
| Mx | Nie można określić obecności przerzutów odległych |
| M0 | Nie stwierdza się przerzutów odległych |
| M1 | Obecne przerzuty odległe |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M |
| 0 | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| II | T2a–T2b | N0 | M0 |
| IIIa | T3 | N0 | M0 |
| IIIb | T1–T3 | N1 | M0 |
| IVa | dowolne T | N0–N1 | M0 |
| IVb | dowolne T | N2 | M0 |
| dowolne T | dowolne N | M1 |
| Guz pierwotny – cecha T | |
| Tx | Nie można ocenić guza pierwotnego |
| T0 | Nie stwierdza się guza pierwotnego |
| Tis | Rak in situ |
| T1 | Rak histologicznie ograniczony do przewodu żółciowego |
| T2 | Rak przechodzi poza ścianę przewodu żółciowego. |
| T3 | Rak nacieka pęcherzyk żółciowy, trzustkę, dwunastnicę lub inne okoliczne narządy bez zajęcia pnia trzewnego ani tętnicy krezkowej górnej |
| T4 | Rak nacieka pień trzewny lub tętnicę krezkową górną |
| Zajęcie okolicznych węzłów chłonnych – cecha N | |
| Nx | Nie można ocenić okolicznych węzłów chłonnych |
| N0 | Nie stwierdza się przerzutów w regionalnych węzłach chłonnych |
| N1 | Przerzuty w regionalnych węzłach chłonnych |
| Przerzuty odległe – cecha M | |
| Mx | Nie można określić obecności przerzutów odległych |
| M0 | Nie stwierdza się przerzutów odległych |
| M1 | Obecne przerzuty odległe |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M |
| 0 | Tis | N0 | M0 |
| Ia | T1 | N0 | M0 |
| Ib | T2 | N0 | M0 |
| IIa | T3 | N0 | M0 |
| IIb | T1–T3 | N1 | M0 |
| III | T4 | każde N | M0 |
| IV | każde T | każde N | M1 |
Przypisy
- ↑ S.H. Landis, T. Murray, S. Bolden, P.A. Wingo. Cancer statistics, 1998. „CA Cancer J Clin”. 48 (1). s. 6–29. PMID: 9449931.
- ↑ Herman, Pawlik i Thomas, Jr. 2014 ↓, s. 2.
- ↑ a b c d e f g h Szczeklik i Gajewski 2014 ↓, s. 1044.
- ↑ a b c d e f g h Paweł Lampe, Beata Jabłońska. Chirurgiczne leczenie raka dróg żółciowych. „Postępy Nauk Medycznych”, 2011.
- ↑ a b c d e S. Rizvi, G.J. Gores. Pathogenesis, diagnosis, and management of cholangiocarcinoma. „Gastroenterology”. 145 (6), s. 1215–1229, Dec 2013. DOI: 10.1053/j.gastro.2013.10.013. PMID: 24140396.
- ↑ a b c DeVita, Lawrence i Rosenberg 2008 ↓, s. 1156.
- ↑ a b c B. Blechacz, M. Komuta, T. Roskams, G.J. Gores. Clinical diagnosis and staging of cholangiocarcinoma. „Nat Rev Gastroenterol Hepatol”. 8 (9), s. 512–522, Sep 2011. DOI: 10.1038/nrgastro.2011.131. PMID: 21808282.
- ↑ Herman, Pawlik i Thomas, Jr. 2014 ↓, s. 14.
- ↑ M.L. DeOliveira, S.C. Cunningham, J.L. Cameron, F. Kamangar i inni. Cholangiocarcinoma: thirty-one-year experience with 564 patients at a single institution. „Ann Surg”. 245 (5), s. 755–762, May 2007. DOI: 10.1097/01.sla.0000251366.62632.d3. PMID: 17457168.
- ↑ H.A. Pitt, W.C. Dooley, C.J. Yeo, J.L. Cameron. Malignancies of the biliary tree. „Curr Probl Surg”. 32 (1), s. 1–90, Jan 1995. PMID: 7528652.
- ↑ Bismuth H, Nakache R, Diamond T. Management strategies in resection for hilar cholangiocarcinoma. „Ann Surg”. 215, s. 31–38, 1992. PMID: 1309988.
- ↑ a b c d e f Price i Sikora 2014 ↓, s. 233.
- ↑ a b c B.R. Blechacz, G.J. Gores. Cholangiocarcinoma. „Clin Liver Dis”. 12 (1), s. 131-150, ix, Feb 2008. DOI: 10.1016/j.cld.2007.11.003. PMID: 18242501.
- ↑ a b Steven A.= Curley: Bile Duct Cancer. W: Donald W. Kufe, Raphael E. Pollock, Ralph R. Weichselbaum, Robert C. Bast, Ted S. Gansler: Holland-Frei Cancer Medicine, 6th edition. BC Decker, 2003. ISBN 1-55009-213-8.
- ↑ a b c d e f Grzegorz Ćwik, Witold Krupski, Andrzej Prystupa, Grzegorz Wallner. Rak przewodów żółciowych – możliwości terapeutyczne i ocena zaawansowania nowotworu w badaniach obrazowych. „Prz Gastroenterol”, 2013.
- ↑ a b DeVita, Lawrence i Rosenberg 2008 ↓, s. 1159.
- ↑ James S. Dooley, Anna Lok, Andrew K. Burroughs, Jenny Heathcote: Sherlock’s Diseases of the Liver and Biliary System. John Wiley & Sons, 2011, s. 297. ISBN 978-1-4443-4127-0.
- ↑ a b DeVita, Lawrence i Rosenberg 2008 ↓, s. 1160.
- ↑ Stephen T. Kee, David C. Madoff, Ravi Murthy: Clinical Interventional Oncology. Elsevier Health Sciences, 2013, s. 103. ISBN 978-1-4557-7564-4.
- ↑ a b c Sripa B, Kaewkes S, Sithithaworn P, Mairiang E, Laha T, Smout M, Pairojkul C, Bhudhisawasdi V, Tesana S, Thinkamrop B, Bethony JM, Loukas A, Brindley PJ. Liver Fluke Induces Cholangiocarcinoma. „PLoS Med”. 4. 7, s. e201, 2007. PMID: 17622191.
- ↑ Shin HR, Lee CU, Park HJ, et al. Hepatitis B and C virus, Clonorchis sinensis for the risk of liver cancer: a case-control study in Pusan, Korea. „Int J Epidemiol”. 25, s. 933–940, 1996.
- ↑ Watanapa P. Cholangiocarcinoma in patients with opisthorchiasis. „Br J Surg”. 83, s. 1062–1064, 1996. PMID: 8869303.
- ↑ Lipsett P, Pitt H, Colombani P, Boitnott J, Cameron J. Choledochal cyst disease. A changing pattern of presentation. „Ann Surg”. 220. 5, s. 644–652, 1994. PMID: 7979612.
- ↑ Dayton M, Longmire W, Tompkins R. Caroli’s Disease: a premalignant condition?. „Am J Surg”. 145. 1, s. 41–48, 1983. PMID: 6295196.
- ↑ Szczeklik i Gajewski 2014 ↓, s. 1042.
- ↑ Chow WH, McLaughlin JK, Menck HR, Mack TM. Risk factors for extrahepatic bile duct cancers: Los Angeles County, California (USA). „Cancer Causes Control”. 5, s. 267–272, 1994. PMID: 8061176.
- ↑ Bergquist A, Glaumann H, Persson B, Broome U. Risk factors and clinical presentation of hepatobiliary carcinoma in patients with primary sclerosing cholangitis: a case-control study. „Hepatology”. 27, s. 311–316, 1998. PMID: 9462625.
- ↑ a b c Callea F, Sergi C, Fabbretti G, Brisigotti M, Cozzutto C, Medicina D. Precancerous lesions of the biliary tree. „J Surg Oncol Suppl”. 3, s. 131–133, 1993. PMID: 8389160.
- ↑ Zhou H, Ortiz-Pallardo ME, Ko Y, Fischer HP. Is heterozygous alpha-1-antitrypsin deficiency type PIZ a risk factor for primary liver carcinoma?. „Cancer”. 88. 12, s. 2668–2676, 2000. PMID: 10870048.
- ↑ Broome U, Olsson R, Loof L, et al. Natural history and prognostic factors in 305 Swedish patients with primary sclerosing cholangitis. „Gut”. 38, s. 610–615, 1996. PMID: 8707097.
- ↑ Hocqueloux L, Gervais A. Cholangiocarcinoma and AIDS-related sclerosing cholangitis. „Ann Intern Med”. 132. 12, s. 1006–1007, 2000. PMID: 10858162.
- ↑ a b de Groen PC, Gores GJ, LaRusso NF, Gunderson LL, Nagorney DM. Biliary tract cancers. „New England Journal of Medicine”. 341, s. 1368–1378, 1999. PMID: 10536130.
- ↑ Shaib Y, El-Serag H, Davila J, Morgan R, McGlynn K. Risk factors of intrahepatic cholangiocarcinoma in the United States: a case-control study. „Gastroenterology”. 128. 3, s. 620–626, 2005. PMID: 15765398.
- ↑ Mecklin JP, Jarvinen HJ, Virolainen M. The association between cholangiocarcinoma and hereditary nonpolyposis colorectal carcinoma. „Cancer”. 69. 5, s. 1112–1114, 1992. PMID: 1310886.
- ↑ Vernez M, Hutter P, Monnerat C, Halkic N, Gugerli O, Bouzourene H. A case of Muir-Torre syndrome associated with mucinous hepatic cholangiocarcinoma and a novel germline mutation of the MSH2 gene. „Fam Cancer”. 6. 1, s. 141–145, 2007. PMID: 17051350.
- ↑ Parkin DM, Ohshima H, Srivatanakul P, Vatanasapt V. Cholangiocarcinoma: epidemiology, mechanisms of carcinogenesis and prevention. „Cancer Epidemiol Biomarkers Prev”. 2. 6, s. 537–544, 1993. PMID: 826877.
- ↑ a b S.A. Khan, S.D. Taylor-Robinson, M.B. Toledano, A. Beck i inni. Changing international trends in mortality rates for liver, biliary and pancreatic tumours. „J Hepatol”. 37 (6), s. 806–813, Dec 2002. PMID: 12445422.
- ↑ a b S.A. Khan, M.B. Toledano, S.D. Taylor-Robinson. Epidemiology, risk factors, and pathogenesis of cholangiocarcinoma. „HPB (Oxford)”. 10 (2), s. 77–82, 2008. DOI: 10.1080/13651820801992641. PMID: 18773060.
- ↑ Y.A. Ghouri, I. Mian, B. Blechacz. Cancer review: Cholangiocarcinoma. „J Carcinog”. 14, s. 1, 2015. DOI: 10.4103/1477-3163.151940. PMID: 25788866.
- ↑ a b c Mark Feldman, Lawrence S. Friedman, Lawrence J. Brandt: Sleisenger and Fordtran’s Gastrointestinal and Liver Disease: Pathophysiology, Diagnosis, Management. Elsevier Health Sciences, 2015, s. 1614. ISBN 978-1-4557-4989-8.
- ↑ D.E. Henson, J. Albores-Saavedra, D. Corle. Carcinoma of the extrahepatic bile ducts. Histologic types, stage of disease, grade, and survival rates. „Cancer”. 70 (6), s. 1498–1501, Sep 1992. PMID: 1516001.
- ↑ H.R. Shin, J.K. Oh, E. Masuyer, M.P. Curado i inni. Epidemiology of cholangiocarcinoma: an update focusing on risk factors. „Cancer Sci”. 101 (3), s. 579–585, Mar 2010. DOI: 10.1111/j.1349-7006.2009.01458.x. PMID: 20085587.
- ↑ Maria Consiglia Bragazzi, Vincenzo Cardinale, Guido Carpino, Rosanna Venere i inni. Cholangiocarcinoma: Epidemiology and risk factors. „Transl Gastrointest Cancer”, 2012. DOI: 10.3978/j.issn.2224-4778.2011.11.04.
- ↑ T. Patel. Worldwide trends in mortality from biliary tract malignancies. „BMC Cancer”. 2, s. 10, May 2002. PMID: 11991810.
- ↑ T. Patel. Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States. „Hepatology”. 33 (6), s. 1353–1357, Jun 2001. DOI: 10.1053/jhep.2001.25087. PMID: 11391522.
- ↑ Y.H. Shaib, J.A. Davila, K. McGlynn, H.B. El-Serag. Rising incidence of intrahepatic cholangiocarcinoma in the United States: a true increase?. „J Hepatol”. 40 (3), s. 472–477, Mar 2004. DOI: 10.1016/j.jhep.2003.11.030. PMID: 15123362.
- ↑ J. West, H. Wood, R.F. Logan, M. Quinn i inni. Trends in the incidence of primary liver and biliary tract cancers in England and Wales 1971-2001. „Br J Cancer”. 94 (11), s. 1751–1758, Jun 2006. DOI: 10.1038/sj.bjc.6603127. PMID: 16736026.
- ↑ T.M. Welzel, K.A. McGlynn, A.W. Hsing, T.R. O’Brien i inni. Impact of classification of hilar cholangiocarcinomas (Klatskin tumors) on the incidence of intra- and extrahepatic cholangiocarcinoma in the United States. „J Natl Cancer Inst”. 98 (12), s. 873–875, Jun 2006. DOI: 10.1093/jnci/djj234. PMID: 16788161.
- ↑ Y.H. Shaib, H.B. El-Serag, J.A. Davila, R. Morgan i inni. Risk factors of intrahepatic cholangiocarcinoma in the United States: a case-control study. „Gastroenterology”. 128 (3), s. 620–626, Mar 2005. PMID: 15765398.
- ↑ Krzakowski i in. 2015 ↓, s. 606.
- ↑ Hamilton i Aaltonen 2000 ↓, s. 173.
- ↑ a b c d e f Edward C. Halperin, Luther W. Brady, David E. Wazer, Carlos A. Perez: Perez & Brady’s Principles and Practice of Radiation Oncology. Lippincott Williams & Wilkins, 2013, s. 1210. ISBN 978-1-4511-1648-9.
- ↑ a b c Hamilton i Aaltonen 2000 ↓, s. 175.
- ↑ Herman, Pawlik i Thomas, Jr. 2014 ↓, s. 59.
- ↑ a b c d Hamilton i Aaltonen 2000 ↓, s. 176.
- ↑ Herman, Pawlik i Thomas, Jr. 2014 ↓, s. 63.
- ↑ a b c d e f Hamilton i Aaltonen 2000 ↓, s. 177.
- ↑ Hamilton i Aaltonen 2000 ↓, s. 207.
- ↑ a b Alfred E. Chang, Patricia A. Ganz, Daniel F. Hayes, Timothy Kinsella, Harvey I. Pass, Joan H. Schiller, Richard M. Stone, Victor Strecher: Oncology: An Evidence-Based Approach. Springer Science & Business Media, 2007, s. 754. ISBN 978-0-387-31056-5.
- ↑ Hamilton i Aaltonen 2000 ↓, s. 207–208.
- ↑ Hamilton i Aaltonen 2000 ↓, s. 204.
- ↑ Hamilton i Aaltonen 2000 ↓, s. 208.
- ↑ a b c Hamilton i Aaltonen 2000 ↓, s. 209.
- ↑ Roskams T. Liver stem cells and their implication in hepatocellular and cholangiocarcinoma. „Oncogene”. 25 (27), s. 3818–3822, 2006. PMID: 16799623.
- ↑ Liu C, Wang J, Ou Q. Possible stem cell origin of human cholangiocarcinoma. „World J Gastroenterol”. 10 (22), s. 3374–3376, 2004. PMID: 15484322.
- ↑ Sell S, Dunsford H. Evidence for the stem cell origin of hepatocellular carcinoma and cholangiocarcinoma. „Am J Pathol”. 134 (6), s. 1347–1363, 1989. PMID: 2474256.
- ↑ a b Sirica A. Cholangiocarcinoma: molecular targeting strategies for chemoprevention and therapy. „Hepatology”. 41 (1), s. 5–15, 2005. PMID: 15690474.
- ↑ Holzinger F, Z’graggen K, Büchler M. Mechanisms of biliary carcinogenesis: a pathogenetic multi-stage cascade towards cholangiocarcinoma. „Ann Oncol”. 10 Suppl 4. s. 122–126. PMID: 10436802.
- ↑ Gores G. Cholangiocarcinoma: current concepts and insights. „Hepatology”. 37 (5), s. 961–969, 2003. PMID: 12717374.
- ↑ Suto T, Sugai T, Nakamura S, et al. Assessment of the expression of p53, MIB-1 (Ki-67 antigen), and argyrophilic nucleolar organizer regions in carcinoma of the extrahepatic bile duct. „Cancer”. 82, s. 86–95, 1998. PMID: 9428483.
- ↑ Terada T, Nakanuma Y, Sirica AE. Immunohistochemical demonstration of MET overexpression in human intrahepatic cholangiocarcinoma and in hepatolithiasis. „Hum Pathol”. 29, s. 175–180, 1998. PMID: 9490278.
- ↑ Rijken AM, van Gulik TM, Polak MM, Sturm PD, Gouma DJ, Offerhaus GJ. Diagnostic and prognostic value of incidence of K-ras codon 12 mutations in resected distal bile duct carcinoma. „J Surg Oncol”. 68, s. 187–192, 1998. PMID: 9701213.
- ↑ Voravud N, Foster CS, Gilbertson JA, Sikora K, Waxman J. Oncogene expression in cholangiocarcinoma and in normal hepatic development. „Hum Pathol”. 20, s. 1163–1168, 1989. PMID: 2574140.
- ↑ Pierre-Alain Clavien, John Baillie: Diseases of the Gallbladder and Bile Ducts: Diagnosis and Treatment. John Wiley & Sons, 2008, s. 333. ISBN 978-0-470-98697-4.
- ↑ Pierre-Alain Clavien: Malignant Liver Tumors: Current and Emerging Therapies. Jones & Bartlett Learning, 2004, s. 31. ISBN 978-0-7637-1857-2.
- ↑ Brian O’Sullivan, James Brierley, Anil D’Cruz, Martin Fey, Martin Fey, Raphael E. Pollock, Jan Vermorken, Shao Hui Huang: UICC Manual of Clinical Oncology. John Wiley & Sons, 2015, s. 265. ISBN 978-1-4443-3244-5.
- ↑ a b Neal C. Dalrymple, John R. Leyendecker, Michael Oliphant: Problem Solving in Abdominal Imaging. Elsevier Health Sciences, 2009, s. 227. ISBN 978-0-323-04353-3.
- ↑ Taofic Mounajjed, Vishal S. Chandan, Michael S. Torbenson: Surgical Pathology of Liver Tumors. Springer, 2015, s. 259. ISBN 978-3-319-16089-4.
- ↑ Pierre-Alain Clavien: Malignant Liver Tumors: Current and Emerging Therapies. Jones & Bartlett Learning, 2004, s. 32. ISBN 978-0-7637-1857-2.
- ↑ a b c Krzakowski i in. 2015 ↓, s. 607.
- ↑ Eckel, Brunner i Jelic 2011 ↓, s. 1.
- ↑ S. Saini. Imaging of the hepatobiliary tract. „N Engl J Med”. 336 (26), s. 1889–1894, Jun 1997. DOI: 10.1056/NEJM199706263362607. PMID: 9197218.
- ↑ M.P. Sharma, V. Ahuja. Aetiological spectrum of obstructive jaundice and diagnostic ability of ultrasonography: a clinician’s perspective. „Trop Gastroenterol”. 20 (4). s. 167–169. PMID: 10769604.
- ↑ a b c d e Szczeklik i Gajewski 2014 ↓, s. 1045.
- ↑ a b c d e f B.E. Van Beers. Diagnosis of cholangiocarcinoma. „HPB (Oxford)”. 10 (2), s. 87–93, 2008. DOI: 10.1080/13651820801992716. PMID: 18773062.
- ↑ J. Romagnuolo, M. Bardou, E. Rahme, L. Joseph i inni. Magnetic resonance cholangiopancreatography: a meta-analysis of test performance in suspected biliary disease. „Ann Intern Med”. 139 (7), s. 547–557, Oct 2003. PMID: 14530225.
- ↑ R. Materne, B.E. Van Beers, J.F. Gigot, J. Jamart i inni. Extrahepatic biliary obstruction: magnetic resonance imaging compared with endoscopic ultrasonography. „Endoscopy”. 32 (1), s. 3–9, Jan 2000. DOI: 10.1055/s-2000-86. PMID: 10691265.
- ↑ a b A. Weber, R.M. Schmid, C. Prinz. Diagnostic approaches for cholangiocarcinoma. „World J Gastroenterol”. 14 (26), s. 4131–4136, Jul 2008. PMID: 18636656.
- ↑ Szczeklik i Gajewski 2014 ↓, s. 1047.
- ↑ S.M. Weber, R.P. DeMatteo, Y. Fong, L.H. Blumgart i inni. Staging laparoscopy in patients with extrahepatic biliary carcinoma. Analysis of 100 patients. „Ann Surg”. 235 (3), s. 392–399, Mar 2002. PMID: 11882761.
- ↑ M.P. Callery, S.M. Strasberg, G.M. Doherty, N.J. Soper i inni. Staging laparoscopy with laparoscopic ultrasonography: optimizing resectability in hepatobiliary and pancreatic malignancy. „J Am Coll Surg”. 185 (1), s. 33–39, Jul 1997. PMID: 9208958.
- ↑ H. Malhi, G.J. Gores. Cholangiocarcinoma: modern advances in understanding a deadly old disease. „J Hepatol”. 45 (6), s. 856–867, Dec 2006. DOI: 10.1016/j.jhep.2006.09.001. PMID: 17030071.
- ↑ X.L. Qin, Z.R. Wang, J.S. Shi, M. Lu i inni. Utility of serum CA19-9 in diagnosis of cholangiocarcinoma: in comparison with CEA. „World J Gastroenterol”. 10 (3), s. 427–432, Feb 2004. PMID: 14760772.
- ↑ G. Malaguarnera, I. Paladina, M. Giordano, M. Malaguarnera i inni. Serum markers of intrahepatic cholangiocarcinoma. „Dis Markers”. 34 (4), s. 219–228, 2013. DOI: 10.3233/DMA-130964. PMID: 23396291.
- ↑ a b B. Juntermanns, S. Radunz, M. Heuer, S. Hertel i inni. Tumor markers as a diagnostic key for hilar cholangiocarcinoma. „Eur J Med Res”. 15 (8), s. 357–361, Aug 2010. PMID: 20947473.
- ↑ W.F. Shen, W. Zhong, F. Xu, T. Kan i inni. Clinicopathological and prognostic analysis of 429 patients with intrahepatic cholangiocarcinoma. „World J Gastroenterol”. 15 (47), s. 5976–5982, Dec 2009. PMID: 20014463.
- ↑ a b G. Malaguarnera, M. Giordano, I. Paladina, A. Rando i inni. Markers of bile duct tumors. „World J Gastrointest Oncol”. 3 (4), s. 49–59, Apr 2011. DOI: 10.4251/wjgo.v3.i4.49. PMID: 21528090.
- ↑ J.K. Ramage, A. Donaghy, J.M. Farrant, R. Iorns i inni. Serum tumor markers for the diagnosis of cholangiocarcinoma in primary sclerosing cholangitis. „Gastroenterology”. 108 (3), s. 865–869, Mar 1995. PMID: 7875490.
- ↑ DeVita, Lawrence i Rosenberg 2008 ↓, s. 1161.
- ↑ a b Benson i in. 2016 ↓, s. 70.
- ↑ a b DeVita, Lawrence i Rosenberg 2008 ↓, s. 1162.
- ↑ a b Benson i in. 2016 ↓, s. 71.
- ↑ M. Shimada, Y. Yamashita, S. Aishima, K. Shirabe i inni. Value of lymph node dissection during resection of intrahepatic cholangiocarcinoma. „Br J Surg”. 88 (11), s. 1463–1466, Nov 2001. DOI: 10.1046/j.0007-1323.2001.01879.x. PMID: 11683741.
- ↑ S.B. Choi, K.S. Kim, J.Y. Choi, S.W. Park i inni. The prognosis and survival outcome of intrahepatic cholangiocarcinoma following surgical resection: association of lymph node metastasis and lymph node dissection with survival. „Ann Surg Oncol”. 16 (11), s. 3048–3056, Nov 2009. DOI: 10.1245/s10434-009-0631-1. PMID: 19626372.
- ↑ C.J. Clark, C.M. Wood-Wentz, K.M. Reid-Lombardo, M.L. Kendrick i inni. Lymphadenectomy in the staging and treatment of intrahepatic cholangiocarcinoma: a population-based study using the National Cancer Institute SEER database. „HPB (Oxford)”. 13 (9), s. 612–620, Sep 2011. DOI: 10.1111/j.1477-2574.2011.00340.x. PMID: 21843261.
- ↑ Y. Morine, M. Shimada, T. Utsunomiya, S. Imura i inni. Clinical impact of lymph node dissection in surgery for peripheral-type intrahepatic cholangiocarcinoma. „Surg Today”. 42 (2), s. 147–151, Jan 2012. DOI: 10.1007/s00595-011-0057-9. PMID: 22124809.
- ↑ a b J.H. Kim, H.J. Won, Y.M. Shin, K.A. Kim i inni. Radiofrequency ablation for the treatment of primary intrahepatic cholangiocarcinoma. „AJR Am J Roentgenol”. 196 (2), s. W205-9, Feb 2011. DOI: 10.2214/AJR.10.4937. PMID: 21257864.
- ↑ G. Carrafiello, D. Laganà, E. Cotta, M. Mangini i inni. Radiofrequency ablation of intrahepatic cholangiocarcinoma: preliminary experience. „Cardiovasc Intervent Radiol”. 33 (4), s. 835–839, Aug 2010. DOI: 10.1007/s00270-010-9849-3. PMID: 20411389.
- ↑ a b M.V. Kiefer, M. Albert, M. McNally, M. Robertson i inni. Chemoembolization of intrahepatic cholangiocarcinoma with cisplatinum, doxorubicin, mitomycin C, ethiodol, and polyvinyl alcohol: a 2-center study. „Cancer”. 117 (7), s. 1498–1505, Apr 2011. DOI: 10.1002/cncr.25625. PMID: 21425151.
- ↑ O. Hyder, J.W. Marsh, R. Salem, E.N. Petre i inni. Intra-arterial therapy for advanced intrahepatic cholangiocarcinoma: a multi-institutional analysis. „Ann Surg Oncol”. 20 (12), s. 3779–3786, Nov 2013. DOI: 10.1245/s10434-013-3127-y. PMID: 23846786.
- ↑ a b J.B. Kuhlmann, W. Euringer, H.C. Spangenberg, M. Breidert i inni. Treatment of unresectable cholangiocarcinoma: conventional transarterial chemoembolization compared with drug eluting bead-transarterial chemoembolization and systemic chemotherapy. „Eur J Gastroenterol Hepatol”. 24 (4), s. 437–443, Apr 2012. DOI: 10.1097/MEG.0b013e3283502241. PMID: 22261548.
- ↑ a b S.C. Schiffman, T. Metzger, G. Dubel, T. Andrasina i inni. Precision hepatic arterial irinotecan therapy in the treatment of unresectable intrahepatic cholangiocellular carcinoma: optimal tolerance and prolonged overall survival. „Ann Surg Oncol”. 18 (2), s. 431–438, Feb 2011. DOI: 10.1245/s10434-010-1333-4. PMID: 20862554.
- ↑ G. Poggi, P. Quaretti, C. Minoia, G. Bernardo i inni. Transhepatic arterial chemoembolization with oxaliplatin-eluting microspheres (OEM-TACE) for unresectable hepatic tumors. „Anticancer Res”. 28 (6B). s. 3835–3842. PMID: 19192637.
- ↑ a b c S.M. Ibrahim, M.F. Mulcahy, R.J. Lewandowski, K.T. Sato i inni. Treatment of unresectable cholangiocarcinoma using yttrium-90 microspheres: results from a pilot study. „Cancer”. 113 (8), s. 2119–2128, Oct 2008. DOI: 10.1002/cncr.23818. PMID: 18759346.
- ↑ S. Mouli, K. Memon, T. Baker, A.B. Benson i inni. Yttrium-90 radioembolization for intrahepatic cholangiocarcinoma: safety, response, and survival analysis. „J Vasc Interv Radiol”. 24 (8), s. 1227–1234, Aug 2013. DOI: 10.1016/j.jvir.2013.02.031. PMID: 23602420.
- ↑ R.T. Hoffmann, P.M. Paprottka, A. Schön, F. Bamberg i inni. Transarterial hepatic yttrium-90 radioembolization in patients with unresectable intrahepatic cholangiocarcinoma: factors associated with prolonged survival. „Cardiovasc Intervent Radiol”. 35 (1), s. 105–116, Feb 2012. DOI: 10.1007/s00270-011-0142-x. PMID: 21431970.
- ↑ K. Shitara, I. Ikami, M. Munakata, O. Muto i inni. Hepatic arterial infusion of mitomycin C with degradable starch microspheres for unresectable intrahepatic cholangiocarcinoma. „Clin Oncol (R Coll Radiol)”. 20 (3), s. 241–246, Apr 2008. DOI: 10.1016/j.clon.2007.12.007. PMID: 18222071.
- ↑ Y. Inaba, Y. Arai, H. Yamaura, Y. Sato i inni. Phase I/II study of hepatic arterial infusion chemotherapy with gemcitabine in patients with unresectable intrahepatic cholangiocarcinoma (JIVROSG-0301). „Am J Clin Oncol”. 34 (1), s. 58–62, Feb 2011. DOI: 10.1097/COC.0b013e3181d2709a. PMID: 20177362.
- ↑ N.E. Kemeny, L. Schwartz, M. Gönen, A. Yopp i inni. Treating primary liver cancer with hepatic arterial infusion of floxuridine and dexamethasone: does the addition of systemic bevacizumab improve results?. „Oncology”. 80 (3–4), s. 153–159, 2011. DOI: 10.1159/000324704. PMID: 21677464.
- ↑ DeVita, Lawrence i Rosenberg 2008 ↓, s. 1163.
- ↑ a b c d N. Akamatsu, Y. Sugawara, D. Hashimoto. Surgical strategy for bile duct cancer: Advances and current limitations. „World J Clin Oncol”. 2 (2), s. 94–107, Feb 2011. DOI: 10.5306/wjco.v2.i2.94. PMID: 21603318.
- ↑ a b K.C. Soares, I. Kamel, D.P. Cosgrove, J.M. Herman i inni. Hilar cholangiocarcinoma: diagnosis, treatment options, and management. „Hepatobiliary Surg Nutr”. 3 (1), s. 18–34, Feb 2014. DOI: 10.3978/j.issn.2304-3881.2014.02.05. PMID: 24696835.
- ↑ a b Benson i in. 2016 ↓, s. 72.
- ↑ a b c Benson i in. 2016 ↓, s. 74.
- ↑ DeVita, Lawrence i Rosenberg 2008 ↓, s. 1163–1164.
- ↑ a b DeVita, Lawrence i Rosenberg 2008 ↓, s. 1165.
- ↑ Benson i in. 2016 ↓, s. 26.
- ↑ Benson i in. 2016 ↓, s. 29.
- ↑ E.S. Glazer, P. Liu, E.K. Abdalla, J.N. Vauthey i inni. Neither neoadjuvant nor adjuvant therapy increases survival after biliary tract cancer resection with wide negative margins. „J Gastrointest Surg”. 16 (9), s. 1666–1671, Sep 2012. DOI: 10.1007/s11605-012-1935-1. PMID: 22777053.
- ↑ A.M. Horgan, E. Amir, T. Walter, J.J. Knox. Adjuvant therapy in the treatment of biliary tract cancer: a systematic review and meta-analysis. „J Clin Oncol”. 30 (16), s. 1934–1940, Jun 2012. DOI: 10.1200/JCO.2011.40.5381. PMID: 22529261.
- ↑ T. Takada, H. Amano, H. Yasuda, Y. Nimura i inni. Is postoperative adjuvant chemotherapy useful for gallbladder carcinoma? A phase III multicenter prospective randomized controlled trial in patients with resected pancreaticobiliary carcinoma. „Cancer”. 95 (8), s. 1685–1695, Oct 2002. DOI: 10.1002/cncr.10831. PMID: 12365016.
- ↑ T.H. Kim, S.S. Han, S.J. Park, W.J. Lee i inni. Role of adjuvant chemoradiotherapy for resected extrahepatic biliary tract cancer. „Int J Radiat Oncol Biol Phys”. 81 (5), s. e853-9, Dec 2011. DOI: 10.1016/j.ijrobp.2010.12.019. PMID: 21497455.
- ↑ K.H. Lim, D.Y. Oh, E.K. Chie, J.Y. Jang i inni. Adjuvant concurrent chemoradiation therapy (CCRT) alone versus CCRT followed by adjuvant chemotherapy: which is better in patients with radically resected extrahepatic biliary tract cancer?: a non-randomized, single center study. „BMC Cancer”. 9, s. 345, 2009. DOI: 10.1186/1471-2407-9-345. PMID: 19781103.
- ↑ Y. Borghero, C.H. Crane, J. Szklaruk, M. Oyarzo i inni. Extrahepatic bile duct adenocarcinoma: patients at high-risk for local recurrence treated with surgery and adjuvant chemoradiation have an equivalent overall survival to patients with standard-risk treated with surgery alone. „Ann Surg Oncol”. 15 (11), s. 3147–3156, Nov 2008. DOI: 10.1245/s10434-008-9998-7. PMID: 18754070.
- ↑ J.H. Park, E.K. Choi, S.D. Ahn, S.W. Lee i inni. Postoperative chemoradiotherapy for extrahepatic bile duct cancer. „Int J Radiat Oncol Biol Phys”. 79 (3), s. 696–704, Mar 2011. DOI: 10.1016/j.ijrobp.2009.12.031. PMID: 20510541.
- ↑ Krzakowski i in. 2015 ↓, s. 610–611.
- ↑ Eckel, Brunner i Jelic 2011 ↓, s. 3.
- ↑ B. Glimelius, K. Hoffman, P.O. Sjödén, G. Jacobsson i inni. Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer. „Ann Oncol”. 7 (6), s. 593–600, Aug 1996. PMID: 8879373.
- ↑ A. Sharma, A.D. Dwary, B.K. Mohanti, S.V. Deo i inni. Best supportive care compared with chemotherapy for unresectable gall bladder cancer: a randomized controlled study. „J Clin Oncol”. 28 (30), s. 4581–4586, Oct 2010. DOI: 10.1200/JCO.2010.29.3605. PMID: 20855823.
- ↑ F. Eckel, R.M. Schmid. Chemotherapy in advanced biliary tract carcinoma: a pooled analysis of clinical trials. „Br J Cancer”. 96 (6), s. 896–902, Mar 2007. DOI: 10.1038/sj.bjc.6603648. PMID: 17325704.
- ↑ Krzakowski i in. 2015 ↓, s. 610.
- ↑ Benson i in. 2016 ↓, s. 77.
- ↑ a b Roman Herman, Jakub Pałucki, Wojciech Polkowski, Piotr Potemski: Rak pęcherzyka żółciowego i dróg żółciowych zewnątrzwątrobowych. 2014.
- ↑ Benson i in. 2016 ↓, s. 77–78.
- ↑ J. Valle, H. Wasan, D.H. Palmer, D. Cunningham i inni. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. „N Engl J Med”. 362 (14), s. 1273–1281, Apr 2010. DOI: 10.1056/NEJMoa0908721. PMID: 20375404.
- ↑ T. Okusaka, K. Nakachi, A. Fukutomi, N. Mizuno i inni. Gemcitabine alone or in combination with cisplatin in patients with biliary tract cancer: a comparative multicentre study in Japan. „Br J Cancer”. 103 (4), s. 469–474, Aug 2010. DOI: 10.1038/sj.bjc.6605779. PMID: 20628385.
- ↑ M. Ducreux, E. Van Cutsem, J.L. Van Laethem, T.M. Gress i inni. A randomised phase II trial of weekly high-dose 5-fluorouracil with and without folinic acid and cisplatin in patients with advanced biliary tract carcinoma: results of the 40955 EORTC trial. „Eur J Cancer”. 41 (3), s. 398–403, Feb 2005. DOI: 10.1016/j.ejca.2004.10.026. PMID: 15691639.
- ↑ G.V. Kornek, B. Schuell, F. Laengle, T. Gruenberger i inni. Mitomycin C in combination with capecitabine or biweekly high-dose gemcitabine in patients with advanced biliary tract cancer: a randomised phase II trial. „Ann Oncol”. 15 (3), s. 478–483, Mar 2004. PMID: 14998852.
- ↑ Szczeklik i Gajewski 2014 ↓, s. 1046.
- ↑ Benson i in. 2016 ↓, s. 76.
- ↑ J. Park, M.H. Kim, K.P. Kim, do H. Park i inni. Natural History and Prognostic Factors of Advanced Cholangiocarcinoma without Surgery, Chemotherapy, or Radiotherapy: A Large-Scale Observational Study. „Gut Liver”. 3 (4), s. 298–305, Dec 2009. DOI: 10.5009/gnl.2009.3.4.298. PMID: 20431764.
- ↑ Krzakowski i in. 2015 ↓, s. 611.
- ↑ a b F. Mihalache, M. Tantau, B. Diaconu, M. Acalovschi. Survival and quality of life of cholangiocarcinoma patients: a prospective study over a 4 year period. „J Gastrointestin Liver Dis”. 19 (3), s. 285–290, Sep 2010. PMID: 20922193.
- ↑ Survival statistics for bile duct cancers. [dostęp 2016-01-20]. [zarchiwizowane z tego adresu (2016-01-20)].
- ↑ a b Benson i in. 2016 ↓, s. 34.
- ↑ a b Benson i in. 2016 ↓, s. 35.
- ↑ Rak przywnękowych dróg żółciowych. Klasyfikacja TNM. [dostęp 2016-01-24]. [zarchiwizowane z tego adresu (2016-01-24)].
- ↑ a b Benson i in. 2016 ↓, s. 36.
- ↑ Rak obwodowych dróg żółciowych. Nowa klasyfikacja TNM (2010 r.). [dostęp 2016-01-24]. [zarchiwizowane z tego adresu (2016-01-24)].
Bibliografia
- Al B. Benson, Michael I. D’Angelica, Thomas A. Abrams, Steven R. Alberts i inni. Hepatobiliary Cancers. „National Comprehensive Cancer Network”, 2016.
- F. Eckel, T. Brunner, S. Jelic. Biliary cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. „Ann Oncol”. 22 Suppl 6, Sep 2011. DOI: 10.1093/annonc/mdr375. PMID: 21908502.
- Vincent T. DeVita, Theodore S. Lawrence, Steven A. Rosenberg: Devita, Hellman & Rosenberg’s Cancer: Principles & Practice of Oncology. Wyd. 8. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7207-5.
- S.R. Hamilton, L.A. Aaltonen, Pathology and Genetics of Tumours of the Digestive System, Lyon: IARC Press, 2000, ISBN 92-83-22410-8 [dostęp 2016-01-24] [zarchiwizowane z adresu 2018-07-28].
- Joseph M. Herman, Timothy M. Pawlik, Charles R. Thomas Jr.: Biliary Tract and Gallbladder Cancer: A Multidisciplinary Approach. Springer Science & Business Media, 2014. ISBN 978-3-642-40558-7.
- Pat Price, Karol Sikora: Treatment of Cancer Sixth Edition. CRC Press, 2014, s. 233. ISBN 978-1-4822-1496-3.
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: James Heilman, MD, Licencja: CC BY 3.0
A person with jaundice from pancreatic cancer.
Autor: Banchob Sripa, Sasithorn Kaewkes, Paiboon Sithithaworn, Eimorn Mairiang, Thewarach Laha, Michael Smout, Chawalit Pairojkul, Vajaraphongsa Bhudhisawasdi, Smarn Tesana, Bandit Thinkamrop, Jeffrey M. Bethony, Alex Loukas & Paul J. Brindley, Licencja: CC BY 2.5
Incidence of cholangiocarcinoma (CCA) and Opisthorchis viverrini in Thailand from 1990–2001
Autor: Hellerhoff, Licencja: CC BY-SA 3.0
Klatskin tumor during ERC. The patient lies on his stomach obliquely, so that the left side of image corresponds to the patient's left side. In the left and right biliary system, a wire is placed, which is required for the subsequent insertion of stents to drain bile. Both parts were injected with contrast through a tube. The lack of contrast in the area of the confluence is clearly visible, where the wires run parallel.
Autor: Banchob Sripa, Licencja: CC BY 2.5
Photograph of cholangiocarcinoma in human liver from a patient from Khon Kaen, Thailand.
Autor: Oryginalnym przesyłającym był Samir z angielskiej Wikipedii, Licencja: CC-BY-SA-3.0
CT scan showing cholangiocarcinoma.
Autor: Фидель22, Licencja: CC BY-SA 3.0
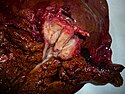
Опухоль Клацкина (холангиокарцинома) на препарате после выполнения правосторонней гемигепатэктомии
Autor: Nephron, Licencja: CC BY-SA 3.0
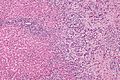
High magnification micrograph of cholangiocarcinoma. H&E stain.
Histologically, this is a cholangiocarcinoma as (1) atypical bile duct-like cells (left of image) extend from the tumour in an interlobular septum (the normal anatomical location of bile ducts), and (2) the tumour has the abundant desmoplastic stroma often seen in cholangiocarcinomas. A portal triad (upper-left of image) has a histologically normal bile duct.
Related image
ERCP image of cholangiocarcinoma, showing common bile duct stricture and dilation of the proximal common bile duct