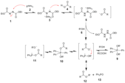
Reakcja Mitsunobu
Reakcja Mitsunobu – reakcja chemiczna alkoholi z odpowiednim czynnikiem nukleofilowym w obecności trifenylofosfiny oraz estru etylowego (DEAD) lub izopropylowego (DIAD) kwasu azodikarboksylowego. W zależności od użytego odczynnika nukleofilowego grupa hydroksylowa ulega przekształceniu w odpowiednią grupę funkcyjną, np. estrową. Reakcja zachodzi z inwersją (zmianą) konfiguracji. Została odkryta przez Oyo Mitsunobu w 1967 roku[1][2].
Opublikowano wiele prac przeglądowych na jej temat[3][4][5][6][7].
Mechanizm
Mechanizm reakcji Mitsunobu nie jest do końca poznany, a obecność i rola poszczególnych produktów przejściowych jest wciąż kwestią dyskusyjną.
W pierwszym etapie w wyniku ataku nukleofilowego trifenylofosfiny 2 na DEAD 1 powstaje pochodna betainy 3, która deprotonuje odczynnik nukleofilowy (kwas octowy) 4, tworząc z nim parę jonową. Następnie DEAD deprotonuje cząsteczkę alkoholu 6 a powstały alkoholan tworzy z trifenylofosfiną jon oksyfosfoniowy 8 – kluczowy produkt przejściowy, ulegający przemianom równowagowym. Stosunek poszczególnych pochodnych (8 – 11) zależy od pKa użytego odczynnika nukleofilowego oraz polarności rozpuszczalnika[8][9][10]. Jedynie atak nukleofila (Sn2) na pochodną 8 prowadzi do powstania produktu 12 oraz tlenku trifenylofosfiny 13. Pochodna 11 może jednak wykazywać aktywność chemiczną w reakcji z drugorzędowymi alkoholami z zawadą przestrzenną, która cechuje się retencją konfiguracji w powstałym produkcie[11][12][13].
Najszybszym etapem reakcji jest tworzenie soli 5, natomiast najwolniejszym powstawanie pochodnej oksyfosfoniowej 8. Jednakże prędkość całej reakcji zależy od solwatacji odczynnika nukleofilowego oraz jego pKa[14].
Kolejność reagentów
Kolejność dodawania poszczególnych reagentów w reakcji Mitsunobu może być istotna dla jej przeprowadzenia. Zwykle alkohol, odczynnik nukleofilowy i trifenylofosfinę rozpuszcza się razem w THF lub eterze dietylowym, schładza do 0 °C na łaźni lodowej i powoli dodaje DEAD rozpuszczony także w THF. Wszystko miesza się w temperaturze pokojowej przez kilka godzin. Jeżeli reakcja nie zajdzie należy betainę sporządzić oddzielnie dodając DEAD do trifenylofosfiny w THF w 0 °C, a na końcu alkohol i odczynnik nukleofilowy[15].
Stereochemia
Reakcja Mitsunobu cechuje się całkowitą inwersją konfiguracji chiralnego alkoholu dla większości przypadków, co jest niezwykle cenną właściwością w stereoselektywnej syntezie. W przypadku alkoholi z zawadą przestrzenną estryfikację z inwersją osiąga się stosując kwas p-nitrobenzoesowy, pikolinowy[16] lub chlorooctowy.
Odmiany
Od czasu odkrycia reakcja Mitsunobu znalazła szerokie zastosowanie syntetyczne i doczekała się dużej liczby modyfikacji, ukierunkowanych na zwiększenie spektrum możliwych zastosowań, zwiększenie wydajności i ułatwiających izolację produktów[17][18][19][20][21].
Odczynniki nukleofilowe
Oprócz kwasów karboksylowych jako odczynnik nukleofilowy można zastosować także wiele innych grup funkcyjnych. Aby reakcja zaszła, użyty nukleofil musi mieć pKa mniejsze od 15.
| Nukleofil | Produkt |
|---|---|
| kwas azotowodorowy | azydek alkilowy |
| imid | podstawiony imid[22] |
| fenol | eter alkilowo-arylowy |
| sulfonamid | podstawiony sulfonamid[23] |
Alternatywne reagenty "fosforanowe"
Zarówno trifenylofosfinę jak i DEAD można zastąpić odpowiednim ylidem fosforanowym typu R3P=CR2[a], powstałym w wyniku reakcji trimetylofosfiny z chloroacetonitrylem. Wysokie wydajności można uzyskać stosując (cyjanometyleno)trimetylofosforan (CMMP, 1) lub (cyjanometyleno)tributylofosforan (CMBP) w temperaturze ok. 120 °C nawet dla bardzo słabych nukleofili (o pKa do ok. 24) i sferycznie zatłoczonych substratów[24].
Ylid pełni rolę zarówno reduktora jak i zasady. Produktami ubocznymi są wówczas acetonitryl 6 oraz tlenek trialkilofosfiny 8.
Alternatywne reagenty azowe
DEAD zastąpiony odpowiednimi jego pochodnymi umożliwia wykorzystanie nukleofili o pKa wynoszącym nawet 15. Odczynnikami tymi są następujące pochodne kwasu azodikarboksylowego: dipiperydyd (ADDP)[25], tetrametyloamid (TMAD)[26], tetraizopropylodiamid (TIPA), 4,7-dimetylo-3,5,7-heksahydro-1,2,4,7-tetraazyno-3,8-dion (DHTD)[27]. Należy je stosować z fosfinami bardziej nukleofilowymi niż PPh3 jak tributylofosfina (TBP).
Modyfikacje ułatwiające usunięcie produktów ubocznych
Zastosowanie (p-dimetyloaminofenylo)difenylofosfiny[28], 2-(difenylofosfino)pirydyny lub 1,2-di(trifenylofosfino)etanu (DPPE)[29] zamiast trifenylofosfiny umożliwia prostsze usunięcie tlenku fosfiny z mieszaniny poreakcyjnej, odpowiednio przez ekstrakcję w środowisku kwaśnym lub przez krystalizację dla DPPE.
Użyteczną odmianą reakcji Mitsunobu jest zastąpienie trifenylofosfiny jej pochodną związaną ze stałym nośnikiem polimerowym (®–C6H4–PPh2) oraz azodikarboksylanu di-t-butylu (DBAD) zamiast DEAD. Dzięki temu produktem ubocznym reakcji nie jest trudny do usunięcia tlenek fosfiny (Ph3P=O), lecz związek immobilizowany na podłożu stałym (®–C6H4–P(O)Ph2), który wraz z nieprzereagowaną fosfiną można łatwo usunąć przez odsączenie. Natomiast nadmiar związku azowego i powstającą z niego pochodną hydrazyny można rozłożyć do produktów lotnych (CO2, NH2NH2, (CH3)2C=CH2) działając kwasem trifluorooctowym. Związki te można usunąć z mieszaniny poreakcyjnej przez odparowanie, bez użycia czasochłonnych technik chromatograficznych[30].
Innym sposobem na usunięcie ubocznych produktów azowych jest zastosowanie azodikarboksylanu dinorbornenu (DNAD) jako odczynnika azowego. Wobec katalizatora Grubbsa ulega on metatycznej polimeryzacji (ROMP). Dzięki temu zarówno produkty uboczne w postaci polimerów azowych, jak i związane z podłożem stałym związki fosfinowe usunąć można przez odsączenie, uzyskując produkty o czystości 86-96% z wydajnością dochodzącą do 100%[31]. Z kolei przy zastosowaniu azodikarboksylanu di-p-chlorobenzylu (DCAD) jako komponentu azowego, po zakończeniu reakcji powstała pochodna hydrazynowa jest nierozpuszczalna i można ją usunąć również przez sączenie[32].
Zastosowanie
Reakcja Mitsunobu znajduje szereg zastosowań w syntezie produktów naturalnych i leków.
Tymidyna (1) w powyższych warunkach ulega dwóm niezależnym kondensacjom typu Mitsunobu dając pochodną 2,3'-anhydro z zablokowaną grupą 5'-OH (2). Ze związku tego syntezuje się AZT (4) – ważny lek antywirusowy, stosowany m.in. w terapii AIDS[33].
Zobacz też
- Reakcja Appela
Uwagi
- ↑ Fosforoorganicznych fosforanów typu R3P=CR2 i R5P (ang. phosphoranes) nie należy mylić z fosforanami typu (RO)3P=O – pochodnymi kwasu fosforowego (ang. phosphates). W polskiej nomenklaturze oba typy związków noszą tę samą nazwę.
Przypisy
- ↑
 Mitsunobu Oyo, Yamada Masaaki. Preparation of Esters of Carboxylic and Phosphoric Acid via Quaternary Phosphonium Salts. „Bull. Chem. Soc. Japan”. 40 (10), s. 2380-2382, 1967. DOI: 10.1246/bcsj.40.2380.
Mitsunobu Oyo, Yamada Masaaki. Preparation of Esters of Carboxylic and Phosphoric Acid via Quaternary Phosphonium Salts. „Bull. Chem. Soc. Japan”. 40 (10), s. 2380-2382, 1967. DOI: 10.1246/bcsj.40.2380. - ↑
 Mitsunobu Oyo, Yamada Masaaki, Teruaki Mukaiyama. Preparation of Esters of Phosphoric Acid by the Reaction of Trivalent Phosphorus Compounds with Diethyl Azodicarboxylate in the Presence of Alcohols. „Bull. Chem. Soc. Japan”. 40 (4), s. 935, 1967. DOI: 10.1246/bcsj.40.935.
Mitsunobu Oyo, Yamada Masaaki, Teruaki Mukaiyama. Preparation of Esters of Phosphoric Acid by the Reaction of Trivalent Phosphorus Compounds with Diethyl Azodicarboxylate in the Presence of Alcohols. „Bull. Chem. Soc. Japan”. 40 (4), s. 935, 1967. DOI: 10.1246/bcsj.40.935. - ↑ Oyo Mitsunobu. The Use of Diethyl Azodicarboxylate and Triphenylphosphine in Synthesis and Transformation of Natural-Products. „Synthesis”, s. 1-28, 1981. DOI: 10.1055/s-1981-29317.
- ↑ B. R. Castro. „Org. React.”. 29, s. 1, 1983.
- ↑ D.L. Hughes. The Mitsunobu Reaction. „Org. React.”. 42, s. 335-656, 1992.
- ↑ D. L. Hughes. Progress in the Mitsunobu reaction. A review. „Org. Prep.”. 28 (2), s. 127-164, 1996. DOI: 10.1080/00304949609356516.
- ↑ K. C. Kumara Swamy, N. N. Bhuvan Kumar, E. Balaraman, K. V. P. Pavan Kumar. Mitsunobu and Related Reactions: Advances and Applications. „Chem. Rev.”. 109 (6), s. 2551-2651, 2009. DOI: 10.1021/cr800278z.
- ↑ Edward Grochowski, Bruce D. Hilton, Robert J. Kupper, Christopher J. Michejda. Mechanism of the triphenylphosphine and diethyl azodicarboxylate induced dehydration reactions (Mitsunobu reaction). The central role of pentavalent phosphorus intermediates. „J. Am. Chem. Soc.”. 104 (24), s. 6876-6877, 1982. DOI: 10.1021/ja00388a110.
- ↑ David Camp, Ian D. Jenkins. The mechanism of the Mitsunobu esterification reaction. Part I. The involvement of phosphoranes and oxyphosphonium salts. „J. Org. Chem.”. 54 (13), s. 3045-3049, 1989. DOI: 10.1021/jo00274a016.
- ↑ David Camp, Ian D. Jenkins. The mechanism of the Mitsunobu esterification reaction. Part II. The involvement of (acyloxy)alkoxyphosphoranes. „J. Org. Chem.”. 54 (13), s. 3049-3054, 1989. DOI: 10.1021/jo00274a017.
- ↑ Chuljin Ahn, Reuben Correia, Philip DeShong. Mechanistic Study of the Mitsunobu Reaction. „J. Org. Chem.”. 67 (6), s. 1751–1753, 2002. DOI: 10.1021/jo001590m.
- ↑ G. Grynkiewicz. Acylation in Presence of Diethyl Azodicarboxylate and Triphenylphosphine. „Rocz. Chem.”. 50 (13), s. 1449-1451, 1976.
- ↑ Stephen F. Martin, Jeffrey A. Dodge. Efficacious modification of the mitsunobu reaction for inversions of sterically hindered secondary alcohols. „Tetrahedron Letters”. 32 (26), s. 3017-3020, 1991. DOI: 10.1016/0040-4039(91)80675-V.
- ↑ D. L. Hughes, R. A. Reamer, J. J. Bergan, E. J. J. Grabowski. A mechanistic study of the Mitsunobu esterification reaction. „J. Am. Chem. Soc.”. 110 (19), s. 6487–6491, 1988. DOI: 10.1021/ja00227a032.
- ↑ R. P. Volante. A mechanistic study of the Mitsunobu esterification reaction. „Tetrahedron Letters”. 22 (33), s. 3119-3122, 1981. DOI: 10.1016/S0040-4039(01)81842-6.
- ↑ Tarek Sammakia, Jon S. Jacobs. Picolinic acid as a partner in the Mitsunobu reaction: Subsequent hydrolysis of picolinate esters under essentially neutral conditions with copper acetate in methanol. „Tetrahedron Letters”. 40 (14), s. 2685-2688, 1999. DOI: 10.1016/S0040-4039(99)00332-9.
- ↑ S. Ito. Development of new synthetic reagents in Mitsunobu-type reaction. „Yakugaku Zasshi-Journal of the Pharmaceutical Society of Japan”. 121 (8), s. 567-583, 2001. DOI: 10.1248/yakushi.121.567. (ang.).
- ↑ R. Dembinski. Recent advances in the Mitsunobu reaction: Modified reagents and the quest for chromatography-free separation. „Eur.J.Org.Chem.”, s. 2763-2772, 2004. DOI: 10.1002/ejoc.200400003. (ang.).
- ↑ T. Y. S. But, P. H. Toy. The Mitsunobu reaction: Origin, mechanism, improvements, and applications. „Chemistry-An Asian Journal”. 2 (11), s. 1340-1355, 2007. DOI: 10.1002/asia.200700182.
- ↑ K. C. K. Swamy, N. N. B. Kumar, E. Balaraman, K. V. P. P. Kumar. Mitsunobu and Related Reactions: Advances and Applications. „Chem.Rev.”. 109 (6), s. 2551-2651, 2009. DOI: 10.1021/cr800278z. (ang.).
- ↑ A. J. Reynolds, M. Kassiou. Recent Advances in the Mitsunobu Reaction: Modifications and Applications to Biologically Active Molecules. „Curr.Org.Chem.”. 13 (16), s. 1610-1632, 2009. DOI: 10.2174/138527209789578144. (ang.).
- ↑ Louis S. Hegedus, Michael S. Holden, James M. McKearin, cis-N-tosyl-3-methyl-2-azabicyclo[3.3.0]oct-3-ene, „Organic Syntheses”, 62, 1990, s. 48, DOI: 10.15227/orgsyn.062.0048.
- ↑ Wataru Kurosawa, Toshiyuki Kan, Tohru Fukuyama, Preparation of secondary amines from primary amines via 2-nitrobenzenesulfonamides: N-(4-methoxybenzyl)-3-phenylpropylamine, „Organic Syntheses”, 79, s. 186, DOI: 10.15227/orgsyn.079.0186.
- ↑ Tetsuto Tsunoda, Chisato Nagino, Miwa Oguri, Shô Itô. Mitsunobu-type alkylation with active methine compounds. „Tetrahedron Letters”. 37 (14), s. 2459-2462, 1996. DOI: 10.1016/0040-4039(96)00318-8.
- ↑ Tetsuto Tsunoda, Yoshiko Yamamiya, Shô Itô. 1,1'-(azodicarbonyl)dipiperidine-tributylphosphine, a new reagent system for mitsunobu reaction. „Tetrahedron Letters”. 34 (10), s. 1639-1642, 1993. DOI: 10.1016/0040-4039(93)85029-V.
- ↑ Tetsuto Tsunoda, Junko Otsuka, Yoshiko Yamamiya, Shô Itô. N,N,N',N'-Tetramethylazodicarboxamide (TMAD), A New Versatile Reagent for Mitsunobu Reaction. Its Application to Synthesis of Secondary Amines. „Chemistry Letters”. 23 (3), s. 539, 1994. DOI: 10.1246/cl.1994.539.
- ↑ Tetsuto Tsunoda, Yumi Kawamura, Kaori Uemoto, Shô Itô. Mitsunobu Type C-N Bond Formation with 4,7-Dimethyl-3,5,7-hexahydro-1,2,4,7-tetrazocin-3,8-dione(DHTD), a New Cyclic Azodicarboxamide. „Heterocycles”. 47 (1), s. 177-179, 1997. DOI: 10.3987/COM-97-S(N)78.
- ↑ Mark von Itzstein, Mauro Mocerino. (p-Dimethylaminophenyl) Diphenylphosphine: A More Practical Phosphine in the Mitsunobu Reaction. „Synthetic Communications”. 20 (13), s. 2049-2057, 1990. DOI: 10.1080/00397919008053136.
- ↑ Ian A. O'Neil, Stephen Thompson, Clare L. Murray, S. Barret Kalindjian. DPPE: A convenient replacement for triphynylphosphine in the staudinger and Mitsunobu reactions. „Tetrahedron Letters”. 39 (42), s. 7787-7790, 1998. DOI: 10.1016/S0040-4039(98)01702-X.
- ↑ Jeffrey C. Pelletier, Scott Kincaid. Mitsunobu reaction modifications allowing product isolation without chromatography: application to a small parallel library. „Tetrahedron Letters”. 41 (6), s. 797-800, 2000. DOI: 10.1016/S0040-4039(99)02214-5.
- ↑ Anthony G. M. Barrett, Richard S. Roberts, Jurgen Schroder. Impurity Annihilation: Chromatography-Free Parallel Mitsunobu Reactions. „Org. Lett.”. 2 (19), s. 2999-3001, 2000. DOI: 10.1021/ol006313g.
- ↑ Bruce H. Lipshutz, David W. Chung, Brian Rich, Ricardo Corral. Simplification of the Mitsunobu Reaction. Di-p-chlorobenzyl Azodicarboxylate: A New Azodicarboxylate. „Org. Lett.”. 8 (22), s. 5069–5072, 2006. DOI: 10.1021/ol0618757.
- ↑ Stanislaw Czernecki, Jean-Marc Valéry. An Efficient Synthesis of 3′-Azido-3′-deoxythymidine (AZT). „Synthesis”, s. 239-240, 1991. DOI: 10.1055/s-1991-26434.
Bibliografia
- Jacek Gawroński, Krystyna Gawrońska, Karol Kacprzak, Marcin Kwit: Współczesna synteza organiczna: wybór eksperymentów. Stefan Szczypka (projekt okładki i stron tytułowych). Warszawa: Wydawnictwo Naukowe PWN, 2004, s. 136-145. ISBN 83-01-14138-7.
Linki zewnętrzne
- Kevin Jantzi: The Mitsunobu Reaction. www.chem.wisc.edu, 2001. [dostęp 2010-06-29]. [zarchiwizowane z tego adresu (2013-11-03)].
Media użyte na tej stronie
(p-dimetyloaminofenylo)difenylofosfina
Synteza AZT z tymidyny
Description: Reaction mechanism of the Mitsunobu reaction.
- Author, date of creation: selfmade by ~K, 02 April 2006.
- Source: -
- Copyright: Public domain. (PD)
- Comments: high-resolution PNG; ChemDraw / The GIMP.
Reaction mechanism of the phosphorane variant of the Mitsunobu reaction.
N,N,N',N'-tetraisopropylazodicarboxamide (TIPA)
1,1'-(azodicarbonyl)dipiperidine (ADDP)
4,7-dimethyl-3,5,7-hexahydro-1,2,4,7-tetrazocin-3,8-dione (DHTD)
Autor: Tomasz Dolinowski, Licencja: CC0
2-(Difenylofosfino)pyrydyna
N,N,N',N'-tetramethylazodicarboxamide (TMAD)