Reakcja elektrocykliczna
Reakcja elektrocykliczna – typ reakcji pericyklicznej, która polega na przekształceniu układu wiązań π do pojedynczego wiązania σ w wyniku czego ma miejsce utworzenie układu cyklicznego[1].
Reakcje elektrocykliczne są klasyfikowane zgodnie z następującymi kryteriami:
- rodzaj czynnika indukującego reakcję – mogą one być indukowane termicznie lub fotochemicznie
- ilości elektronów π biorących udział w reakcji
- stereochemii reakcji – możliwe są dwa mechanizmy: konrotacyjny i dysrotacyjny
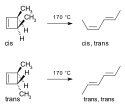
Klasycznym przykładem takiej reakcji jest indukowane termicznie otwarcie pierścienia 3,4 -dimetylocyklobutenowego. Izomer cis ulega przekształceniu do cis,trans-2,4-heksadienu natomiast z izomeru trans powstaje trans,trans-2,4-heksadien[2]:
Mechanizm
Teoria orbitali granicznych
Opisany powyżej przebieg reakcji może zostać wytłumaczony przy wykorzystaniu teorii orbitali granicznych: wiązanie σ w substracie zostaje otwarte w taki sposób by orbitale p miały symetrię identyczną z orbitalem HOMO produktu. Jedyną drogą wiodącą do takiej symetrii orbitali jest konrotacyjne otwarcie pierścienia[3].
| system | Indukowane termicznie (stan podstawowy) | Indukowane fotochemicznie (stan wzbudzony) |
|---|---|---|
| "4n" e- | Konrotacyjnie | Dysrotacyjnie |
| "4n + 2" e- | Dysrotacyjnie | konrotacyjnie |
Reguły Woodwarda-Hoffmana
Do opisu reakcji elektrocyklicznych można wykorzystać diagramy korelacyjne, bazujące na symetrii orbitali molekularnych. Dla otwarcia pierścienia cyklobutenowego można za ich pomocą wykazać, że proces może zachodzić konrotacyjnie natomiast nie może zachodzić dysrotacyjnie. Jest to spowadowane faktem, że jedynie mechanizm konrotacyjny pozwala na maksymalne nakładanie się orbitali w stanie przejściowym. Ponadto powstający produkt jest wtedy w stanie podstawowym a nie wzbudzonym.
Stany wzbudzone a elektrocyklizacje
Jeżeli otwarcie pierścienia w 3,4-dimetylocyklobutanie jest indukowane fotochemicznie to mechanizm reakcji jest dysrotacyjny, co zostało zilustrowane na poniższym diagramie korelacyjnym:
Z powodu istnienia cząsteczki w stanie wzbudzonym zachowanie symetrii orbitali możliwe jest jedynie gdy reakcja przebiega w sposób dysrotacyjny.
Przykłady zastosowań
Często badaną reakcją elektrocykliczną jest konrotacyjne, indukowane termicznie otwarcie pierścienia benzocyklobutanowego. Powstały związek jest bardzo nietrwały, ulega jednak łatwo reakcji Dielsa-Aldera. Efektywność otwarcia pierścienia jest zależna od rodzaju występującego podstawnika[4]. W rozpuszczalniku takim jak toluen i temperaturze reakcji wynoszącej około 110° C wydajność wzrasta w następującym szeregu podstawników: metyl, izobutylometyl i trimetylosilyl. Wysoka wydajność dla ostatniego z podstawników może zostać wytłumaczona przez występowanie hiperkoniungacji pomiędzy atomami węgla i krzemu.
Elektrocykliczna reakcja kaskadowa została z powodzeniem zastosowana w syntezie niektórych biomimetyków[5][6]:
Przypisy
- ↑ IUPAC Gold Book
- ↑ Rudolph Ernst K. Winter, The preparation and isomerization of - and -3,4-dimethylcyclobutene., „Tetrahedron Letters”, 6 (17), 1965, s. 1207–1212, DOI: 10.1016/s0040-4039(01)83997-6.
- ↑ Fleming, Ian. Frontier Orbitals and Organic Chemical Reactions. 1976 (John Wiley & Sons, Ltd.) ISBN 0-471-01820-1
- ↑ Yuji Matsuya, Noriko Ohsawa, Hideo Nemoto, Accelerated Electrocyclic Ring-Opening of Benzocyclobutenes under the Influence of a β-Silicon Atom, „Journal of the American Chemical Society”, 128 (2), 2006, s. 412–413, DOI: 10.1021/ja055505+, ISSN 0002-7863.c?
- ↑ K.C. Nicolaou, N.A. Petasis, R.E. Zipkin, The endiandric acid cascade. Electrocyclizations in organic synthesis. 4. Biomimetic approach to endiandric acids A-G. Total synthesis and thermal studies, „Journal of the American Chemical Society”, 104 (20), 1982, s. 5560–5562, DOI: 10.1021/ja00384a080, ISSN 0002-7863.c?
- ↑ K.C. Nicolaou, Inspirations, Discoveries, and Future Perspectives in Total Synthesis, „Journal of Organic Chemistry”, 74 (3), 2009, s. 951–972, DOI: 10.1021/jo802351b, ISSN 0022-3263, PMID: 19152273, PMCID: PMC2672623.c?
Media użyte na tej stronie
(c) V8rik z angielskiej Wikipedii, CC BY-SA 3.0
Dimethylcyclobutene ringopening mechanism
Autor: V8rik, Licencja: CC-BY-SA-3.0
Electrocyclic reaction Matsuya 2006
(c) V8rik z angielskiej Wikipedii, CC BY-SA 3.0
Electrocyclization In Endrianic Acid Synth
Excited state ring opening of 3,4-dimethylcyclobutene
Correlation diagrams for the allowed conrotatory ring opening of 3,4-dimehtylcyclobutene and the allowed disrotatory ring opening of 5,6-dimethylcyclohexa-1,3-diene
(c) V8rik z angielskiej Wikipedii, CC BY-SA 3.0
Winter dimethylcyclobutene isomerization
Symmetry Elements maintained throughout conrotatory or disrotatory processes.