Rhizaria
 Przedstawiciele Rhizaria | |
| Systematyka[a] | |
| Domena | |
|---|---|
| Królestwo | |
| Podkrólestwo | |
| Infrakrólestwo | Rhizaria[c] |
| Nazwa systematyczna | |
| Rhizaria Cavalier-Smith, 2002 | |
Rhizaria – mający rangę infrakrólestwa takson głównie[1] jednokomórkowych eukariontów z królestwa chromistów[d][2][3][4]. Organizmy te żyją w akwenach i glebach na całym świecie (jako plankton, bentos lub edafon)[5][6][7][8]; są zazwyczaj cudzożywne, choć część z nich posiada też endosymbiotyczne glony, a niektóre wykształciły nawet chloroplasty[3][4]; są również znane gatunki pasożytnicze[6]. Zazwyczaj posiadają cienkie pseudopodia[9], mogą posiadać też wić[3]. Większość z nich jest mikroskopijnych rozmiarów[6], jednakże istnieją też gatunki o średnicy kilku lub nawet kilkunastu centymetrów[10].
Rhizaria wywodzą się od prymitywnych glonów; grupa ta ma przynajmniej 650 mln lat, chociaż może być o ponad 100 mln lat starsza[3]; u wielu z nich występuje jakaś forma szkieletu lub skorupy dzięki czemu odnajdywane są licznie w fanerozoicznych skamieniałościach[4][6]. Stworzenie dla nich wspólnego taksonu nastąpiło dopiero niedawno[9] – wcześniej różne ich linie rozwojowe traktowane były jako pierwotniaki[11], glony[4], grzyby[4], a nawet zwierzęta[12]; w innych ujęciach systematycznych tworzą one supergrupę[9] bądź nieposiadający rangi takson supergrupy Sar (równoważnej wtedy z podkrólestwem Harosa)[13]. Znanych jest kilkanaście tysięcy żyjących gatunków Rhizaria[11].
Rozmnażanie następuje zazwyczaj bezpłciowo, choć zostały odnotowane przypadki rozmnażania płciowego lub sposobem (w pewnym sensie) mieszanym[14][15][16][17][18]. Występują na całym świecie[5]; odgrywają istotną rolę w regulowaniu globalnej liczebności bakterii, na które chętnie polują; mimo tak ważnej roli w ekosystemie nie były przez długi czas przedmiotem badań ludzi – głównie ze względu na niewielkie znaczenie gospodarcze i niewywoływanie chorób u człowieka[6].
Taksonomia i ewolucja
Historia taksonu
Niegdyś poszczególne grupy przedstawicieli Rhizaria były klasyfikowane jako protisty (głównie w obrębie typów Sarcodina i Flagellata[19]). Nazwa Rhizaria nawiązuje do taksonu Rhizopoda – podtypu[e] zarodziowców, do którego należało wielu przedstawicieli Cercozoa[4] oraz otwornice[20].
Termin Rhizaria wprowadził dopiero brytyjski biolog Thomas Cavalier-Smith w 2002 r. w celu zdefiniowania grupy pierwotniaków charakteryzującej się korzeniastymi filo- bądź retikulopodiami[9]; nadał jej wówczas rangę infrakrólestwa dzielącego się na cztery typy[9]:
- Apusozoa
- Cercozoa
- Retaria
- Helioza (Centrohelida)
Definicja ta była raczej intuicyjna; głównym jej oparciem było stwierdzone rok wcześniej pokrewieństwo między przedstawicielami Foraminifera i Cercozoa – kladu nowo utworzonego na podstawie badań filogenetycznych, które dowiodły m.in. bliskiego pokrewieństwa chlorarachniofitów z Euglypha. Niedługo później, w związku z postępem badań, wykluczono z niej Apusozoa (obecnie przynależące do Obazoa) oraz Centrohelida (obecnie przynależące do Haptista) pozostawiając dwa typy[9]:
- Cercozoa (sensu lato[f])
- Filosa (Cercozoa sensu stricto[g])
- Endomyxa
- Retaria
- Foraminifera – otwornice
- Radiozoa (Radiolaria) – promienice
W związku jednak z parafiletyzmem królestwa protistów oraz nowymi badaniami filogenetycznymi opartymi na genach aktynowych oraz SSU rDNA, Rhizaria szybko awansowały do nowo utworzonej rangi supergrupy[9]. W wyniku wzrostu zainteresowania taksonem, w roku 2006 jego monofiletyzm[h] nie ulegał już wątpliwościom[21], jednakże pokrewieństwa w jego obrębie wciąż pozostawały nierozstrzygnięte. Największe wątpliwości dotyczyły monofiletyzmu[h] grup Endomyxa oraz Polycystinea, jak również przynależności taksonów Gromiida i Haplosporida, a także wzajemnego pokrewieństwa Radiozoa i Foraminifera (wspólnie określanych jako Retaria). Jedną z propozycji systematycznych w 2008 r. był podział na[22]:
- Cercozoa Nikolaev i inni, 2004
- Euglyphida Copeland, 1956
- Cercomonadida Poche, 1913 przywrócony przez Karpov i inni, 2006
- Heteromitida Cavalier-Smith i Chao, 1996/1997
- Cryomonadida Kuhn i inni, 2000
- Ebriida Hoppenrath i Leander, 2006
- Thaumatomonadida Cavalier-Smith i Chao, 2004
- Chlorarachnea Cavalier-Smith, 1993
- Desmothoracida Nikolaev i inni, 2004
- Phaeodarea Polet i inni, 2004
- Massisteria Atkins i inni, 2000
- Gymnophrys Nikolaev i inni, 2003 r.
- inne
- Phytomyxea + Ascetosporea + Foraminifera + Gromiida + Corallomyxa
- Phytomyxea Engler i Prantl, 1897
- Plasmodiophorida Bulman i inni, 2001, 2006, 2007
- Phagomyxida Bulman i inni, 2001
- Ascetosporea Desportes i Ginsburger-Vogel, 1977
- Haplosporida Flores i inni, 1996; Reece i inni, 2004
- Paramyxida Berthe i inni, 2000
- Foraminifera d’Orbigny, 1826
- Gromiida Pawlowski i inni, 1994
- Corallomyxa Tekle i inni, 2009
- Phytomyxea Engler i Prantl, 1897
- Radiozoa Cavalier-Smith i inni, 1987
- Acantharea Amaral Zettler i Caron, 2000
- Taxopodida Nikolaev i inni, 2004
- Spumellarida Takahashi i inni, 2004
- Nassellarida Kunitomo i inni, 2006
- Collodaria Polet i inni 2004, Nikolaev i inni 2004
Przełomem okazały się badania wykonane przez Burkiego i innych w roku 2010 z użyciem EST pięciu gatunków Rhizaria, w wyniku których uzyskano dwa kladogramy[i] potwierdzające hipotezę Retaria, lecz wciąż nie rozstrzygające o monofiletyzmie[h] Endomyxa i ich miejscu w obrębie Rhizaria[23]:
| Rhizaria |
| ||||||||||||||||||||||||
| Rhizaria |
| ||||||||||||||||||||||||
Z kolei w 2012 r. Sina Adl zaproponował podział następujący[13]:
- Cercozoa Cavalier-Smith, 1998 przywrócony przez Adl i inni, 2005
- Cercomonadidae Kent, 1880 przywrócony przez Mylnikov i Karpov, 2004
- Pansomonadida Vickerman, 2005
- Glissomonadida Howe i Cavalier-Smith, 2009
- Tremula Howe i inni, 2011
- Metromonadea Cavalier-Smith, 2007 przywrócony przez Cavalier-Smith, 2011
- Granofilosea Cavalier-Smith i Bass, 2009
- Thecofilosea Cavalier-Smith, 2003 przywrócony przez Cavalier-Smith, 2011
- Imbricatea Cavalier-Smith, 2011
- Chlorarachniophyta Hibberd i Norris 1984
- Vampyrellida West, 1901 przywrócony przez Hess i inni, 2012
- Phytomyxea Engler i Prantl, 1897
- Filoreta Bass i Cavalier-Smith, 2009
- Gromia Dujardin, 1835
- Ascetosporea Desportes i Ginsburger-Vogel, 1977 przywrócony przez Cavalier-Smith, 2009
- Incertae sedis
- Psammonobiotidae Golemansky, 1974 przywrócony przez Meisterfeld, 2002
- Volutellidae Sudzuki, 1979
- Retaria Cavalier-Smith, 2002
- Foraminifera d’Orbigny, 1826
- Acantharia Haeckel, 1881 przywrócony przez Mikrjukov, 2000
- Polycystinea Ehrenberg, 1838 przywrócony przez Haeckel, 1887
- Incertae sedis
- Gymnosphaerida Poche, 1913 przywrócony przez Mikrjukov, 2000
- Actinolophus, Biomyxa, Cholamonas, Dictiomyxa, Helkesimastix, Katabia, Myxodictyium, Penardia, Pontomyxa, Protomyxa, Protogenes, Pseudospora, Rhizoplasma, Sainouron, Wagnerella
Systematyka[k]
Według klasyfikacji Ruggiera i innych z 2015 roku Rhizaria jest infrakrólestwem w ramach podkrólestwa Harosa, należącego do królestwa Chromistów w nadkrólestwie Eukariontów; dzieli się na 2 typy, 5 podtypów, 17 gromad[l] i 62 rzędy, przy czym występują też nadgromady i podgromady[2]. Poniższa tabela uwzględnia większość poprawek autorstwa Cavalier-Smitha z 2018 roku (m.in. zwiększenie liczby gromad do 18[l], rzędów – do 65)[3] z wyjątkiem przeniesienia Endomyxa do Retaria, gdyż późniejsze badania raczej wykluczają tę opcję (Irwin i inni 2019[24])[m]:
| Infrakrólestwo | Typ | Podtyp | Gromada[n] | Rzędy[o] | ||
|---|---|---|---|---|---|---|
| Rhizaria | Cercozoa | Endomyxa | Nadgromada Marimyxia | Ascetosporea | Claustrosporida, Haplosporida, Mikrocytida, Paradinida i Paramyxida | |
| Gromiidea | Gromiida i Reticulosida | |||||
| Nadgromada Proteomyxia | Phytomyxea | Phagomyxida i Plasmodiophorida | ||||
| Vampyrellidea | Vampyrellida | |||||
| Monadofilosa | Nadgromada Eoglissa | Helkesea | Helkesida | |||
| Metromonadea | Metopiida i Metromonadida | |||||
| Nadgromada Ventrifilosa | Imbricatea[p][3] | Podgromada Placonuda | Nadrząd Discomonada: rząd Discomonadida Nadrząd Euglyphia: rzędy Euglyphida i Zoelucasida Nadrząd Nudisarca: rzędy Marimonadida i Variglissida | |||
| Podgromada Placoperla | Nadrząd Placofila: rzędy Discocelida i Thaumatomonadida Nadrząd Perlatia: rzędy Perlofilida i Spongomonadida | |||||
| Podgromada Krakenia | Krakenida | |||||
| Sarcomonadea[p][3] | Podgromada Paracercomonada | Paracercomonadida | ||||
| Podgromada Pediglissa | Cercomonadida[q][3] i Glissomonadida, | |||||
| Thecofilosea | Podgromada Eothecia | Cryomonadida, Ebriida i Matazida | ||||
| Podgromada Phaeodaria | Eodarida i Opaloconchida | |||||
| Podgromada Ventricleftia | Ventricleftida | |||||
| Podgromada Tectosia | Tectofilosida | |||||
| Reticulofilosa[p][3] | Chlorarachnea | Chlorarachnida i Minorisida | ||||
| Granofilosea | Cryptofilida, Desmothoracida, Leucodictyida, Limnofilida i Axomonadida | |||||
| Skiomonadea | Aquavolonida i Tremulida | |||||
| Retaria[m] | Foraminifera | Monothalamea | Allogromiida, Astrorhizida, Psamminida i Stannomida | |||
| Globothalamea | Carterinida, Globeriginida, Lagenida, Lituolida, Lofusiida, Robertinida, Rotaliida, Testulariida i Trochamminida | |||||
| Tubothalamea | Miliolida i Spirillinida | |||||
| Radiozoa | Acantharea | Acanthoplegmida, Arthracanthida, Chaunacanthida i Holacanthida | ||||
| Polycystinea | Collodarida, Nassellaria i Spumellaria | |||||
| Sticholonchia[r][25][26] | Sticholonchea | Taxopodia | ||||
Wyróżnia się ok. 350 rodzin w obrębie Rhizaria[27]; Sina Adl oszacował liczbę żyjących gatunków na 18–28 tysięcy[11].
Filogeneza

Przeprowadzone w 2018 r. (opublikowane w 2019 r.) przez Irwina i innych badania dostarczyły silnych dowodów na monofiletyzm[h] Cercozoa[s], a kladogram Rhizaria prezentuje się obecnie w sposób następujący[24] (położenie Sticholonche, jedynego rodzaju w obrębie Sticholonchia, jest oparte na pracy Krabberøda i innych z 2017 r.[28]; gałąź grupy siostrzanej dla Filosa oparta jest na pracy Bassa i innych z 2018 r.[29], choć nie zostały uwzględnione domniemane na podstawie badań środowiskowego DNA grupy zewnętrzne dla Skiomonadea a bliższe im niż jest NC12[t]):
| Rhizaria |
| ||||||||||||||||||||||||||||||||||||||||||||||||
Według innych badań (m.in. He i inni 2016, Krabberød i inni 2017 oraz Cavalier-Smith i inni 2018) Radiozoa (Acantharea + Polycystinea) jest kladem, a Endomyxa nie należą do Cercozoa, lecz stanowią grupę najbardziej zewnętrzną (lub kilka takich grup – jest to wtedy takson parafiletyczny) w obrębie Retaria[3][28][30].
Od 2007 roku Rhizaria zaliczane są do grupy Sar[3] (od 2009 roku części chromistów[31]):
| Neokaryota |
| ||||||||||||||||||||||||
Powyższy kladogram został przedstawiony przez Cavalier-Smitha i innych w roku 2015[32], podobne wyniki (z różnicami w terminologii) otrzymali He i inni w 2014 roku[33]; w niektórych alternatywnych kladogramach, które przedstawili m.in. Derelle i inni (2015), Ren i inni (2016), He i inni (2016) oraz Krabberød i inni (2017), Hacrobia mogą być całkowicie lub częściowo grupowane z Plantae, a nieprzedstawione tutaj grupy zewnętrzne dla Neokaryota mogą być łączone w Discoba/Excavata jako grupa siostrzana dla Corticata, co czyni Scotokaryota kladem bazalnym jądrowców, gdyż Neokaryota połączone z Discoba/Excavata jest równoważne z Eukaryota; badania, które przedstawili He i inni w 2016 r. podważają monofiletyzm[h] Halvaria, grupując Alveolata z Rhizaria (zamiast Heterokonta); w różnych pracach Neokaryota, Scotokaryota, Corticata, Plantae i Harosa mogą pojawiać się pod synonimicznymi nazwami[28][30][34][35].
Metody badawcze i trudności; genetyka
W celu przeprowadzenia badań nad Rhizaria próbki pobiera się z gleby (gatunki edafoniczne), osadu (gatunki bentoniczne) lub na głębokości do kilkuset metrów zazwyczaj przy pomocy siatki planktonowej (gatunki planktoniczne). Następnie próbki przeniesione zostają do laboratorium i spreparowane – organizmy zostają oddzielone za pomocą igiełek lub szklanych mikropipet, umyte i zamrożone po uprzednim odfiltrowaniu wody morskiej, mogą też zostać wcześniej inkubowane w wodzie o odpowiedniej dla nich temperaturze. Przy pasożytach z gromady[l] Phytomyxea stosowana jest hodowla kalusu in vitro, a następnie jego sterylizacja[3][23][24][28][29].
Kolejnym krokiem jest przygotowanie cDNA potrzebnego do badań na przykład poprzez jego syntezę z użyciem RNA, amplifikację, fragmentację przy pomocy fal dźwiękowych, ligację i ponowną amplifikację gotowej próbki. W przypadku pasożytów roślin eliminuje się kontigi przypominające cDNA żywiciela[23]. Bada się też rDNA[6].
Obiektem zainteresowania naukowców są również białka i geny odpowiadające za ich syntezę; są to m.in. aktyna (białko występujące u wszystkich Rhizaria, pozwalające na ustalenie pokrewieństw w obrębie całej grupy, odgrywające istotną rolę w określeniu miejsca Endomyxa w drzewie filogenetycznym zależnie od tego, czy nastąpiła u nich – jak u Retaria – jej duplikacja, czy też nie)[23][24][28], tubulina (istotna szczególnie przy określaniu pokrewieństw w obrębie Retaria), kompleks Arp2/3 (w ramach którego część genów uległa duplikacji u chlorarachniofitów)[23][28], miozyny (z których miozyna XXXVII jest synapomorfią Rhizaria)[28], białko rybosomalne L10a (które u wielu Rhizaria posiada specyficzną insercję niegdyś uważaną za potencjalną synapomorfię)[23][28], poliubikwityna (posiadająca u wszystkich Rhizaria z wyjątkiem niektórych Radiozoa charakterystyczną insercję)[28][36] oraz polimeraza RNA II[23][37].
Analizę filogenomiczną przeprowadza się przy pomocy programów takich jak RAxML, PhyML, PhyloBayes, MrBayes czy Treefinder[v][23][38].
Głównymi powodami słabego poznania tej grupy są:
- Brak znanych pasożytów ludzkich oraz niewielkie znaczenie gospodarcze[6];
- Ogromne zróżnicowanie, (praktycznie) brak synapomorfii, fałszywe podobieństwa w obrębie grupy[9][23][24];
- Wykształcenie się cech analogicznych wobec innych grup na skutek konwergencji np. chloroplastów u Chlorarachnea, które prowadziły do błędnego skojarzenia Rhizaria z obecnie wątpliwym kladem Excavata, z którym łączone bywały w grupę Cabozoa[39].
- Mikroskopijność i brak zapisu kopalnego wielu grup;
- Trudności w hodowli[6];
- Szybkie tempo ewolucji organizmów z grupy Retaria[23];
- Duże zróżnicowane genetycznie[28].
Skutkiem takiej specyfiki obecnie dostępne są tylko dwa[w] genomy (należące do Bigelowiella natans i Reticulomyxa filosa) z grupy Rhizaria – najmniej wśród wszystkich głównych[x] linii rozwojowych jądrowców[6].
Ewolucja
Zapis kopalny
Przedstawiciele niektórych grup Rhizaria, w przeciwieństwie do większości protistów[6], posiadają twarde skorupki, szkielety i tym podobne, dzięki czemu pozostały po nich skamieniałości[40]. Jedne z najstarszych takich szczątków zostały odnalezione w prekambryjskich skałach na Alasce należących do tzw. grupy Tindir[41]; datuje się je na późny ton – przed około 740 mln laty, co koresponduje z przypuszczeniem, że Rhizaria odgrywały ważną rolę już w Ediakarze – zgodnie z tą hipotezą miałyby one być odpowiedzialne za obecność 24-izopropylocholestanu i 26-metylostygmastanu, uważanych do niedawna za niekwestionowany znak obecności zwierząt na początku tego okresu[42] – oraz z badaniami przeprowadzonymi przez Lentona i innych, które określają wiek Rhizaria na 760 mln lat. Pierwsze pewne znalezisko datowane jest dopiero na wczesny kambr, około 535 mln lat temu[y][3]; jest to przedstawiciel otwornic[4]. Prócz tego w skamieniałościach zachowały się inne posiadające twarde części ciała organizmy: fanerozoiczne Retaria (m.in. promienice), postpaleozoiczne Phaeodaria oraz niektóre kenozoiczne gatunki Ebriida[4][43].
Pochodzenie i wczesna ewolucja
Ostatni wspólny przodek Rhizaria i siostrzanego kladu Halvaria (lub samych Alveolata przy założeniu parafiletyzmu Halvaria) był drobnym, nieopancerzonym, jednokomórkowym eukariontem, elementem planktonu[4][28]; prawdopodobnie posiadał wić, rzęski[3], pęcherzyki[z][3], włoski[aa][4] oraz chloroplasty pochodzące od endosymbiotycznych krasnorostów[4]. Wczesne Rhizaria stały się bentonicznymi fagotrofami (heterotrofami pozyskującymi składniki odżwcze na drodze fagocytozy); taka zmiana środowiskowa doprowadziła do wykształcenia się u nich filopodiów oraz całkowitej utraty chloroplastów[3]; ich cytoszkielet również uległ znacznym zmianom; utraciły też włoski[4].
Dalsze podziały
Około 650–620 mln lat temu nastąpił rozdział na dwie odrębne grupy – drobnych wiciowców szybujących między ziarnami piasku i pozyskujących swoje bakteryjne pożywienie przy pomocy filopodiów, które dały początek Cercozoa, oraz większych, posiadających retikulopodia bezwiciowych form – wczesnych Retaria[4].
Z czasem u Cercozoa plezjomorficzne pęcherzyki zanikły całkowicie, zwiększając powierzchnię, na której mogłyby wyrastać nibynóżki, tymczasem w kontekście Retaria spekuluje się, że występująca u wielu promienic membranowa otoczka oddzielająca wewnętrzną, zawierającą najważniejsze organella część cytoplazmy od zewnętrznej – dziś spełniająca głównie funkcje ochronną i rusztowaniową – może być ich formą szczątkową powstałą poprzez utwardzenie ich powierzchni[3]. Większość Cercozoa nie pozostawia po sobie skamieniałości; wiadomo jednak, że ich ewolucja przebiegała w kierunku zmniejszania się rozmiarów i adaptacji do polowania na bakterie, choć, co ciekawe, część z nich – Chlorarachnea – wykształciło chloroplasty z endosymbiotycznych zielenic, podczas gdy te z rodzaju Paulinella zrobiły to poprzez uwięzienie cyjanobakterii. Ewolucja Retaria przebiegała szybciej[23] i w kierunku wprost przeciwnym – stawały się coraz większe, a glony były dla nich pożywieniem bądź endosymbiontami[3]; w stosunkowo krótkim czasie wiele z nich wykształciło jakąś formę szkieletu[44][45]. Niektóre Cercozoa – Endomyxa – na skutek konwergencji upodobniły się w dużej mierze do Retaria[3][24] (niektóre badania wskazują na to, że mogą one nawet do tej grupy przynależeć[3]); podobnie inna grupa – Phaeodaria – znacznie upodobniła się w budowie do promienic (uważano dawniej, że do nich przynależy)[46][47].
Występowanie
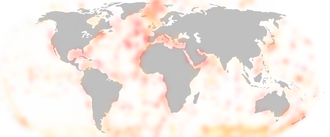
Żyją w różnorakich zbiornikach wodnych – głównie morzach i oceanach jako element planktonu (głównie Cercozoa i Radiozoa)[48][49] oraz bentosu (m.in. Foraminifera)[50], ale też w wodach słodkich – i na ich wybrzeżach[6] na całym świecie[5] – nawet w rejonach podbiegunowych[7][51], co jest zgodne z przypuszczeniem, że przetrwały one dwa wielkie zlodowacenia kriogeńskie[3]; występują licznie również w glebach jako element edafonu (także gatunki pasożytnicze)[6][8][52][53]; innymi słowy: żyją wszędzie i w każdym środowisku. Generalnie w niższych szerokościach geograficznych dominują gatunki miksotroficzne, zaś im bliżej biegunów, tym więcej gatunków stricte heterotroficznych[54]; rozmieszczenie ulega zmianom w zależności od pory roku[54], zwłaszcza w rejonach podbiegunowych[55]. Nie ma ścisłych reguł dotyczących głębokości występowania[56] – wiele planktonicznych gatunków ma szeroki ich zakres; u niektórych grup stwierdzono tendencję osobników młodocianych do trzymania się bliżej powierzchni[55]. Mimo tej różnorodności, statystycznie większość z nich preferuje ciepłe wody morskie i oceaniczne oraz głębokości do 100m[5].
Morfologia
Rhizaria jest jedną z najbardziej zróżnicowanych grup eukariontów[57] ; z tego powodu została zdefiniowana tylko na podstawie badań filogenetycznych[58]. Ich jedyną znaną synapomorfią morfologiczną jest specyficzny wygląd strefy przejściowej rzęsek, której przekrój poprzeczny daje się opisać jako zawierający w sobie środkową plamkę na tle bądź kratkowanej struktury (przy ciałku podstawowym), bądź szprychowatych elementów promieniście z niej wyrastających (przy rzęsce)[1][3][59]; jednakże, w znakomitej większości przypadków, ich cechami wspólnymi (acz nie charakterystycznymi) są: jednokomórkowość, rurkowate grzebienie mitochondrialne, oraz cienkie nibynóżki: filopodia, retikulopodia lub aksopodia[9]. Badania filogenetyczne organizmu pleśniopodobnego Guttulinopsis vulgaris wykazały jego przynależność do tego kladu (chociaż ma on odmienny wygląd grzebieni mitochondrialnych, posiada lobopodia i nie jest nawet jednokomórkowcem), czyniąc go pierwszym poznanym organizmem wielokomórkowym tej grupy[1].
Posiadają wszystkie struktury charakterystyczne bądź dla każdej komórki, bądź dla komórek eukariotycznych[ac]; na ogół posiadają również aparat Golgiego[60], wakuole[61], mitochondria (z jednym znanym wyjątkiem[6]), pseudopodia (z wyjątkami)[3] a czasami również: chloroplasty, endosymbionty, ścianę komórkową[62] lub jakąś formę szkieletu[4][56]. Najmniejszym znanym gatunkiem jest osiągający wielkość 1,4 µm Minorisa minuta[63], a największym – osiągający wielkość 20 cm Syringammina fragilissima, będący również największym znanym organizmem jednokomórkowym (choć wielojądrowym)[10]. Bardziej szczegółowe informacje dla pięciu grup[ad] Rhizaria zawiera poniższa tabela:
[64].
| Grupa | Organella komórkowe[ae] | Pozostałe struktury | Rozmiar | Przykładowa ilustracja/zdjęcie[af] | |
|---|---|---|---|---|---|
| Cercozoa | Endomyxa | Są jednokomórkowcami; niektóre z nich mogą tworzyć na drodze fuzji wielojądrowe plazmodia[52]; posiadają mitochondria[52]; nie posiadają chloroplastów[3][6]. | Najczęściej posiadają retikulopodia, rzadziej – filopodia[52]; mogą posiadać skorupki[52]; rzadko posiadają wici[24], nie posiadają ancestralnych pęcherzyków ani ich pozostałości[3]. Dwie pierwsze cechy są bardziej kojarzone z Retaria niż z Cercozoa, co – w połączeniu z wynikami niektórych badań filogenetycznych – prowadziło do (prawdopodobnie niesłusznego) klasyfikowania Endomyxa jako części Retaria[3][23][24]. | ok. 2 µm[3][65]–3 cm[52][66] |  |
| Filosa[ag] | Są w zdecydowanej większości przypadków jednokomórkowcami (choć istnieją formy wielokomórkowe)[1]; posiadają (prócz jednego znanego gatunku) mitochondria[6]; mogą posiadać nukleomorf[4], chloroplasty (chlorarachniophyta, Paulinella) lub endosymbionty. Nie posiadają centrosomów[3]. | Zwykle posiadają pseudopodia (najczęściej filopodia, rzadziej – retikulopodia, aksopodia lub lobopodia); mogą posiadać ścianę komórkową, struktury szkieletopodobne lub skorupki[1][3][4][62]. Posiadają na ogół wić[3], czasami proste w budowie włoski[4], choć są całkowicie pozbawione ancestralnych pęcherzyków[3]. Specyficzną grupą Filosa są Phaeodaria, które (nie wszystkie) wykształciły promienistą symetrię, regularny szkielet z wystającymi odnogami, centralną kapsułę i gigantyczny (jak na komórkę) rozmiar – wszystko niehomologicznie do należących do Retaria promienic, do których są łudząco podobne[3][46][47]. | 1,4 µm[63]–3 cm[ah][3][46] |  | |
| Retaria | Foraminifera | Są organizmami jednokomórkowymi[67]; posiadają jedno lub wiele jąder, zazwyczaj o kształcie kulistym, otoczonych membranami[12]; posiadają mitochondria[6]; nie posiadają chloroplastów[3], choć wiele z nich posiada endosymbiotyczne glony[4]. | Posiadają granuloretikulopodia (retikulopodia o ziarnistej fakturze widocznej pod mikroskopem) będące synapomorfią[12][67]; zdecydowana większość gatunków posiada skorupki (organiczne, powstałe wskutek aglutynacji lub złożone z węglanu wapnia bądź krzemionki)[67] możliwie złożone z kilku komór połączonych otworami (stąd nazwa taksonu – otwornice)[68]; wewnątrz tej skorupy znajduje się endoplazma zawierająca organella i ewentualne endosymbionty, a na zewnątrz – ektoplazma[68]; nie posiadają wici (poza gametami) ani ancestralnych pęcherzyków[3]. | W porównaniu z innymi Rhizaria (zwłaszcza Cercozoa) osiągają bardzo duże rozmiary (choć rozpiętość jest wielka) – od mniej niż 32 µm do aż 20 cm (średnio około 100 µm)[10][69]. | © Hans Hillewaert, CC BY-SA 4.0 |
| Radiozoa | Są organizmami jednokomórkowymi; posiadają jedno lub wiele jąder[18] oraz mitochondria[70]; nie posiadają chloroplastów[3], choć wiele z nich posiada endosymbiotyczne glony[18] | Posiadają na ogół aksopodia[25]; ich endoplazma zawierająca jądro, mitochondria, aparaty Golgiego, wakuole, kropelki lipidów i rezerwy składników odżywczych jest zamknięta w otoczoną membraną kapsułę (pozostałość ancestralnych pęcherzyków), która oddziela ją od ektoplazmy zawierającej mniejszą część mitochondriów, wakuole służące do fagocytozy, charakterystyczne pęcherzyki służące regulowaniu głębokości oraz endosymbiotyczne glony[70]; ze ściany tej wyrastają aksopodia; większość Radiozoa posiada również szkielet utworzony z krzemionki lub siarczanu strontu[6]; ich nazwa (również polska – promienice) pochodzi od promienistej symetrii tworzonej przez wystające elementy szkieletu[70]; nie posiadają wici[3]. | 30 µm–0,2 cm[71] | 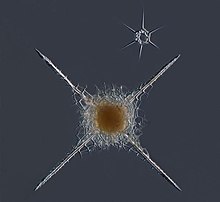 | |
| Sticholonchia[r][25][26] | Są organizmami jednokomórkowymi; posiadają jedno jądro[72] oraz mitochondria[6]; nie posiadają chloroplastów[3]. | Posiadają długie, wiosłowate aksopodia, wewnątrz których znajdują się pojedyncze, złożone z dwutlenku krzemu „kości” – ich szkielet nie jest zespojony jak u promienic, dzięki czemu są w stanie swobodnie poruszać jego elementami; w przeciwieństwie do Radiozoa, nie posiadają kapsuły, która otaczałaby endoplazmę, ale ich jądro otoczone jest ścianą, z której to aksopodia wyrastają[25]; nie posiadają też wici[3]. | 50 µm[72] (bez wliczania osiągających długość ok. 150 µm nibynóżek[25]) |  | |
Tryb życia i ekologia
Odżywianie

Większość Rhizaria to gatunki heterotroficzne odżywiające się poprzez fagocytozę bądź miksotroficzne – dodatkowo korzystające z fotosyntezy. Cercozoa okazują się być ważnymi bakteriożercami (polują też na glony, grzyby i protisty) obecnymi m.in. w glebie[8]; niektóre z nich posiadają chloroplasty lub endosymbionty jako dodatkowe lub jedyne źródło energii, i bywają nazywane glonami[4]; niektóre z nich (należące do Endomyxa) są pasożytami – głównie roślin (m.in. kapusty i ziemniaka), heterokontów (m.in okrzemek i brunatnic) oraz zwierząt (m.in. ostrygów i małży)[6].
Podobna sytuacja dotyczy Retaria, jednakże symbioza z glonami występuje u nich częściej (przy czym nie musi być to koniecznie endosymbioza)[6] i odżywiają się one w nieco inny sposób: podczas gdy Cercozoa zazwyczaj „szybują” wśród ziarenek piasku przy pomocy wici i rzęsek, łapiąc i więżąc bakterie długimi filopodiami po to, by pozyskać z nich składniki odżywcze pokarmowymi wodniczkami[3], Retaria są na ogół bardziej bierne jako bezwiciowce bądź poruszane przez prąd wody, bądź leżące na dnie morskim, przy pomocy pseudopodiów łapiąc i wstępnie trawiąc przepływające bakterie lub – dużo częściej niż w przypadku Cercozoa – inne protisty; nibynóżki umożliwiają im też wydalanie[3][6][17][24][67][70]. Wyjątek od tej reguły stanowi Sticholonche, który zwinnie porusza się, aktywnie wiosłując swoimi długimi nibynóżkami[25].
Rozmnażanie
Rozmnażanie przebiega różnie w różnych grupach. Cercozoa rozmnażają się zazwyczaj bezpłciowo[14]; mogą przy tym tworzyć plazmodia, co jest powszechne u pasożytów[14][73][74]: na przykład u Phytomyxea znajdujące się w ziemi zarodniki zarażają korzenie roślin, powiększają się, tworząc plazmodium, które następnie wypuszcza kolejne pływki, które na drodze fuzji tworzą drugie plazmodium, które następnie wypuszcza zarodniki do ziemi – cykl się zamyka[52][73]; znane są również przypadki rozmnażania płciowego (m.in. u Gromia i Chlorarachnion)[15][16].
U Retaria rozmnażanie płciowe również zostało zaobserwowane; w ramach podtypu Foraminifera reprodukcja następuje zazwyczaj w sposób łączony: pierwsze (nieparzyste), diploidalne pokolenie – nazywane ze względu na niewielki rozmiar środkowej komory „mikrosferycznym”– rozmnaża się bezpłciowo (poprzez mitozę), dając początek drugiemu (parzystemu), haploidalnemu pokoleniu – nazywanemu ze względu na większy rozmiar środkowej komory „megalosferycznym”– rozmnażającemu się płciowo, dając początek trzeciemu (znowóż nieparzystemu), diploidalnemu pokoleniu – cykl się zamyka[17]; osobniki należące do podtypu Radiozoa rozmnażają się na ogół bezpłciowo, choć możliwość istnienia u nich rozmnażania płciowego – domniemana na podstawie niepewnych obserwacji – nie jest wykluczona[18].
Rola w ekosystemie
Niewiele wiadomo o skali oddziaływań, jakie wywiera Rhizaria jako całość na przyrodę, ale badania molekularne wskazują na to, że jest ona znacznie większa, niż kiedyś myślano[6]. Cercozoa są istotne dla środowiska gleb, gdzie stanowią często największy odsetek biomasy, jeżeli chodzi o protisty; niemało istotne są również w środowisku mórz i oceanów, gdzie sami przedstawiciele gatunku Minorisa minuta stanowią aż 5% wszystkich heterotroficznych wiciowców, co świadczy o ich wpływie na światową liczebność bakterii w oceanach, a co za tym idzie – na obieg węgla w przyrodzie; podobnie jest z Retaria, które zarówno w wodzie, jak i w glebie odgrywają ważną rolę jako konsumenci mikroorganizmów[6][53].
Pasożytnicze Phytomyxea występują na całym świecie i mają znaczący wpływ na sieć pokarmową: zarodniki przenoszone przez wiatry lub prądy morskie zawierają wiele substancji wysokoenergetycznych, więc odgrywają rolę przenośnika energii; pasożyty te mogą też przyczynić się do zmiany składu chemicznego żywiciela (rośliny), a co za tym idzie – zmian w łańcuchu pokarmowym (np. korzeń z kiłą szybko kolonizują bakterie i grzyby)[73]; Ascetosporea również są ważnymi pasożytami[74].
Jako jedyne z eukariontów, otwornice mają zdolność przeprowadzania denitryfikacji; są również w stanie wchłaniać znajdujący się w wodzie dwutlenek węgla i przetrzymywać go przez dłuższy okres[6]. Zbudowane z węglanu wapnia skorupki otwornic mają znaczący wpływ na obieg węgla w przyrodzie[6]; zbudowane z dwutlenku krzemu szkielety promienic mają znaczący wpływ na obieg krzemu w przyrodzie[56].
Znaczenie dla człowieka
Rhizaria są stosunkowo mało istotne z punktu widzenia człowieka, a ich relacja z nim – słabo poznana[6]. Nie są znane wśród nich żadne patogeny występujące u ludzi, aczkolwiek niektóre Phytomyxea mogą być uciążliwymi pasożytami upraw, w szczególności kapusty (u której gatunek Plasmodiophora brassicae wywołuje kiłę) i ziemniaka (u którego gatunek Spongospora subterranea jest przyczyną parchu prószystego), z kolei pasożyty należące do Ascetosporea potrafią atakować bezkręgowce należące do owoców morza, co może być – dla akwakultury – dewastacyjne w skutkach[6].
Foraminifera mają zastosowanie w stratygrafii – jako że posiadają one twarde skorupki, ich skamieniałości są licznie odnajdywane w skałach pochodzących od kambru wzwyż[44], a różnorakie ich kształty i skład chemiczny pozwalają na określenie wieku znaleziska, głębokości prehistorycznych mórz i oceanów, pradawnych zmian klimatycznych[17], a także pomagają w odnajdowaniu złóż ropy naftowej[75]; podobne zastosowania dotyczą także pokrewnych Radiozoa[6][17], których współczesna bioróżnorodność na obszarze Arktyki pomaga również w badaniach nad trwającymi zmianami klimatu[55]. Otwornice mają też znaczenie gospodarcze jako jedne z głównych grup organizmów, których skamieniałości tworzą kredę[76].
Skamieniałości otwornic z rodzaju Nummulites są bardzo powszechne w egipskich wapieniach, których używano m.in. do budowy piramid[77]. Ich średnica – nawet 4 cm[78] – umożliwiała użycie ich jako monet (dowody na takie ich zastosowanie odnaleziono na terenie dzisiejszej Francji[79]; mogły być używane jako monety również w starożytnym Egipcie[80]); również w folklorze niektórych regionów świata wiązane są z pieniędzmi[78].
Zobacz też
Uwagi
- ↑ wg Ruggiera i innych 2015
- ↑ Również (jako „Sar”) w randze supergrupy (Adl i inni 2012); czasami traktowany bez kategorii systematycznej
- ↑ Również w randze supergrupy (Adl i inni 2005); czasami traktowany bez kategorii systematycznej
- ↑ wg Ruggiera i innych 2015, jak również wg Cavalier-Smitha, Chao i Lewis 2018
- ↑ Występował pod różnymi kategoriami systematycznymi.
- ↑ łac. 'w szerokim znaczeniu'
- ↑ łac. 'w wąskim znaczeniu'; w dalszej części artykułu mianem Cercozoa określane będzie Filosa + Endomyxa (Cercozoa sensu lato) chyba, że będzie obok uwaga: sensu stricto.
- ↑ a b c d e W obrębie tego artykułu monofiletyzm należy rozumieć sensu Hennig, czyli jako równoważny z holofiletyzmem sensu Ashlock.
- ↑ niepełne
- ↑ a b sensu stricto
- ↑ Klasyfikacja tej stosunkowo słabo poznanej grupy organizmów jest podatna na zmiany; w sekcji tej ukazany został względnie aktualny podział z 2015 roku z uwzględnieniem poprawek wprowadzonych w 2018 r. i badania opublikowanego w 2019 r.
- ↑ a b c ⟨ang. Class 'gromada, klasa'⟩
- ↑ a b Wszystkie infratypy (wg Cavalier-Smitha) zaliczające się do Retaria zostały w obrębie tabeli podniesione do rangi podtypu (co skutkuje zwiększeniem ich ilości do sześciu) w związku z tym, że wprowadzony przez Cavalier-Smitha podtyp Ectoreta, do którego należały, stałby się wraz z przeniesieniem Endomyxa do Cercozoa tożsamy z Retaria; obecność infratypów przy de facto braku podtypów byłaby niezręcznością.
- ↑ ⟨ang. Class 'gromada, klasa'⟩; podane są też ewentualne nadgromady
- ↑ oraz ewentualne nadrzędy i podgromady
- ↑ a b c możliwie takson parafiletyczny (przypis obok)
- ↑ możliwie takson polifiletyczny (przypis obok.)
- ↑ a b Zawiera tylko jeden rodzaj – Sticholonche – do którego zalicza się zazwyczaj jeden gatunek, Sticholonche zanclea, choć Meunier (1910) uznaje jeszcze drugi – Sticholonche ventricosa – o odmiennym kształcie ciała (przypis obok).
- ↑ a b sensu lato
- ↑ a b nienazwany jeszcze oficjalnie klad należący do Rhizaria i według niektórych badań stanowiący wraz z Aquavolonida (dawniej NC10) oraz Tremulida (dawniej NC11) – łączonymi w Skiomonadea – grupę siostrzaną dla Endomyxa ⟨ang. Novel Clade 12 'nowy klad 12'⟩
- ↑ bez Skiomonadea
- ↑ ML – Maximum Likelihood, Bayes – od Bayesian Inference (BI)
- ↑ stan na rok 2014; nie posiadam informacji, które wskazywałyby na to, że zostały od tego czasu odkryte jakiekolwiek nowe (stan na rok 2021)
- ↑ tu w znaczeniu "o tej samej randze co Rhizaria (wg Ruggiera i innych 2015) t.j. infrakrólestwa lub wyższej".
- ↑ Choć pierwszy niekwestionowany dowód ich egzystencji – obecność 24-n-propylocholestanu – datowany jest na 650 mln lat temu. Przypis obok.
- ↑ Hipoteza zakładająca, że pęcherzyki u przedstawicieli heterokontów, haptofitów i roślin są homologiczne, implikowałaby, iż jest to cecha wywodząca się od wspólnego przodka chromistów i roślin (tworzących razem klad Corticata); to z kolei wskazywałoby na to, że ostatni wspólny przodek Rhizaria i siostrzanej grupy takowe posiadał (przypis obok).
- ↑ zgodnie z przypuszczeniem, że włoski u heterokontów i Hacrobia są homologiczne (przypis obok)
- ↑ Grafika ilustruje częstość występowania (na podstawie danych z obis.org) w różnych miejscach – w mniejszej lub większej ilości Rhizaria występują na całym świecie.
- ↑ jądro komórkowe, siateczkę śródplazmatyczną, rybosomy, cytoszkielet, cytozol i błonę komórkową
- ↑ czyli wszystkich podtypów z różnicą taką, że Monadofilosa zostały potraktowane razem z Reticulofilosa jako Filosa
- ↑ Nie została zwrócona uwaga na posiadanie jądra komórkowego, siateczki śródplazmatycznej, rybosomów, cytoszkieletu, cytozolu czy błony komórkowej, gdyż występują u wszystkich eukriontów
- ↑ Nie oddaje różnorodności morfologicznej danej grupy.
- ↑ Monadofilosa + Reticulofilosa; Cercozoa sensu stricto
- ↑ Podany rozmiar maksymalny osiągają tylko Phaeodaria; u innych Filosa nawet rozmiar rzędu 100 μm jest rzadkością.
Przypisy
- ↑ a b c d e Matthew W. Brown i inni, Aggregative Multicellularity Evolved Independently in the Eukaryotic Supergroup Rhizaria, 19 czerwca 2012.
- ↑ a b c Michael A. Ruggiero i inni, A Higher Level Classification of All Living Organisms, „PLOS One”, 10 (4), 2015, art. nr e0119248, DOI: 10.1371/journal.pone.0119248, PMID: 25923521, PMCID: PMC4418965 [dostęp 2021-02-11] (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap Thomas Cavalier-Smith, Ema E. Chao, Rhodri Lewis, Multigene phylogeny and cell evolution of chromist infrakingdom Rhizaria: contrasting cell organisation of sister phyla Cercozoa and Retaria, „Protoplasma”, 255 (5), 2018, s. 1517–1574, DOI: 10.1007/s00709-018-1241-1, ISSN 0033-183X, PMID: 29666938, PMCID: PMC6133090 [dostęp 2021-02-12].
- ↑ a b c d e f g h i j k l m n o p q r s Thomas Cavalier-Smith, Kingdom Chromista and its eight phyla: a new synthesis emphasising periplastid protein targeting, cytoskeletal and periplastid evolution, and ancient divergences, „Protoplasma”, 255 (1), 2017, s. 297–357, DOI: 10.1007/s00709-017-1147-3, ISSN 1615-6102, PMID: 28875267, PMCID: PMC5756292 [dostęp 2021-02-24] (ang.).
- ↑ a b c d Rhizaria - Ocean Biodiversity Information System, obis.org [dostęp 2021-02-24].
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab Fabien Burki, Patrick J. Keeling, Rhizaria, „Current Biology”, 24 (3), 2014, R103–R107, DOI: 10.1016/j.cub.2013.12.025, ISSN 0960-9822, PMID: 24502779 [dostęp 2021-02-14] (ang.).
- ↑ a b Wojciech Majewski, Benthic foraminifera from West Antarctic fiordenvironments: An overview, 2010.
- ↑ a b c Samira Khanipour Roshan i inni, Taxonomic and Functional Diversity of Heterotrophic Protists (Cercozoa and Endomyxa) from Biological Soil Crusts, „Microorganisms”, 9 (2), 2021, s. 205, DOI: 10.3390/microorganisms9020205 [dostęp 2021-02-24] (ang.).
- ↑ a b c d e f g h i Jan Pawlowski, The twilight of Sarcodina: a molecular perspective on the polyphyletic origin of amoeboid protists, 2008, s. 7.
- ↑ a b c Michael Marshall, Zoologger: 'Living beach ball' is giant single cell, New Scientist [dostęp 2021-02-08] (ang.).
- ↑ a b c Sina M. Adl i inni, Diversity, Nomenclature, and Taxonomy of Protists, „Systematic Biology”, 56 (4), 2007, s. 684–689, DOI: 10.1080/10635150701494127, ISSN 1063-5157 [dostęp 2021-02-24] (ang.).
- ↑ a b c Palaeos Eukarya: Rhizaria: Foraminifera, palaeos.com [dostęp 2021-02-23].
- ↑ a b Sina M. Adl i inni, The Revised Classification of Eukaryotes, „Journal of Eukaryotic Microbiology”, 59 (5), 2012, s. 429–514, DOI: 10.1111/j.1550-7408.2012.00644.x, ISSN 1550-7408, PMID: 23020233, PMCID: PMC3483872 [dostęp 2021-02-24] (ang.).
- ↑ a b c Cercozoa, www.tolweb.org [dostęp 2021-02-26].
- ↑ a b Juliet Brodie, Jane Lewis, Unravelling the algae: the past, present, and future of algal systematics, 30 lipca 2009.
- ↑ a b Zach M. Arnold, Observations on the Sexual Generation of Gromia oviformis Dujardin, „The Journal of Protozoology”, 13 (1), 1966, s. 23–27, DOI: 10.1111/j.1550-7408.1966.tb01863.x, ISSN 1550-7408 [dostęp 2021-02-26] (ang.).
- ↑ a b c d e University College London Postgraduate Unit of Micropalaeontology, Foraminifera, various, 2002 [dostęp 2021-02-26] (ang.).
- ↑ a b c d University College London Postgraduate Unit of Micropalaeontology, Radiolaria, various, 2002 [dostęp 2021-02-23] (ang.).
- ↑ Б.Ф. Жуков, Атлас пресноводных гетеротрофных жгутиконосцев (биология, экология и систематика), Alexander Doweld [dostęp 2021-02-12] (ros.).
- ↑ Rhizopoda - Definition,Classification,Characteristics and Reproduction, MicroscopeMaster [dostęp 2021-02-19] (ang.).
- ↑ Fabien Burki, Jan Pawlowski, Monophyly of Rhizaria and Multigene Phylogeny of Unicellular Bikonts, „Molecular Biology and Evolution”, 23 (10), 2006, s. 1922–1930, DOI: 10.1093/molbev/msl055, ISSN 0737-4038 [dostęp 2021-02-17] (ang.).
- ↑ Jan Pawlowski, The twilight of Sarcodina: a molecular perspective on the polyphyletic origin of amoeboid protists, s. 12.
- ↑ a b c d e f g h i j k l Fabien Burki i inni, Evolution of Rhizaria: new insights from phylogenomic analysis of uncultivated protists, „BMC Evolutionary Biology”, 10 (1), 2010, s. 377, DOI: 10.1186/1471-2148-10-377, ISSN 1471-2148, PMID: 21126361, PMCID: PMC3014934 [dostęp 2021-02-11].
- ↑ a b c d e f g h i j Nicholas A.T. Irwin i inni, Phylogenomics supports the monophyly of the Cercozoa, „Molecular Phylogenetics and Evolution”, 130, 2019, s. 416–423, DOI: 10.1016/j.ympev.2018.09.004, ISSN 1055-7903 [dostęp 2021-02-11] (ang.).
- ↑ a b c d e f Noritoshi Suzuki, Yoshiaki Aita, Raidolaria: achievements and unresolved issues: taxonomy and cytology, styczeń 2011.
- ↑ a b A. Meunier, Microplankton des Mers de Barents et de Kara. Duc d'Orléans. Campagne arctique de 1907., C. Bulens: Bruxelles, Beligium, 1910, s. 204, 205 [dostęp 2021-03-02] (fr.).
- ↑ Markus Döring, Families of Living Organisms (FALO), DOI: 10.15468/tfp6yv [dostęp 2021-03-10].
- ↑ a b c d e f g h i j k Anders K. Krabberød i inni, Single Cell Transcriptomics, Mega-Phylogeny, and the Genetic Basis of Morphological Innovations in Rhizaria, „Molecular Biology and Evolution”, 34 (7), 2017, s. 1557–1573, DOI: 10.1093/molbev/msx075, ISSN 0737-4038, PMID: 28333264, PMCID: PMC5455982 [dostęp 2021-03-01].
- ↑ a b David Bass i inni, Rhizarian ‘Novel Clade 10’ Revealed as Abundant and Diverse Planktonic and Terrestrial Flagellates, including Aquavolon n. gen., „Journal of Eukaryotic Microbiology”, 65 (6), 2018, s. 828–842, DOI: 10.1111/jeu.12524, ISSN 1550-7408, PMID: 29658156, PMCID: PMC6282753 [dostęp 2021-03-02] (ang.).
- ↑ a b Ding He i inni, Reducing long-branch effects in multi-protein data uncovers a close relationship between Alveolata and Rhizaria, „Molecular Phylogenetics and Evolution”, 101, s. 1, ISSN 1055-7903 [dostęp 2021-03-01] (ang.).
- ↑ Thomas Cavalier-Smith, Kingdoms Protozoa and Chromista and the eozoan root of the eukaryotic tree, „Biology Letters”, 6 (3), 2010, s. 342–345, DOI: 10.1098/rsbl.2009.0948, PMID: 20031978, PMCID: PMC2880060 [dostęp 2021-02-14].
- ↑ Multiple origins of Heliozoa from flagellate ancestors: New cryptist subphylum Corbihelia, superclass Corbistoma, and monophyly of Haptista, Cryptista, Hacrobia and Chromista, „Molecular Phylogenetics and Evolution”, 93, 2015, s. 331–362, DOI: 10.1016/j.ympev.2015.07.004, ISSN 1055-7903 [dostęp 2021-03-01] (ang.).
- ↑ Ding He i inni, An Alternative Root for the Eukaryote Tree of Life, „Current Biology”, 24 (4), 2014, s. 465–470, DOI: 10.1016/j.cub.2014.01.036, ISSN 0960-9822, PMID: 24508168 [dostęp 2021-03-01] (ang.).
- ↑ Romain Derelle i inni, Bacterial proteins pinpoint a single eukaryotic root, „Proceedings of the National Academy of Sciences of the United States of America”, 112 (7), 2015, E693–E699, DOI: 10.1073/pnas.1420657112, ISSN 0027-8424, PMID: 25646484, PMCID: PMC4343179 [dostęp 2021-03-01].
- ↑ Ren Ren i inni, Phylogenetic Resolution of Deep Eukaryotic and Fungal Relationships Using Highly Conserved Low-Copy Nuclear Genes, „Genome Biology and Evolution”, 8 (9), 2016, s. 2683–2701, DOI: 10.1093/gbe/evw196, ISSN 1759-6653, PMID: 27604879, PMCID: PMC5631032 [dostęp 2021-03-01].
- ↑ David Bass i inni, Polyubiquitin Insertions and the Phylogeny of Cercozoa and Rhizaria, „Protist”, 156 (2), 2005, s. 149–161, DOI: 10.1016/j.protis.2005.03.001, ISSN 1434-4610 [dostęp 2021-02-14] (ang.).
- ↑ David Longet i inni, Foraminifera and Cercozoa share a common origin according to RNA polymerase II phylogenies, grudzień 2003, DOI: 10.1099/ijs0.02597-0.
- ↑ Naiara Rodríguez-Ezpeleta i inni, Detecting and Overcoming Systematic Errors in Genome-Scale Phylogenies, „Systematic Biology”, 56 (3), 2007, s. 389–399, DOI: 10.1080/10635150701397643, ISSN 1063-5157 [dostęp 2021-02-17] (ang.).
- ↑ Thomas Cavalier-Smith, Protist phylogeny and the high-level classification of Protozoa, „European Journal of Protistology”, 39 (4), 2003, s. 338–348, DOI: 10.1078/0932-4739-00002, ISSN 0932-4739 [dostęp 2021-02-17] (ang.).
- ↑ A.G.B. Simpson, Y. Eglit, Protist Diversification, Richard M. Kliman (red.), Oxford: Academic Press, 2016, s. 344–360, ISBN 978-0-12-800426-5 [dostęp 2021-02-17] (ang.).
- ↑ H.S. Yoon i inni, Stramenopiles, Moselio Schaechter (red.), Oxford: Academic Press, 2009, s. 721–731, ISBN 978-0-12-373944-5 [dostęp 2021-02-17] (ang.).
- ↑ Benjamin J. Nettersheim i inni, Putative sponge biomarkers in unicellular Rhizaria question an early rise of animals, „Nature Ecology & Evolution”, 3 (4), 2019, s. 577–581, DOI: 10.1038/s41559-019-0806-5, ISSN 2397-334X [dostęp 2021-02-18] (ang.).
- ↑ Yasuhide Nakamura, Noritoshi Suzuki, Phaeodaria: Diverse Marine Cercozoans of World-Wide Distribution, Susumu Ohtsuka i inni red., Tokyo: Springer Japan, 2015, s. 223–249, DOI: 10.1007/978-4-431-55130-0_9, ISBN 978-4-431-55130-0 [dostęp 2021-03-04] (ang.).
- ↑ a b Jan Pawlowski i inni, The evolution of early Foraminifera, „Proceedings of the National Academy of Sciences of the United States of America”, 100 (20), 2003, s. 11494–11498, DOI: 10.1073/pnas.2035132100, ISSN 0027-8424, PMID: 14504394 [dostęp 2021-02-18] (ang.).
- ↑ M.S. Afanasieva, E.O. Amon, Biomineralization of radiolarian skeletons, „Paleontological Journal”, 48 (14), 2014, s. 1473–1486, DOI: 10.1134/S0031030114140020, ISSN 1555-6174 [dostęp 2021-02-18] (ang.).
- ↑ a b c Ernst Haeckel, Report on the Radiolaria [dostęp 2021-03-02].
- ↑ a b Kozo Takahashi, O.R. Anderson, Class Phaeodaria, 2002.
- ↑ WoRMS - World Register of Marine Species - Cercozoa, www.marinespecies.org [dostęp 2021-02-19].
- ↑ WoRMS - World Register of Marine Species - Radiozoa, www.marinespecies.org [dostęp 2021-02-19].
- ↑ WoRMS - World Register of Marine Species - Foraminifera, www.marinespecies.org [dostęp 2021-02-19].
- ↑ S.B. Kruglikova, Arctic Ocean Radiolarians, Yvonne Herman (red.), Boston, MA: Springer US, 1989, s. 461–480, DOI: 10.1007/978-1-4613-0677-1_19, ISBN 978-1-4613-0677-1 [dostęp 2021-02-19] (ang.).
- ↑ a b c d e f g RHIZARIAE, comenius.susqu.edu [dostęp 2021-02-23].
- ↑ a b Franck Lejzerowicz i inni, Molecular evidence for widespread occurrence of Foraminifera in soils, „Environmental Microbiology”, 12 (9), 2010, s. 2518–2526, DOI: 10.1111/j.1462-2920.2010.02225.x, ISSN 1462-2920 [dostęp 2021-02-26] (ang.).
- ↑ a b S.G. Leles i inni, Oceanic protists with different forms of acquired phototrophy display contrasting biogeographies and abundance, „Proceedings of the Royal Society B: Biological Sciences”, 284 (1860), 2017, s. 20170664, DOI: 10.1098/rspb.2017.0664, PMID: 28768886, PMCID: PMC5563798 [dostęp 2021-02-19].
- ↑ a b c T. Ikenoue i inni, Flux variations and vertical distributions of siliceous Rhizaria (Radiolaria and Phaeodaria) in the western Arctic Ocean: indices of environmental changes, „Biogeosciences”, 12 (6), 2015, s. 2019–2046, DOI: 10.5194/bg-12-2019-2015, Bibcode: 2015BGeo...12.2019I [dostęp 2021-02-19].
- ↑ a b c Natalia Llopis Monferrer i inni, Estimating Biogenic Silica Production of Rhizaria in the Global Ocean, „Global Biogeochemical Cycles”, 34 (3), 2020, e2019GB006286, DOI: 10.1029/2019GB006286, ISSN 1944-9224 [dostęp 2021-02-22] (ang.).
- ↑ Jan Pawlowski, The twilight of Sardodina: a molecular perspective on the polyphyletic origin of amoeboid protists, s. 14.
- ↑ T Cavalier-Smith, The phagotrophic origin of eukaryotes and phylogenetic classification of Protozoa., „International Journal of Systematic and Evolutionary Microbiology”, 52 (2), 2002, DOI: 10.1099/00207713-52-2-297#tab2, ISSN 1466-5026 [dostęp 2021-02-08] (ang.).
- ↑ Thomas Cavalier-Smith, Sergey A. Karpov, Paracercomonas Kinetid Ultrastructure, Origins of the Body Plan of Cercomonadida, and Cytoskeleton Evolution in Cercozoa, sierpień 2011, DOI: 10.1016/j.protis.2011.06.004.
- ↑ Joel B Dacks i inni, Evidence for Golgi bodies in proposed 'Golgi-lacking' lineages., „Proceedings of the Royal Society B: Biological Sciences”, 270 (Suppl 2), 2003, S168–S171, DOI: 10.1098/rsbl.2003.0058, ISSN 0962-8452, PMID: 14667372, PMCID: PMC1809936 [dostęp 2021-02-22].
- ↑ Gian Pietro Di Sansebastiano i inni, Trafficking routes to the plant vacuole: connecting alternative and classical pathways, 31 października 2017.
- ↑ a b Chitchai Chantangsi, Comparative morphology and molecular evolution of marine interstitial cercozoans, 2009 [dostęp 2021-02-23].
- ↑ a b Javier del Campo i inni, Taming the smallest predators of the oceans, „The ISME Journal”, 7 (2), 2013, s. 351–358, DOI: 10.1038/ismej.2012.85, ISSN 1751-7370 [dostęp 2021-02-08] (ang.).
- ↑ James P. Kennett, M.S. Srinivasan, Neogene Planktonic Foraminifera: A Phylogenetic Atlas, Hutchinson Ross, 1983, ISBN 978-0-87933-070-5 [dostęp 2021-02-08] (ang.).
- ↑ Cathryn L. Abbott i inni, Molecular taxonomy of Mikrocytos boweri sp. nov. from Olympia oysters Ostrea lurida in British Columbia, Canada, 24 lipca 2014, DOI: 10.3354/dao02699.
- ↑ Mikhail V. Matz i inni, Giant Deep-Sea Protist Produces Bilaterian-like Traces, „Current Biology”, 18 (23), 2008, s. 1849–1854, DOI: 10.1016/j.cub.2008.10.028, ISSN 0960-9822, PMID: 19026540 [dostęp 2021-02-22] (ang.).
- ↑ a b c d Barun K. Sen Gupta, K. Barun, Modern Foraminifera, Springer Science & Business Media, 31 października 1999, ISBN 978-0-412-82430-2 [dostęp 2021-02-23] (ang.).
- ↑ a b Sindy Becker, Modern foraminifera: biological and ecological basics.
- ↑ Andrea D. Hawkes, Chapter 12 - Foraminifera in tsunami deposits, Max Engel i inni red., Elsevier, 2020, s. 239–259, ISBN 978-0-12-815686-5 [dostęp 2021-02-23] (ang.).
- ↑ a b c d Radiolaria.org > What are radiolarians, www.radiolaria.org [dostęp 2021-02-23].
- ↑ Introduction to the Radiolaria, ucmp.berkeley.edu [dostęp 2021-02-23].
- ↑ a b Department of Invertebrate Zoology / Protists Handbook Radiolaria / Taxopodida, www.zoology.bio.spbu.ru [dostęp 2021-02-23].
- ↑ a b c Sigrid Neuhauser, Martin Kirchmair, Frank H. Gleason, The ecological potentials of Phytomyxea (“plasmodiophorids”) in aquatic food webs, „Hydrobiologia”, 659 (1), 2011, s. 23–35, DOI: 10.1007/s10750-010-0508-0, ISSN 0018-8158, PMID: 21339888, PMCID: PMC3040567 [dostęp 2021-02-22].
- ↑ a b David Bass, Georgia M. Ward, Fabien Burki, Ascetosporea, „Current Biology”, 29 (1), 2019, R7–R8, DOI: 10.1016/j.cub.2018.11.025, ISSN 0960-9822, PMID: 30620917 [dostęp 2021-02-26] (ang.).
- ↑ USING MICROFOSSILS IN PETROLEUM EXPLORATION, ucmp.berkeley.edu [dostęp 2021-02-28].
- ↑ chalk, [w:] Encyclopædia Britannica [online] [dostęp 2022-10-06] (ang.).
- ↑ Nummulite, t. Volume 19, 1911 Encyclopædia Britannica [dostęp 2021-02-28].
- ↑ a b Paul D Taylor, Fossil folklore: some myths, monsters, swallows and butterflies, „Deposits Magazine”, 47, 2016.
- ↑ Adam Stéphane, The use of fossils as account tokens: the example of the Senlis foraminifera, Bellon-Republic streets. (English version of the french paper published here) [dostęp 2021-02-28] (ang.).
- ↑ Speaking of Science from The Washington Post, web.archive.org, 8 marca 2018 [dostęp 2021-02-28] [zarchiwizowane z adresu 2018-03-08].
Bibliografia
- A.G.B. Simpson, Y. Eglit: Protist Diversification. W: Richard M. Kliman: The Encyclopedia of Evolutionary Biology. T. 3. Stany Zjednoczone: Academic Press, 2016. ISBN 978-0-12-800049-6.
- Moselio Schaeter: Encyclopedia of Microbiology. Stany Zjednoczone: Academic Press, 2009. ISBN 978-0-12-373944-5.
Linki zewnętrzne
Rhizaria w serwisie Paleos – interaktywny dendrogram Rhizaria zawierający wiele informacji na temat różnych podgrup i gatunków (w języku angielskim).
Protist digital specimen archive – baza danych zawierająca zdjęcia wszelakich protistów. Różnorakie Rhizaria znaleźć można głównie w sekcjach Cercomonadida i Filosea.
Rhizaria na stronie OBIS – wiele danych statystycznych dotyczących dystrybucji i odnotowanych obserwacji.
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
© Hans Hillewaert, CC BY-SA 4.0
Benthic forams, taken with a Leica DFC 490 camera mounted on a Leica M205C binocular microscope. Collected in 2011 at 51°42′32.88″N 2°27′3.98″E / 51.7091333°N 2.4511056°E on the edge of the Belgian part of the North Sea.
Diameter = ~600 µm
Autor: Ringwoodit, Licencja: CC BY-SA 4.0
Großforaminiferen als Gesteinsbildner, Erzkalk von Grünten im Allgäu
Autor:
Amoeba from the Collection Pénard MHNG
Autor: John Dolan, Licencja: CC BY-SA 3.0
Cleveiplegma boreale (or Rhizoplegma boreale? See: Dumitrica, P. (2013) "Cleveiplegma nov. gen., a new generic name for the radiolarian species Rhizoplegma boreale (Cleve, 1899)". Revue de Micropaléontologie, 56(1): 21–25. doi:10.1016/j.revmic.2013.01.001).
Radiolaria Sticholonche ventricosa
Autor: Lubov Czech, Tatyana Svitkina, and Changsong Yang, Licencja: CC BY 2.5
This electron micrograph shows exaggerated filopodia with club-like shape induced by formin mDia2 in cultured cells. These filopodia are filled with bundled actin filaments which were born in and converged from the lamellipodial network.
Autor: Maciuf, Licencja: CC BY-SA 4.0
The distribution of Rhizaria based on data from obis.org. More red means more Rhizarians reported in the region.
Autor:
Amoeba from the Collection Pénard MHNG
Autor: I, Licencja: CC BY-SA 4.0
A collage depicting rhizarian diversity using pictures from wikimedia commons.
















