Starzyk granatowy
| Molothrus bonariensis[1] | |||
| (J.F. Gmelin, 1789) | |||
 Samiec (zdjęcie z południowo-zachodniego Mato Grosso) | |||
 Samica (zdjęcie ze wschodniej Argentyny) | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Infragromada | |||
| Rząd | |||
| Podrząd | |||
| Rodzina | |||
| Podrodzina | epoletniki | ||
| Rodzaj | Molothrus | ||
| Gatunek | starzyk granatowy | ||
| Synonimy | |||
| |||
| Podgatunki[2] | |||
| |||
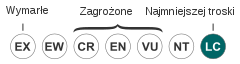
| Kategoria zagrożenia (CKGZ)[3] | |||
 | |||
| Zasięg występowania | |||
 | |||
Starzyk granatowy[4] (Molothrus bonariensis) – gatunek małego lub średniej wielkości ptaka z rodziny kacykowatych (Icteridae). Występuje w Ameryce Środkowej i Południowej oraz na Florydzie. Nie jest zagrożony wyginięciem.
Taksonomia
Po raz pierwszy gatunek opisał Johann Friedrich Gmelin w 1789 w pierwszym tomie 13. edycji Systema Naturae. Holotyp pochodził z Buenos Aires. Autor nadał nowemu gatunkowi nazwę Tanagra bonariensis[5]. Epitet gatunkowy bonariensis nawiązuje do miejsca odłowienia holotypu (Bonaria → Buenos Aires)[6]. Obecnie (2020) Międzynarodowy Komitet Ornitologiczny umieszcza starzyka granatowego w rodzaju Molothrus[2]. Jest blisko spokrewniony ze starzykiem brunatnogłowym (M. ater), którego przypomina zwyczajami i głosem[7].
Podgatunki
IOC wyróżnia 7 podgatunków[2]. Nie uznaje M. b. melanogyna (Stolzmann, 1926[8]) i M. b. milleri (Naumburg & Friendmann, 1927[9]), które obejmują ptaki będące przedstawicielami ciemniejszej odmiany osobników podgatunku nominatywnego. Nie jest znane pochodzenie izolowanej chilijskiej populacji starzyków granatowych[7].
Najpóźniej, bo w 1937 roku, opisany został Molothrus bonariensis riparius przez Griscoma i J. C. Greenwaya. Holotypem była samica odłowiona 11 czerwca 1933 w Pinhy nad rzeką Tapajós[10]. Wcześniej, w 1915 Frank Michler Chapman wyodrębnił Molothrus bonariensis aequatorialis na podstawie samicy odłowionej 5 sierpnia 1912 w Barbacoas (Nariño, południowo-zachodnia Kolumbia)[11]. Molothrus bonariensis minimus po raz pierwszy opisał Raymond de Dalmas w 1900 pod nazwą Molothrus minimus, uznając go za osobny gatunek[12]. Podobnie i Molothrus bonariensis occidentalis został początkowo uznany za odrębny gatunek przez Berlepscha i Stolzmanna w 1892[13]. Rok wcześniej Witmer Stone podjął się próby rewizji okazów uznanych za przedstawicieli M. bonariensis i pokrewnych; wyodrębnił nowy podgatunek (Molothrus bonariensis venezuelensis), który uznał za odrębny gatunek; holotyp pochodził z nieokreślonej lokalizacji w Wenezueli[14]. Pomijając podgatunek nominatywny, chronologicznie najwcześniej opisano Molothrus bonariensis cabanisii. Swoimi spostrzeżeniami dotyczącymi morfologii reprezentantów nowego taksonu (opisanego jako M. cabanisii) John Cassin podzielił się w 1866 na łamach Proceedings of the Academy of Natural Sciences of Philadelphia[15].
Zasięg występowania
Zasięg występowania w zależności od podgatunku[2]:
- M. b. minimus – południowo-wschodnie Stany Zjednoczone (Floryda), Karaiby, Trynidad i Tobago, region Gujana i skrajnie północna Brazylia (okolice Rio Branco)[7]
- M. b. cabanisii – wschodnia Kostaryka, Panama i zachodnia Kolumbia[7]
- M. b. venezuelensis – północna Wenezuela i wschodnia Kolumbia
- M. b. aequatorialis – południowo-zachodnia Kolumbia i zachodni Ekwador[7]
- M. b. occidentalis – skrajnie południowo-zachodni Ekwador (Prowincja Loja) i zachodnie Peru[7]
- M. b. riparius – wschodni Ekwador, wschodnie Peru, dolina Amazonki w Brazylii (na wschód od Óbidos)[7]
- M. b. bonariensis – wschodnia i centralna Brazylia (na południe od Amazonki) na południe po wschodnią Boliwię, Paragwaj, Urugwaj i Argentynę (na południe po centralną prowincję Santa Cruz) oraz Chile (region Coquimbo na południe po Aysén)
W 1994 po raz pierwszy odnotowano starzyka granatowego na Bahamach (na North Andros Island). Wcześniej w 1982 pierwszy raz stwierdzono go na Kubie, w 1973 na Dominikanie, a w 1955 na Portoryko. W 1985 dokonano pierwszego stwierdzenia w kontynentalnej części Ameryki Północnej. Do 1993 obserwowano przedstawicieli M. bonariensis w kilku stanach, w tym na Florydzie (1985[16]), w Georgii, Luizjanie, Karolinie Północnej, Oklahomie, Teksasie i Maine[17]. 27 maja 1996 dokonano pierwszego stwierdzenia dla Meksyku; ptaka zaobserwowano w Celestún na półwyspie Jukatan[16]. Przedstawiciele M. bonariensis nie występują w niektórych częściach Amazonii, ich zasięg w tym regionie powiększa się wraz z wycinką lasów[18].
Morfologia
Długość ciała wynosi 17–21,5 cm[7]. Przedstawiciele poszczególnych podgatunków znacząco różnią się osiąganymi rozmiarami. Najmniejsi są reprezentanci M. b. minimus, gdzie samce osiągają średnio masę 39 g, zaś samice 32 g, zaś największe są ptaki z podgatunku M. b. cabanisii – średnia masa ciała samców to 64 g, samic – 56 g. Ptaki podgatunku nominatywnego są pod względem masy przeciętnie (średnio 56 g dla samców i 45,6 g dla samic) (nie podano liczby zbadanych osobników)[19]. Występuje dymorfizm płciowy w upierzeniu. Samce są w większości czarne z fioletowawą – lub niebieskozieloną, na skrzydłach i, nieznacznie, na ogonie – opalizacją, najintensywniejszą na głowie, szyi i piersi. Upierzenie samic w większości jest szare po brązowoszare, z jaśniejszym spodem ciała. Przeważnie za okiem występuje jasny pasek, najbardziej widoczny u samic podgatunków M. b. aequatorialis i M. b. occidentalis. Samice M. b. occidentalis są ogółem najjaśniejsze ze wszystkich starzyków granatowych, z jasnoszarym spodem ciała pokrytym nieregularnymi, popielatymi paskami[18]. Dziób smukły, o stożkowatym kształcie. Tęczówka ciemna[16].
Niejednokrotnie najłatwiej rozpoznać starzyki granatowe w stadzie, ponieważ u części pokrewnych gatunków nie występuje dymorfizm płciowy. Samce M. bonariensis są bardzo podobne do samców starzyków krótkodziobych (M. rufoaxillaris)[18].
Ekologia i zachowanie
Starzyki granatowe zamieszkują różne półotwarte i otwarte środowiska. Są szczególnie liczne na terenach rolniczych z porozrzucanymi skupiskami drzew i zakrzewieniami. Szybko zasiedlają wylesione obszary. Przeważnie starzyki granatowe odnotowywane są poniżej 2000 m n.p.m., ale w zachodniej Argentynie ich zasięg sięga do 3500 m n.p.m. W Boliwii i Peru powszechne są stwierdzenia na wysokościach większych niż 3000 m n.p.m. Zwłaszcza w Ekwadorze większość stwierdzeń pochodzi z wysokości 900–1000 m n.p.m., ale regularnie odnotowuje się te ptaki wyżej, między 1400 a 1600 m n.p.m. Pojedyncze stwierdzenia dotyczyły wyżyn – do 2700 m n.p.m., ale nie obserwowano aktywności lęgowej na takich wysokościach. Od 11 kwietnia do 15 maja 2015 obserwowano w Quito młodocianego starzyka granatowego, co dowodzi, że kacyki te są w stanie skolonizować miasto położone na znacznej wysokości[20].
Przeważnie starzyki granatowe przebywają w niewielkich stadach (większe grupy tworzą podczas odpoczynku)[18]. W Argentynie we wrześniu notowano stada liczące 100–200 osobników; przed nadejściem pory lęgowej (październik) widywano mniejsze stada, w których było 24–30 osobników, ale większość ptaków przebywała w grupach 1–2 samic i 2–4 samców[21]. Żerują głównie na ziemi. Często przyjmują charakterystyczną postawę, lekko zadzierając ogon do góry[18]. Pożywieniem tych kacyków są bezkręgowce i nasiona, zarówno roślin dzikich, jak i uprawnych[7]; nie jedzą dużych nasion, np. słonecznika (Helianthus)[21]. Odnotowano również żerowanie na nektarze Combretum[7] i uprawianego w północnej Argentynie tęgosza mocnego Phormium tenax[22]. Jedzą ryż i chleb podawany im przez ludzi, wydziobują również ze żłobów karmę dla zwierząt gospodarskich[21].
Lęgi
Okres lęgowy na Portoryko trwa od marca do października, w Wenezueli od maja do września, a w północnej Argentynie od września do lutego[7]. Pieśń samców jest płynna, zwięzła i bulgocząca; podczas jej wykonywania ptaki często stroszą pióra na szyi[18]. Podobnie jak inni przedstawiciele rodzaju, starzyki granatowe są pasożytami lęgowymi. Do 2013 włącznie odnotowano 267 gatunków (należących do 15 rodzin), na których pasożytują lub próbowały pasożytować starzyki granatowe (w tym w przypadku 40 takowe pasożytnictwo stwierdzono tylko raz, a 5 gatunków jest dyskusyjnych). Jest to największa liczba z całego rodzaju (na 2. miejscu plasuje się starzyk brunatnogłowy, na 3. – czarny, M. aeneus). Większość wymienili Friedmann i Kiff w 1985, w późniejszych latach z listy wykreślono 2 gatunki, natomiast kilka dodano[23]. Według danych z 1963 najpospolitszymi gospodarzami starzyków granatowych były pasówki obrożne (Zonotrichia capensis), diuki (Diuca diuca), tyrany widłosterne (Tyrannus savana), garncarze rdzawe (Funarius rufus), przedrzeźniacze białoskrzydłe (Mimus triurus), ciemnokacyki kasztanowogłowe (Chrysomus ruficapillus) i strzyżyki śpiewne (Troglodytes aedon)[21]. Wśród pasożytowanych gatunków są również zagrożone wyginięciem (stan z 2007), jak narażone: mniszek blady (Xolmis dominicanus) i wojak pampasowy (Leistes defilippii) oraz zagrożona kardynałka (Gubernatrix cristata)[24]. Samica gniazd, do których może złożyć jaja, szuka przeważnie samotnie, niekiedy dwie lub trzy samice szukają gniazd razem, czasami w towarzystwie jednego samca[25]. Starzyki potrafią zredukować rozmiar wylęgu jaj gospodarza do około 20%. Sukces wyklucia z jaja gospodarza może spaść nawet do 80%. Spowodowane jest to wyrzucaniem jaj gospodarza, a także ich niższą wydajnością inkubacji[26].
Jaja starzyków granatowych wykazują niesamowitą zmienność. Skorupka może mieć barwę czysto białą albo różowawą lub białą, jasnoszarą lub jasnoniebieską i pokrytą w różnym stopniu różowymi lub czerwonymi wzorkami. Na niektórych występują podobne do śladu długopisu znaczki, na innych – duże, czekoladowobrązowe plamy[19]. Mimo rozmaitości ubarwienia skorupki można z grubsza wyodrębnić trzy typy jaj: czysto białe, pośrednie i plamkowane, przy czym to w trzecim typie występują najbardziej zróżnicowane skorupki. Czysto białe jaja M. bonariensis odnotowywano we wschodniej Argentynie, Urugwaju i południowo-wschodniej Brazylii (gdzie ich odsetek sięga 50%) i zdają się nie występować nigdzie indziej w Ameryce Południowej, z wyjątkiem południowo-zachodniego Ekwadoru i obszarów skolonizowanych przez starzyki granatowe w XX wieku (Karaiby)[27]. Według danych z 1929 wymiary jaj wynoszą 20–26 na 18–22 mm[19]. Wzorzystość skorupki nie jest dziedziczona po matce na chromosomie W – nie występuje korelacja między haplotypem a występowaniem wzoru na skorupce[27]. Przynajmniej w Argentynie i Urugwaju gospodarze mogą akceptować jaja o czystej skorupce i o plamkowanej skorupce lub wyłącznie te o plamkowanej skorupce[28]. Starzyki granatowe nakłuwają dziobem jaja innych ptaków, zarówno tych pasożytowanych, jak i niepasożytowanych[29].
Szacunkowo podczas jednego sezonu lęgowego samica składa od 60 do 120 jaj[19]. Dla porównania spokrewnione starzyki brunatnogłowe w Kanadzie podczas krótkiego sezonu lęgowego składają łącznie do 40 jaj. Ewentualny związek dużej płodności samic starzyków granatowych z morfologią ich układu rozrodczego był przedmiotem badań; nie odnaleziono jednak żadnych unikatowych cech morfologicznych, które wiązałyby się z produkcją tak dużej liczby jaj[30]. Okres inkubacji trwa od 11 do 13 dni. Pisklęta porośnięte są czarniawym puchem. Wnętrze dzioba czerwonawe[19]. Przeżywalność piskląt jest tym większa, im mniejsza jest masa ciała piskląt gospodarza, jako że u gatunków, gdzie jest ona stosunkowo duża, występuje intensywniejsza konkurencja o pokarm między potomstwem. Badano rozmiary jaj i rozwój piskląt starzyków granatowych w Reserva El Destino (prowincja Buenos Aires, Argentyna) w przypadku dwóch gospodarzy o różnej masie, większej i mniejszej od starzyków: przedrzeźniaczy białobrewych (Mimus saturninus; masa ciała: 70–75 g) i strzyżyków śpiewnych (Troglodytes aedon; masa ciała: 12–13 g). Jaja starzyków w gniazdach przedrzeźniaczy były większe niż w gniazdach strzyżyków. Młode samce rosły szybciej od samic. W 9. dniu życia masa piskląt płci męskiej wynosiła 41,2 ± 1,6 g (n=13), zaś masa samic w tym wieku 35,9 ± 1,2 g (n=12; później nie była już mierzona)[31]. Po 3 dniach ukazują się osłonki przyszłych lotek. 4. dnia życia pisklętom starzyków granatowych otwierają się oczy, zaś 5. dnia są już całkowicie otwarte[21]. Dymorfizm płciowy przejawiający się w masie ciała można zauważyć już w 7. dniu życia piskląt[32]. Według danych z 1929 przeważnie młode starzyki granatowe opuszczają gniazdo po 10 dniach życia[21].
Badania pokazują, że samice pasożytniczych starzyków mają większy hipokamp niż niepasożytnicze podgatunki. Prawdopodobnie ułatwia im to lokalizowanie i oszacowanie jakości gniazd gospodarzy. Uważa się też, że zmiany te występują jedynie sezonowo w okresie lęgowym[19].
Status
IUCN uznaje starzyka granatowego za gatunek najmniejszej troski (LC, Least Concern) nieprzerwanie od 1988 (stan w 2020). BirdLife International ocenia trend populacji jako wzrostowy ze względu na ekspansję gatunku w kierunku Karaibów, Ameryki Centralnej i Stanów Zjednoczonych[33].
Starzyk granatowy uwzględniony jest w Global Invasive Species Database[19]. Ich populacja stale wzrasta, co może stanowić zagrożenie dla innych gatunków ptaków, które nigdy wcześniej nie miały do czynienia z pasożytnictwem lęgowym[33]. Pasożytnictwo ze strony starzyków granatowych było główną przyczyną gwałtownego spadku liczebności epoletników lagunowych (Agelaius xanthomus) w latach 40. i 50. XX wieku. Między latami 1974–1975 a 1981–1982 liczebność ich populacji w południowo-zachodnim Portoryko zmniejszyła się o około 80%, spadając z około 2000 osobników w 1974 do blisko 300 w 1982. Prowadzony był program zakładający m.in. wyłapywanie starzyków granatowych i zabijanie ich. Zwiększyła się populacja epoletników, ponadto zasiedliły nowe obszary, nieobjęte programem[34]. W latach 90. XX wieku pojawienie się populacji starzyków w Meksyku spowodowało ich konflikt i zagrożenie dla endemicznych gatunków[35]. Wśród ptaków z Trynidadu i Tobago przedmiotem badań nad wpływem starzyków granatowych na sukces lęgowy stały się ciemnokacyki żółtogłowe (Chrysomus icterocephalus); negatywny wpływ był jednak minimalny[36].
Starzyk granatowy był jednym z gatunków ptaków, na których testowano toksyczność i potencjalne zagrożenie 998 różnych substancji chemicznych. Dostarczyło to wiele wiedzy na temat poziomu zachorowalności i pozwoliło oszacować średni czas rozprzestrzeniania się epidemii pośród ptaków[37].
Przypisy
- ↑ Molothrus bonariensis, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ a b c d F. Gill, D. Donsker & P. Rasmussen (red.): Oropendolas, orioles, blackbirds. IOC World Bird List (v10.2). [dostęp 2021-01-03]. (ang.).
- ↑ Molothrus bonariensis, [w:] The IUCN Red List of Threatened Species [online] (ang.).
- ↑ Systematyka i nazwy polskie za: P. Mielczarek & M. Kuziemko: Podrodzina: Agelaiinae Swainson, 1832 - epoletniki (wersja: 2020-01-11). [w:] Kompletna lista ptaków świata [on-line]. Instytut Nauk o Środowisku Uniwersytetu Jagiellońskiego. [dostęp 2021-01-03].
- ↑ Johann Friedrich Gmelin: Systema naturae. T. 1, pt. 2. 1789, s. 898.
- ↑ James A. Jobling: Helm Dictionary of Scientific Bird Names. Christopher Helm Publishers Ltd, 2009, s. 74. ISBN 1-4081-2501-3.
- ↑ a b c d e f g h i j k Fraga, R: Shiny Cowbird (Molothrus bonariensis). [w:] del Hoyo, J., Elliott, A., Sargatal, J., Christie, D.A. & de Juana, E. (eds.). Handbook of the Birds of the World Alive [on-line]. 2016. [zarchiwizowane z tego adresu (19 listopada 2016)].
- ↑ Jan Sztolcman. Étude des collections ornithologiques de Paraná. „Ptaki zebrane w Paranie. Prace zoologiczne Polskiego Państwowego Muzeum Przyrodniczego”. V, s. 135, 1926.
- ↑ A new race of Molothrus bonariensis from Brazil. „The Auk”. 44. s. 494.
- ↑ L. Griscom & J.C. Greenway. Critical notes on new Neotropical Birds. „Bulletin of the Museum of Comparative Zoology at Harvard College”. 81, s. 434–435, 1937.
- ↑ F. M. Chapman. Diagnoses of apparently new Colombian birds. „Bulletin of the American Museum of Natural History”. 34, s. 661–662, 1915.
- ↑ Raymond de Dalmas. Note sur une collection d’oiseaux de l’ile de Tobago. „Mémoires de la Société zoologique de France”. 13, s. 138, 1900.
- ↑ Hans von Berlepsch & Jan Stolzmann. Résultats des recherses ornithologiques faites au Pérou par M. Jean Kalinowski. „Proceedings of the Zoological Society of London”, s. 378, 1892.
- ↑ Witmer Stone. A Revision of the Species of Molothrus allied to M. Bonariensis (Gm.). „The Auk”. 8, s. 347, 1891.
- ↑ John Cassin. A study of the Icteridæ. „Proceedings of the Academy of Natural Sciences of Philadelphia”. 18, s. 22–23, 1866.
- ↑ a b c Daniel A. Kluza. First Record of Shiny Cowbird (Molothrus bonariensis) in Yucatán, Mexico. „The Willson Bulletin”. 110 (3), s. 429–430, 1998.
- ↑ Michael E. Baltz. First Records of the Shiny Cowbird (Molothrus bonariensis) in the Bahama Archipelago. „The Auk”. 112 (4), s. 1039–1041, 1995.
- ↑ a b c d e f Robert S. Ridgely, Tudor Guy: The Birds of South America. T. 1. The Oscine Passerines. University of Texas Press, 1989, s. 354. ISBN 978-0-292-70756-6.
- ↑ a b c d e f g Species profile: Molothrus bonariensis. [w:] Global Invasive Species Database [on-line]. 2021. [dostęp 2021-01-03].
- ↑ Verónica Crespo-Pérez, C. Miguel Pinto, Juan Manuel Carrión, Rubén D. Jarrín-E, Cristian Poveda & Tjitte de Vries. The Shiny Cowbird, Molothrus bonariensis (Gmelin, 1789) (Aves: Icteridae), at 2,800 m asl in Quito, Ecuador. „Biodiversity Data Journal”. 4, 2016.
- ↑ a b c d e f Peter E. Lowther: Molothrus bonariensis. Identification, Distribution, Life History. [w:] Neotropical Birds Online [on-line]. Cornell Lab of Ornithology, 2011. [dostęp 2016-12-18]. [zarchiwizowane z tego adresu (2016-12-20)].
- ↑ Juan Pablo Isacch. Nectarivorous Feeding by Shiny Cowbirds: a Complex Feeding Innovation. „Willson Bulletin”. 114 (3), s. 412–414, 2002.
- ↑ Peter E. Lowther: Lists of victims and hosts of the parasitic cowbirds (Molothrus). Muzeum Historii Naturalnej w Chicago, 26 sierpnia 2013. [dostęp 2016-11-19].
- ↑ Adrián B. Azpiroz. Shiny Cowbird (Molothrus bonariensis) Parasitism Records for Three Globally Threatened Species from the South American Pampas. „The Wilson Journal of Ornithology”. 127 (4), s. 746-752, 2015. DOI: 10.1676/15-007. JSTOR: 24640585.
- ↑ Gustavo H. Kattan, Anamaría Posada, Diego Fernando Arenas, José Luis Moreno & Ángela Barrera. Flocking Behavior of Shiny Cowbirds (Molothrus bonariensis) At Feeding Areas During the Daily Cycle. „The Wilson Journal of Ornithology”. 128 (2), s. 441–445, 2016. DOI: 10.1676/1559-4491-128.2.441.
- ↑ Diego T. Tuero, Vanina D. Fiorini & Juan C. Reboreda. Effects of Shiny Cowbird Molothrus bonariensis parasitism on different components of House Wren Troglodytes aedon reproductive success. „Ibis”. 149, s. 521–529, 2007.
- ↑ a b Bettina Mahler; Viviana A. Confalonieri; Irby J. Lovette; Juan C. Reboreda. Eggshell spotting in brood parasitic shiny cowbirds (Molothrus bonariensis) is not linked to the female sex chromosome. „Behavioral Ecology and Sociobiology”. 62 (7), s. 1193–1199, 2008. DOI: 10.1007/s00265-008-0548-x.
- ↑ Paul Mason. Brood parasitism in a host generalist, the Shiny Cowbird: I. The quality of different species as hosts. „The Auk”. 103, s. 52–60, 1986.
- ↑ Andrea A. Astié & Juan C. Reboreda. Costs of egg punctures and parasitism by Shiny Cowbirds (Molothrus bonariensis) at Creamy-bellied thrush (Turdus amaurochalinus) nests. „The Auk”. 123, s. 23–32, 2006. DOI: 10.1093/auk/123.1.23.
- ↑ Pamela Rueda-Cediel; Gustavo Kattan; Martha Patricia Ramírez-Pinilla. Ovarian and oviductal morphology of a brood parasitic bird, Molothrus bonariensis (Passeriformes, Icteridae). „Acta Zoologica”. 89 (3), s. 261–276, 2008. DOI: 10.1111/j.1463-6395.2007.00315.x.
- ↑ Diego T. Tuero, Vanina D. Fiorini, Bettina Mahler & Juan C. Reboreda. Shiny cowbird Molothrus bonariensis egg size and chick growth vary between two hosts that differ markedly in body size. „Journal of Avian Biology”. 43, s. 1–7, 2012. DOI: 10.1111/j.1600-048X.2012.05596.x.
- ↑ Diego T. Tuero, Vanina D. Fiorini, Bettina Mahler, Juan C. Reboreda. Do sex ratio and development differ in sexually size-dimorphic shiny cowbirds (Molothrus bonariensis) parasitizing smaller and larger hosts?. „Biological Journal of the Linnean Society”. 110 (2), s. 442–448, 2013. DOI: 10.1111/bij.12130.
- ↑ a b Shiny Cowbird Molothrus bonariensis. BirdLife International. [dostęp 2016-11-19].
- ↑ Alexander Cruz, Ricardo López-Ortiz, Eduardo A. Ventosa-Febles, James W. Wiley, Tammie K. Nakamura, Katsi R. Ramos-Alvarez & William Post. Ecology and Management of Shiny Cowbirds (Molothrus bonariensis) and Endangered Yellow-Shouldered Blackbirds (Agelaius xanthomus) in Puerto Rico. „Ornithological Monographs”. 57, s. 38–44, 2005.
- ↑ First record of Shiny Cowbird (Molothrus bonariensis) in Yucatan, Mexico - ProQuest, search.proquest.com [dostęp 2018-04-03] (pol.).
- ↑ Alexander Cruz, Timothy H. Manolis, Robert W. Andrews. History of Shiny Cowbird Molothrus bonariensis brood parasitism in Trinidad and Tobago. „Ibis”. 137, s. 317–321, 1995. DOI: 10.1111/j.1474-919X.1995.tb08027.x.
- ↑ E.W. Schafer, W.A. Bowles, J. Hurlbut, The acute oral toxicity, repellency, and hazard potential of 998 chemicals to one or more species of wild and domestic birds, „Archives of Environmental Contamination and Toxicology”, 12 (3), 1983, s. 355–382, DOI: 10.1007/BF01059413, ISSN 0090-4341 [dostęp 2018-04-03] (ang.).
Linki zewnętrzne
- Zdjęcia i nagrania audiowizualne. [w:] eBird [on-line]. Cornell Lab of Ornithology. (ang.).
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor: , Licencja: CC BY-SA 4.0
Egg of shiny cowbird in a clutch of austral blackbird ; collection of Jacques Perrin de Brichambaut.
Autor: Charles J Sharp , Licencja: CC BY-SA 4.0
Shiny cowbird (Molothrus bonariensis) male
A Yellow-shouldered blackbird in Puerto Rico
Autor: Cephas, Licencja: CC BY-SA 3.0
Distribution map of Shiny Cowbird. Adapted from: Jaramillo, Alvaro and Peter Burke, New World Blackbirds, Christopher Helm, London, 1999, 431 p. (ISBN 0713643331) (OCLC 40798493)
Autor: Dario Sanches from São Paulo, Brazil, Licencja: CC BY-SA 2.0
Shiny Cowbird(Molothrus bonariensis) chick being fed by adult (Zonotrichia capensis ). Parque da Independência, Museu do Ipiranga, São Paulo.
Este é um Vira-Bosta sendo criado pelo Tico-Tico.









