Stwardnienie zanikowe boczne-parkinsonizm/zespół otępienny
Stwardnienie zanikowe boczne-parkinsonizm/zespół otępienny (stwardnienie zanikowe boczne zachodniego Pacyfiku, ang. amyotrophic lateral sclerosis-parkinsonism/dementia complex (of Guam), Guam disease, Lytico-Bodig disease, Western Pacific amyotrophic lateral sclerosis-parkinsonism/dementia complex) – choroba neurodegeneracyjna o niewyjaśnionej etiologii.
Choroba może przyjmować dwie postaci, często występujące obok siebie u członków tej samej rodziny lub u jednej osoby: podobną do stwardnienia zanikowego bocznego (ang. amyotrophic lateral sclerosis, ALS) i podobną do choroby Parkinsona z cechami otępienia.
Choroba jest szczególnie częsta u plemienia Czamorro zamieszkującego wyspę Guam, w którego języku pierwsza z postaci choroby nazywana była lytico, a druga – bodig. Chorobę opisano również na półwyspie Kii w Japonii, gdzie określana była jako choroba Murō, i w zachodniej części Nowej Gwinei (Irian Jaya).
W patogenezie schorzenia postulowano udział neurotoksyn sagowca Cycas circinalis (C. micronesica), zwłaszcza β-metylamino-L-alaniny (BMAA), zawartej także w mięsie żywiących się nasionami sagowca nietoperzy. Być może predyspozycja do niej uwarunkowana jest mutacjami w genie TRPM7 kodującym białko kanału jonowego.
Nazewnictwo i klasyfikacja
Stwardnienie zanikowe boczne-parkinsonizm/zespół otępienny (ang. amyotrophic lateral sclerosis-parkinsonism/dementia complex, ALS/PDC) – jednostka chorobowa przyjmująca obraz kliniczny dwóch zespołów, które mogą występować łącznie lub oddzielnie: stwardnienia zanikowego bocznego (amyotrophic lateral sclerosis) i parkinsonizmu z otępieniem (parkinsonism–dementia complex, PDC). Gdy u danego pacjenta choroba manifestuje się tylko jednym zespołem, rozpoznanie zazwyczaj poprzedzane jest w piśmiennictwie angielskim przymiotnikiem Guamanian (Guamanian parkinsonism–dementia complex, G-PDC i Guamanian ALS, G-ALS).
Według nowych wytycznych rozpoznawania ALS (El Escorial Revisited, 1998[1][2]) ALS/PDC (G-ALS) zaliczane jest do zespołów ALS-plus, czyli o typowym obrazie klinicznym ALS z równoległymi objawami innego zespołu neurologicznego. Analogicznie, ALS/PDC (G-PDC) spełnia część kryteriów dla zespołów parkinsonizm-plus (równoległy inny zespół neurologiczny, zła odpowiedź na lewodopę, niekorzystne rokowanie)[3]. Inna nazwa tej grupy chorób to parkinsonizm atypowy (atypical parkinsonism disorders); ALS/PDC należy tu obok zaniku wieloukładowego, postępującego porażenia nadjądrowego, zwyrodnienia korowo-podstawnego czy parkinsonizmu karaibskiego[4].
Ze względu na obecność zwyrodnienia neurofibrylarnego w większości przypadków ALS/PDC, choroba zaliczana jest do grupy tauopatii[5].
ALS/PDC znajduje się w katalogu Mendelian Inheritance in Man z przypisanym kodem [MIM#105500], ponieważ istnieją dowody na genetyczne uwarunkowanie choroby i jej dziedziczenie autosomalne dominujące[6].
Historia
Stwardnienie zanikowe boczne zostało opisane przez Jeana-Martina Charcota i Alexisa Joffroya w 1869 roku[7]. Choroba w następnych dziesięcioleciach była szczegółowo badana. Jeden z uczniów Charcota, japoński neurolog Kinnosuke Miura, badał ALS w swojej ojczyźnie i w 1911 roku stwierdził niezwykle wysoką zachorowalność wśród ludności półwyspu Kii na wyspie Honsiu[8]. Prace Miury i obserwacje innych lekarzy (najstarsze przekazy o endemicznej chorobie w okolicach miasta Muro pochodzą z 1689 roku[9]) powiązano z chorobą Guam w latach 60.
Do początku XX wieku nieznane są przekazy świadczące o występowaniu szczególnych chorób (poza trądem) na wyspie Guam. Jeszcze w 1902 roku amerykański wicegubernator William Safford odnotował, że mieszkańcy „nie mają żadnych chorób ani wad wrodzonych, i dożywają sędziwego wieku”[10][11]. Z 1904 roku pochodzą jednak trzy pierwsze świadectwa zgonu, w których mowa jest o nieokreślonej postaci paraliżu. Liczba zgonów rosła i w 1940 roku choroba była pierwszą przyczyną zgonów na Guam. Po II wojnie światowej lekarz US Navy Harry Zimmerman autopsyjnie potwierdził rozpoznanie choroby jako stwardnienia zanikowego bocznego i zauważył jego szczególną częstość wśród Guamczyków[12]. Raport Zimmermanna powstał na potrzeby armii amerykańskiej i dopiero pod koniec lat 50. został szerzej udostępniony[13]. W 1952 Koerner[14] i rok później Arnold i wsp.[15] jako kolejni opisali dużą częstość stwardnienia zanikowego bocznego w populacji Czamorro. Obserwacje te potwierdzili Tillema i Wijnberg[16], Kurland i Donald Mulder[17][18][19], oraz Mulder i wsp[20]. Według Kurlanda i Muldera częstość ALS na Guam w 1954 roku była 50 do 100 razy wyższa niż w innych populacjach na całym świecie[17]. Ponadto opisano w tym czasie pierwsze przypadki pacjentów z parkinsonizmem niekiedy towarzyszącym otępieniu[20]. W 1956 roku powstał na wyspie Guam National Institute of Neurological Diseases and Blindness (NINDB), będący agendą National Institutes of Health, mającą na celu zbadanie choroby. Asao Hirano i wsp. opisali kliniczny i neuropatologiczny obraz choroby – uznanej przez nich za samodzielną jednostkę – parkinsonizm-otępienie (parkinsonism-dementia complex, PDC)[21][22]. Zarówno ALS jak i PDC miały postępujący przebieg i prowadziły do śmierci, nierzadko występując obok siebie w jednej rodzinie, a nawet u tego samego pacjenta.
W 1997 roku amerykański neurolog Oliver Sacks przedstawił tę chorobę w popularnonaukowej książce The Island of the Colorblind and Cycad Island (A.A. Knopf, ISBN 978-0-676-97035-7; tłum. polskie Wyspa daltonistów i wyspa sagowców Zysk i S-ka, 2000 ISBN 83-7150-673-2)[13].
Epidemiologia

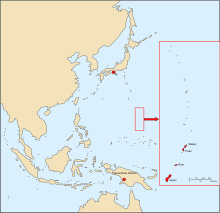
Do dziś zidentyfikowano trzy ogniska endemicznego występowania choroby: na wyspie Guam i kilku mniejszych wyspach archipelagu Marianów, japońskim półwyspie Kii i w zachodniej części Nowej Gwinei (Irian Jaya).
Choroba została pierwotnie opisana u Czamorro zamieszkujących Guam, szczególnie często w wiosce Umatac na południu wyspy. Czamorro nazywają ją czasem chetnut Humatac (choroba z Umatac)[13]. Między 1940 a 1965 rokiem lytico-bodig była najczęstszą przyczyną zgonów Guamczyków. Opisywano ją niemal wyłącznie u rdzennych mieszkańców wyspy[11]. Około 40% z nich miało dodatni wywiad rodzinny w kierunku choroby[14][17]. Badania przeprowadzone na imigrantach z Filipin i na Czamorro, którzy wyemigrowali do Kalifornii wykazały, że u części z nich również po kilku-kilkunastu latach rozwijały się objawy lytico-bodig.
Badania epidemiologiczne przeprowadzone na początku lat 80. na innych wyspach archipelagu (Rota, Tinian, Saipan, Anatahan, Alamagan, Pagan i Agrihan) doprowadziły do rozpoznania 9 przypadków (w populacji około 17 000 ludzi) i dodatkowo 22 przypadków w badaniach retrospektywnych (opartych o świadectwa zgonu, kartoteki szpitalne i wcześniejsze badania); wszystkie na pierwszych trzech wyspach[24].
W 1962 roku Carleton Gajdusek, odkrywca kuru, opisał podobną do lytico chorobę wśród członków plemion Jakai i Auyu w zachodniej Papui-Nowej Gwinei[25][26][27][28][29]. Gajdusek opisał 97 przypadków ALS, 19 przypadków PD i 18 przypadków ostrego zapalenia korzeni rdzeniowych; średni wiek wystąpienia objawów wynosił w tych grupach pacjentów, odpowiednio: 33, 43, i 26 lat; badana populacja liczyła około 7000 ludzi. Nie stwierdzono różnic ekologicznych, kulturowych czy w diecie Auyu i Jakai w porównaniu z sąsiednimi plemionami[29]. Badania przeprowadzone pod koniec lat 80. wykazały również spadkową tendencję w występowaniu choroby[30].
Kiyoshi Kimura i Yoshiro Yase zidentyfikowali w Japonii trzecie ognisko występowania choroby, u mieszkańców Hobara i Kozagawa na półwyspie Kii w południowej części wyspy Honsiu[9][31]. W latach 70. wśród mieszkańców Kozagawa i Hobara roczna zachorowalność wynosiła odpowiednio 15:100 000 i 50:100 000, w porównaniu z 0,3-0,4:100 000 dla reszty Japonii[31]. Liczba zachorowań zaczęła spadać w latach 80. w Kozugawa, gdzie ostatni pacjent zmarł w 1981, jednak w Hobara współczynnik zachorowalności był wciąż wysoki.
W ostatnich 30 latach obserwuje się także stopniowe zmniejszanie zapadalności na ALS-PDC na Guam. Roczna zapadalność rzędu 70:100 000 opisywana w latach 60. spadła do 7:100 000 w latach 90., i od 15 lat pozostaje na tym samym poziomie[32].
Wykres 1. Średnia zapadalność roczna (/100 000) na ALS u guamańskich kobiet (czerwony) i mężczyzn (niebieski) w latach 1940-1999[33].
Wykres 2. Średnia zapadalność roczna (/100 000) na PDC u guamańskich kobiet (czerwony) i mężczyzn (niebieski) w latach 1940-1999[33].
Etiologia
Czynniki genetyczne
Dodatni wywiad rodzinny u około 70% japońskich i u 80% guamańskich pacjentów z ALS/PDC sugeruje istnienie predyspozycji genetycznych do zachorowania. Wykluczono u nich mutacje w genie SOD1, odpowiadające za około 20% rodzinnych przypadków klasycznego ALS[34]. W jednym badaniu u dwóch pacjentów z Kii stwierdzono heterozygotyczność względem punktowej mutacji I113T (zmiana izoleucyny na treoninę) w genie SOD1[35].
Dziedziczenie choroby odbiega jednak od typowych wzorców (jest niemendlowskie); występowanie przypadków w każdym pokoleniu odpowiada dziedziczeniu autosomalnie dominującemu, podczas gdy pokrewieństwo rodziców jest typowe dla dziedziczenia autosomalnego recesywnego. Proponowano, że dziedziczenie jest autosomalne dominujące z niską penetracją lub autosomalne recesywne z dużą częstością zmutowanego allelu w populacji (dziedziczenie pseudodominujące)[36]. Jak dotąd, metodami analizy sprzężeń i przez badanie znanych mutacji w genie TAU nie wykazano związku ALS/PDC z polimorfizmami ani mutacjami tego genu. Nie wykluczono możliwości, że mutacje lub polimorfizmy TAU w połączeniu z mutacjami innego genu mogą zwiększać prawdopodobieństwo rozwoju choroby[37].
Niedawno wykazano związek ALS/PDC z mutacją punktową T1482I w genie TRPM7 kodującym białko kanału jonowego. Wariant ten został wykryty u 5 z 22 przebadanych pacjentów z ALS/PDC i u żadnego z 23 zdrowych członków plemienia Czamorro[38].
Czynniki zakaźne
Jak dotąd, nie udowodniono udziału czynników infekcyjnych w patogenezie ALS/PDC. Zarzucone hipotezy proponowały jako przyczynę choroby:
- priony (określane wówczas jako powolne wirusy, slow viruses)[39][40]
- wirus HTLV-I[41]
- neurowirulentny wirus grypy[42]
- togawirusy[43]
- zapalenia mózgu[44], m.in. japońskie zapalenie mózgu (epidemia japońskiego zapalenia mózgu miała miejsce w 1947-1948 roku na Guam[45][46]).
Czynniki środowiskowe
Ponadto niemal na pewno w patogenezie ALS/PDC biorą udział lokalne czynniki środowiskowe występujące na Guam. Proponowano, że są to:
- nadmiar jonów glinu[47]
- niedobór magnezu
- niedobór wapnia (zaburzenia metabolizmu wapnia/witaminy D[48])
- wtórna nadczynność przytarczyc spowodowana niedoborem wapnia[49]
- neurotoksyny morskie (ciguatoksyny)
- neurotoksyny produkowane przez symbiotyczne cyjanobakterie sagowców Cycas circinalis (C. micronesica).
Hipoteza sagowcowa

Hipoteza sagowcowa (cycad hypothesis) jest obecnie najpopularniejsza i intensywnie weryfikowana; spopularyzował ją Oliver Sacks w książce The Island of the colour-blind and Cycad Island. Pojawiła się po raz pierwszy w pracy Muldera, Kurlanda i Iriate z 1954 roku[20].
W stanowiącej tradycyjny składnik guamańskiej kuchni mące (w języku czamorro fadang lub federico[11]) sporządzanej z nasion sagowców znajdują się niewielkie ilości neurotoksyn, takich jak aminokwas β-metylamino-L-alanina (BMAA)[50][51][52]. Mąka sagowców była spożywana szczególnie często w żyjących zgodnie z tradycją osadach na południu wyspy (np. w Umatac) i w okresach braku innego pożywienia, po przejściach tajfunów i w okresie japońskiej okupacji. W latach 80. rozpowszechniono na Guam informację o niebezpieczeństwie związanym ze spożywaniem przetworów sagowców, w związku z czym fadang jest tam już prawie nie jadany[13].
Zespół objawów spowodowanych ostrym zatruciem neurotoksynami sagowców znany jest od stuleci, ale do jego rozwinięcia się niezbędne jest spożycie dużej ilości świeżych osnówek nasion lub soku sagowców. Zaproponowano więc, że objawy neurologiczne wynikają z przewlekłej ekspozycji na nie. Doświadczalnie wykazano, że zespół neurologiczny zbliżony do ALS rozwija się u małp którym podawano duże ilości pokarmu zawierającego BMAA[53].

Przeciwko hipotezie sagowcowej przemawiały przede wszystkim małe ilości BMAA w mące fadang. Obliczono, że ekwiwalent dawki wywołującej objawy neurologiczne u małp zawarty jest w 1500 kg przetworzonej mąki, spożytej w przeciągu 12 tygodni. Czamorro unikali zatrucia toksynami sagowców, dokładnie myjąc owoce roślin, tak że BMAA często była nieobecna w posiłku. Poza tym, objawy u małp bardziej przypominały zespół ostrego zatrucia sagowcem niż lytico[13]. Początkowo podnoszono również argument braku ekspozycji na toksyny sagowców w Japonii i Nowej Gwinei, ale badania przeprowadzone pod koniec lat 80. udowodniły, że tamtejsi mieszkańcy wykorzystują sagowce jako źródło pożywienia lub w innych celach[54][55].
Doświadczalnie wykazano, że związki te mogą się kumulować w tkankach również spożywanych przez tubylców owocożernych nietoperzy (rudawek z rodzaju Pteropus)[56][57][58]. Przebadane na stężenie BMAA w tkankach ciała nietoperzy wykazywały bardzo wysokie koncentracje wolnej, niezwiązanej z białkami BMAA. Na Guam występowały dwa gatunki nietoperzy: mniejszy Pteropus tokudae i większy P. mariannus. Przed II wojną światową mięso tych nietoperzy (w języku czamorro fanihi) gotowane w mleku kokosowym było rzadką potrawą, jadaną na specjalne okazje; nietoperze przyrządzone w ten sposób były jadane w całości, włącznie ze skórą i włosami[11]. Odświętny charakter potrawy wynikał z trudności w polowaniu, przebiegającym tradycyjnie z użyciem sieci zarzucanej od góry na śpiące nietoperze. Po II wojnie Guamczycy mogli przeprowadzać polowania przy użyciu broni palnej, co znacznie zwiększyło ilość upolowanych zwierząt i wkrótce drastycznie ograniczyło ich populację. Udział w wyginięciu nietoperzy miały też węże Boiga irregularis, za których sprawą na wyspie wymarły wszystkie ptaki[13]. Ostatni osobnik P.tokudae został zabity w 1968 roku[59], a niewielka kolonia zagrożonego wymarciem P. mariannus żyje na terenie zamkniętej amerykańskiej bazy wojskowej na Guam. Pomiary stężeń BMAA w tkankach nietoperzy przeprowadzono w 2003 roku na 50-letnich egzemplarzach muzealnych. Potrawka z nietoperzy nadal jest elementem tradycyjnej kuchni guamańskiej, ale sporządza się ją z importowanych z Samoa zwierząt, nie żywiących się nasionami sagowców[11].
Innym wytłumaczeniem mogą być praktyki Czamorro leczenia dużych owrzodzeń skóry roztartymi nasionami sagowca. Ten sposób leczenia jest coraz mniej popularny u Guamczyków, co wyjaśniałoby spadek zachorowań[55]. Stosowanie nasion sagowców (kurru) na duże rany obserwowano też i wiązano z objawami neurologicznymi u Papuasów[30], a doustne – u pacjentów z Kii[54].
Według symulacji komputerowych, włączenie BMAA, która jest niebiałkowym aminokwasem, do łańcucha dysmutazy ponadtlenkowej SOD-1 zamiast seryny, zmienia jego kształt, co ostatecznie skutkuje niszczeniem neuronów[60]
Objawy i przebieg
Chorobę charakteryzuje zmienność obrazu klinicznego. Może przyjmować postać uszkodzenia neuronu ruchowego (lytico), a także parkinsonowskiego drżenia i otępienia, jak w chorobie Alzheimera (bodig). Postać łączącą cechy parkinsonizmu i demencji określa się jako Parkinson-dementia complex (PDC).
Postać ALS jest nieodróżnialna od sporadycznej choroby Lou Gehriga. Choroba ma późny początek i zwykle ujawnia się między 25. a 40. rokiem życia. Występują objawy uszkodzenia górnego i dolnego neuronu ruchowego.
Pacjenci z bodig są średnio o 10 lat starsi od pacjentów z lytico. Występują takie objawy, jak trudność w przejęciu inicjatywy, np. brak woli samodzielnego zaczęcia odezwania się. Wczesnym objawem są zaburzenia chodu[61]. U części pacjentów obserwuje się ciężkie otępienie, dyzartria i dysfagia, spastyczność mięśni kończyn, niekiedy z przykurczami. Częsta jest anosmia[62]. Akinezja jest bardzo ciężka, połączona czasem z delikatnym intermitującym drżeniem i sztywnością, przypomina katatonię lub zapalenie mózgu von Economo.
Objawy parkinsonowskie u pacjentów z ALS/PDC to zaburzenia snu, stupor, spowolnienie ruchowe i umysłowe, niekiedy drżenie i sztywność, czasem ślinotok i nadmierne pocenie. Około 50% pacjentów z lytico-bodig ma charakterystyczne zmiany siatkówki, widoczne w oftalmoskopii pośredniej[63][64][65][66]; analogiczne zmiany stwierdzono w jednym badaniu u 33% japońskich pacjentów z ALS/PDC[67].
Oliver Sacks tak opisywał pacjentów z różnymi postaciami choroby[13]:
Estella natychmiast zwróciła na siebie moją uwagę, ponieważ bardzo przypominała jednego z moich pacjentów po zapaleniu mózgu; stała nieruchomo jak posąg, z jedną ręką wyciągniętą, z głową odchyloną do tyłu i z takim wyrazem twarzy, jakby była w transie. Można było poruszać jej rękami, układając je w dowolnej pozycji, która ona potem utrzymywała całymi godzinami pozornie bez wysiłku. Gdyby zostawić ją w spokoju, stałaby bez ruchu jak zaczarowana, patrząc przed siebie nieruchomym wzrokiem i śliniąc się. Ale kiedy się do niej odezwałem, odpowiedziała mi jak najbardziej sensownie i rozumnie; potrafiła jasno myśleć i mówić pod warunkiem, że ktoś dał ku temu bodziec. Mogła też pójść z kimś na zakupy czy do kościoła, zawsze uprzejma i uważna, chociaż poruszająca się powoli, jakby była zajęta jakimiś myślami albo jakby szła, śpiąc [...][68].
Reakcje na lewodopę u pacjentów często są bardzo gwałtowne:
Była godzina czternasta; zakonnica powiedziała, że czas podać lekarstwo. Przyniosła Euphrasii [...] maleńką pastylkę i trochę wody. Czternaście minut po przyjęciu l-dopy [...] poderwała się nagle na nogi z taką siłą, że krzesło się przewróciło i odsunęło w stronę korytarza, i zaczęła mówić z ożywieniem, hałaśliwie, chcąc powiedzieć to wszystko, czego nie mogła wyrazić, kiedy była nieruchoma. Znikł jej parkinsonizm i problemy motoryczne, ale nie tylko to – jej zmysły, uczucia i całe zachowanie uległy zmianie. Nie widziałem czegoś podobnego od dwudziestu lat i byłem zarazem zaskoczony (chociaż do pewnego stopnia spodziewałem się podobnej reakcji), jak i rozrzewniony – Euphrasia przypominała mi moją pacjentkę po przebytym zapaleniu mózgu, Hester, u której występowała podobna błyskawiczna zmiana, bez stanu pośredniego, bez żadnego okresu rozruchu. [...] Wraz z pobudzeniem motorycznym, z wesołością, która nagle ją ogarnęła, pojawiła się skłonność do dowcipkowania, do tików, do nagłych spojrzeń i dotknięć, do potrząsania ciałem i gwałtownych ruchów naprzód, do wygadywania głupstw i wykonywania ręką niespodziewanych pchnięć, do wielu dziwnych impulsów, do nadmiernej aktywności ciała i umysłu. [...] dwadzieścia minut później nastąpił powrót do poprzedniego stanu, powiązany z serią ziewnięć i w końcu z letargiem[69].
Obraz neuropatologiczny
Neuropatologia schorzenia u pacjentów z Kii i Guam jest podobna; chorzy z Papui-Nowej Gwinei opisani przez Gajduska nie byli badani neuropatologicznie. Jedną z cech ALS/PDC są splątki neurofibrylarne (ang. neurofibrillary tangles, NFT), znajdywane w ciałach uszkodzonych neuronów, zwłaszcza czołowo-skroniowej kory nowej, formacji hipokampa, kory entorynalnej, jąder podstawy, jądra Meynerta, wzgórza, niskowzgórza, istoty czarnej, miejsca sinawego i istoty szarej okołowodociągowej[22]. Splątki neurofibrylarne spotykane są też w wielu innych chorobach neurodegeneracyjnych, takich jak choroba Alzheimera (AD) czy postępujące porażenie nadjądrowe (choroba Steele’a-Richardsona-Olszewskiego, PSP); znajdywane są w klasycznej postaci ALS, ale w znacznie mniejszej ilości. Właściwości immunohistochemiczne, biochemiczne i ultrastrukturalne NFTs w ALS/PDC są podobne, jak w chorobie Alzheimera. Różnicujące jest rozmieszczenie NFT, które u pacjentów z ALS/PDC występują przede wszystkim w warstwach II i III kory, są natomiast rzadko rozmieszczone w warstwach V i VI, odwrotnie niż w AD[70][71][72]. Immunohistochemicznie wykazano, że NFT w ALS/PDC zawierają białko tau[72][73]. W hipokampie obecne są liczne ciała Hirano (w sektorze Sommera) i nasilone zwyrodnienie ziarnisto-wodniczkowe Simchowicza[74]; nie są to zmiany charakterystyczne dla ALS/PDC i obserwuje się je także w innych chorobach neurodegeneracyjnych.
Obserwuje się zmiany typowe dla ALS w ciałach motoneuronów rogów bocznych: ubikwitynododatnie wtręty skeinowe, ciałka Buniny, wtręty cytoplazmatyczne tau-dodatnie[70].
Zmiany neuropatologiczne w PSP, parkinsonizmie pozapalnym (PEP) i ALS/PDC są bardzo zbliżone i niełatwe do rozróżnienia nawet dla wprawnego neuropatologa[13]. W ALS/PDC nie obserwuje się blaszek amyloidowych, jak w chorobie Alzheimera, z reguły nie ma ciał Lewy’ego.
Leczenie i rokowanie
Nie ma swoistego leczenia dla ALS/PDC. Rokowanie w ALS/PDC i G-ALS jest bez wyjątku złe; chorzy umierają z powodu powikłań typowych dla stwardnienia zanikowego bocznego, głównie niewydolności oddechowej. U japońskich pacjentów średnia przeżycia od momentu rozpoznania wynosiła nieco ponad 6 lat. W PDC leczenie polega na fizjoterapii i podawaniu lewodopy; pacjenci często bardzo dobrze reagują na lek, podobnie jak w parkinsonizmie pozapalnym, jednak wcześnie (czasem od samego początku) występują fluktuacje (on-off) lub tiki. Podkreśla się rolę opieki i akceptacji ze strony rodziny[11].
Przypisy
- ↑ Brooks BR, Miller RG, Swash M, Munsat TL; World Federation of Neurology Research Group on Motor Neuron Diseases. El Escorial revisited: revised criteria for the diagnosis of amyotrophic lateral sclerosis. „Amyotroph Lateral Scler Other Motor Neuron Disord”. 1. 5, s. 293-9, 2000. PMID: 11464847.
- ↑ World Federation of Neurology Research Group on Motor Neuron Diseases El Escorial Revisited: Revised Criteria for the Diagnosis of Amyotrophic Lateral Sclerosis, Virginia April 2-4 1998, http://www.wfnals.org/
- ↑ Mitra K, Gangopadhaya PK, Das SK. Parkinsonism plus syndrome--a review. „Neurol India”. 51. 2, s. 183-188, 2003. PMID: 14570999.
- ↑ Tolosa E, Calandrella D, Gallardo M. Caribbean parkinsonism and other atypical parkinsonian disorders. „Parkinsonism Relat Disord”. 10. Suppl 1, s. S19-26, 2004. PMID: 15109583.
- ↑ Morris HR, Lees AJ, Wood NW. Neurofibrillary tangle parkinsonian disorders--tau pathology and tau genetics. „Mov Disord”. 14. 5, s. 731-736, 1999. PMID: 10495033.
- ↑ AMYOTROPHIC LATERAL SCLEROSIS-PARKINSONISM/DEMENTIA COMPLEX 1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Charcot JM, Joffroy A. Deux cas d’atrophie musculaire progressive avec lésions de la substance grise et des faiseaux antérolatéraux de la moelle épinière. „Archives de physiologie normale et pathologique”. 2, s. 354-367, 629-649, 744-760, 1869 (fr.).
- ↑ Miura K. Amyotrophische Lateralsklerose unter dem Bilde von sog. Bulbärparalyse. „Neurol Jpn”. 10, s. 366-369, 1911.
- ↑ a b Kuzuhara S. [ALS-parkinsonism-dementia complex of the Kii peninsula of Japan (Muro disease). Historical review, epidemiology and concept]. „Rinsho Shinkeigaku”. 47. 11, s. 962-965, 2007. PMID: 18210849.
- ↑ „remarkably free from disease and physical defects, and lived to a great age”
- ↑ a b c d e f Medical problems caused by plants. 12 Lytico-bodig (ang.). Instituut voor Tropische Geneeskunde Antwerpen. [dostęp 2015-11-19]. [zarchiwizowane z tego adresu (2017-09-08)].
- ↑ Zimmerman H: Progress report of work in the laboratory of pathology during May, 1945. Guam. Washington (DC): US Naval Medical Research Unit, 1945.
- ↑ a b c d e f g h Sacks O. The Island of the colour-blind and Cycad Island. A.A. Knopf 1996, ISBN 978-0-676-97035-7. Tłum. pol. Sacks O. Wyspa daltonistów i wyspa sagowców. Przekład Jolanta Bartosik, Zysk i S-ka 2000 ISBN 83-7150-673-2
- ↑ a b Koerner DR. Amyotrophic lateral sclerosis on Guam. A clinical study and review of the literature. „Ann Intern Med”. 37, s. 1204–20, 1952. PMID: 13008298.
- ↑ Arnold A, Edgren DC, Palladino VS. Amyotrophic lateral sclerosis. Fifty cases observed on Guam. „J Nerv Ment Dis”. 117, s. 135–139, 1953. PMID: 13061952.
- ↑ Tillema S, Wijnberg CJ. Endemic amyotrophic lateral sclerosis on Guam; epidemiological data: a preliminary report. „Doc Med Geogr Trop”. 5, s. 366–70, 1953. PMID: 13151035.
- ↑ a b c Kurland LT, Mulder DW. Epidemiologic investigations of amyotrophic lateral sclerosis. 1. Preliminary report on geographic distribution, with special reference to the Mariana Islands, including clinical and pathological observations. „Neurology”. 4, s. 355–378, 438–448, 1954. PMID: 13185376.
- ↑ Kurland LT, Mulder DW. Epidemiologic investigations of amyotrophic lateral sclerosis. 2. Familial aggregations indicative of dominant inheritance II. „Neurology”. 5, s. 249–68, 1955. PMID: 14370376.
- ↑ Kurland LT, Mulder DW. Epidemiologic investigations of amyotrophic lateral sclerosis. 2. Familial aggregations indicative of dominant inheritance I. „Neurology”. 5, s. 182–96, 1955. PMID: 14356347.
- ↑ a b c Mulder DW, Kurland LT, Iriarte LLG. Neurologic diseases on the island of Guam. „US Armed Forces Med J”. 5, s. 1724–1739, 1954. PMID: 13217119.
- ↑ Hirano A, Kurland LT, Krooth RS, et al. Parkinsonism-dementia complex and endemic disease on the island of Guam. I. Clinical features. Brain 1961a;84:642–61 PDF
- ↑ a b Hirano A, Kurland LT, Krooth RS, et al. Parkinsonism-dementia complex and endemic disease on the island of Guam. II. Pathologic features. Brain 1961b;84:662–70
- ↑ Plato CC, Reed DM, Elizan TS, Kurland LT. Amyotrophic lateral sclerosis-Parkinsonism-dementia complex of Guam. IV. Familial and genetic investigations. „Am J Hum Genet”. 19. 5, s. 617-32, 1967. PMID: 6050736.
- ↑ Yanagihara RT, Garruto RM, Gajdusek DC. Epidemiological surveillance of amyotrophic lateral sclerosis and parkinsonism-dementia in the Commonwealth of the Northern Mariana Islands. „Ann Neurol”. 13. 1, s. 79-86, 1983. PMID: 6830169.
- ↑ Gajdusek DC: Environmental Factors Provoking Physiological Changes Which Induce Motor Neurone Disease and Early Neuronal Ageing in High Incidence Foci in the Western Pacific. W: Rose, F. Clifford (red.): Research Progress in Motor Neurone Disease. Londyn: Pitman Books Limited, 1984, s. 44-69.
- ↑ Gajdusek DC: Calcium Deficiency Induced Secondary Hyperparathyroidism and Resultant CNS Deposition of Calcium and Other Metallic Cations as the Cause of ALS and PD in High Incidence among the Auyu and Jakai People in West New Guinea. W: Chen KM, Yase Y (red.): Amyotrophic Lateral Sclerosis in Asia and Oceania. Tajpej: National Taiwan University, 1984, s. 145-171.
- ↑ Gajdusek DC: Foci of Motor Neuron Disease in High Incidence in Isolated Populations of East Asia and the Western Pacific. W: Rowland Lewis P (red.): Human Motor Neuron Diseases. Nowy Jork: Raven Press, 1982, s. 363-393.
- ↑ Gajdusek DC: A Focus of High Incidence Amyotrophic Lateral Sclerosis and Parkinsonism and Dementia Syndromes in a Small Population of Auyu and Jakai People of Southern West New Guinea. W: Tsubaki Tadao, Toyokura Yasuo (red.): Amyotrophic Lateral Sclerosis: Proceedings of the International Symposium on Amyotrophic Lateral Sclerosis Held February 2 and 3, 1978. Tokio: University of Tokyo Press, 1979, s. 287-305.
- ↑ a b Gajdusek DC, Salazar AM. Amyotrophic lateral sclerosis and parkinsonian syndromes in high incidence among the Auyu and Jakai people of West New Guinea. „Neurology”. 32. 2, s. 107-126, 1982. PMID: 7198738.
- ↑ a b Spencer PS, Palmer VS, Ludolph AC. On the decline and etiology of high-incidence motor system disease in West Papua (southwest New Guinea). „Mov Disord”. 20. Suppl 12, s. S119-26, 2005. PMID: 16092101.
- ↑ a b Kimura K, Yase Y, Higashi Y, Uno S, Yamamoto K, Iwasaki M, Tsumoto I, Sugiura M, Yoshimura S, Namikawa K, Kumura S, Iwamoto S, Handa, Y, Yata M, Yata Y. Epidemiological and geomedical studies on ALS and allied diseases in Kii peninsula (Japan): preliminary report. „Proc Jpn Acad”. 37, s. 417-420, 1961.
- ↑ Chen KM. [Disappearance of ALS from Guam: implications for exogenous causes]. „Rinsho Shinkeigaku”. 35. 12, s. 1549-53, 1995. PMID: 8752460.
- ↑ a b Plato CC, Garruto RM, Galasko D, Craig UK, Plato M, Gamst A, Torres JM, Wiederholt W. Amyotrophic lateral sclerosis and parkinsonism-dementia complex of Guam: changing incidence rates during the past 60 years. „Am J Epidemiol”. 157. 2, s. 149-57, 2003. PMID: 12522022.
- ↑ Figlewicz DA, Garruto RM, Krizus A, Yanagihara R, Rouleau GA. The Cu/Zn superoxide dismutase gene in ALS and parkinsonism-dementia of Guam. „Neuroreport”. 5. 5, s. 557-560, 1994. PMID: 8025243.
- ↑ Kikugawa K, Nakano R, Inuzuka T, Kokubo Y, Narita Y, Kuzuhara S, Yoshida S, Tsuji S. A missense mutation in the SOD1 gene in patients with amyotrophic lateral sclerosis from the Kii Peninsula and its vicinity, Japan. „Neurogenetics”. 1, s. 113-115, 1997. PMID: 10732812.
- ↑ Hara K, Kuwano R, Miyashita A, Kokubo Y, Sasaki R, Nakahara Y, Goto J, Nishizawa M, Kuzuhara S, Tsuji S. [Molecular genetic analysis of amyotrophic lateral sclerosis/parkinsonism-dementia complex (ALS/PDC) in the Kii peninsula]. „Rinsho Shinkeigaku”. 47. 11, s. 974-976, 2007. PMID: 18210852.
- ↑ Poorkaj P, Tsuang D, Wijsman E, Steinbart E, Garruto RM, Craig UK, Chapman NH, Anderson L, Bird TD, Plato CC, Perl DP, Weiderholt W, Galasko D, Schellenberg GD. TAU as a susceptibility gene for amyotropic lateral sclerosis-parkinsonism dementia complex of Guam. „Arch Neurol”. 11, s. 1871-1878, 2001. PMID: 11708997.
- ↑ Hermosura MC, Nayakanti H, Dorovkov MV, Calderon FR, Ryazanov AG, Haymer DS, Garruto RM. A TRPM7 variant shows altered sensitivity to magnesium that may contribute to the pathogenesis of two Guamanian neurodegenerative disorders. „Proc Nat Acad Sci”. 102, s. 11510-11515, 2005. PMID: 16051700.
- ↑ Fuccillo DA, Kurent JE, Sever JL. Slow Virus Diseases. „Annual Review of Microbiology”. 28, s. 231-264, 1974. DOI: 10.1146/annurev.mi.28.100174.001311.
- ↑ Gajdusek DC, Gibbs CJ Jr: Slow Infection of the CNS with Unconventional Viruses and Attempts to Demonstrate a Slow-Virus Aetiology in Amyotrophic Lateral Sclerosis and Parkinsonism Dementia. W: International Conference on Peripheral Neuropathies 24th-25th June, 1981, Madrid. Amsterdam: Excerpta Medica, 1982, s. 93-110.
- ↑ Mora CA, Garruto RM, Brown P, Guiroy D, Morgan OS, Rodgers-Johnson P, Ceroni M, Yanagihara R, Goldfarb LG, Gibbs CJ Jr., et al. Seroprevalence of antibodies to HTLV-I in patients with chronic neurological disorders other than tropical spastic paraparesis. „Ann Neurol”. 23. Suppl, s. S192-5, 1988. PMID: 2894813.
- ↑ Maurizi CP. Was a neurovirulent influenza virus the cause of amyotrophic lateral sclerosis and parkinsonism-dementia on Guam?. „Med Hypotheses”. 23. 3, s. 325-6, 1987. PMID: 3614022.
- ↑ Müller WK, Schaltenbrand G. Attempts to reproduce amyotrophic lateral sclerosis in laboratory animals by inoculation of Schu virus isolated from a patient with apparent amyotrophic lateral sclerosis. „Journal of Neurology”. 220 (1), s. 1-19, 1979-01-30. DOI: 10.1007/BF00313144. PMID: 84063.
- ↑ Hudson AJ, Rice GP. Similarities of guamanian ALS/PD to post-encephalitic parkinsonism/ALS: possible viral cause. Can J Neurol Sci 1990;17:427–433.
- ↑ Hammon WM, Tigertt WD, Sather GE, Berge TO, Meiklejohn G. Epidemiologic studies of concurrent virgin epidemics of Japanese B encephalitis and of mumps on Guam, 1947-1948, with subsequent observations including dengue, through 1957. „Am J Trop Med Hyg”. 7. 4, s. 441-467, 1958. PMID: 13559599.
- ↑ Pieper SJ Jr., Kurland LT. Sequelae of Japanese B and mumps encephalitis: recent follow-up of patients affected in 1947-1948 epidemic on Guam. „Am J Trop Med Hyg”. 7. 5, s. 481-490, 1958. PMID: 13571562.
- ↑ Yase Y: The pathogenic role of metals in motor neuron disease: the participation of aluminum. W: Cosi V, Kato AC, Parlette W, Pinelli P, Poloni M (red.): Amyotrophic lateral sclerosis: therapeutic, psychological, and research aspects. Nowy Jork: Plenum Press, 1987, s. 89–96.
- ↑ Yanagihara R, Garruto RM, Gajdusek DC, Tomita A, Uchikawa T, Konagaya Y, Chen KM, Sobue I, Plato CC, Gibbs CJ Jr. Calcium and vitamin D metabolism in Guamanian Chamorros with amyotrophic lateral sclerosis and parkinsonism-dementia. „Ann Neurol”. 15. 1, s. 42-48, 1984. PMID: 6546847.
- ↑ Rodgers-Johnson P, Garruto RM, Yanagihara R, Chen KM, Gajdusek DC, Gibbs CJ Jr. Amyotrophic lateral sclerosis and parkinsonism-dementia on Guam: a 30-year evaluation of clinical and neuropathologic trends. „Neurology”. 36. 1, s. 7-13, 1986. PMID: 3941784.
- ↑ a b Murch SJ, Cox PA, Banack SA. A mechanism for slow release of biomagnified cyanobacterial neurotoxins and neurodegenerative disease in Guam. „Proc Natl Acad Sci”. 101 (33), s. 12228-31, 2004. PMID: 15295100.
- ↑ Cox PA, Banack SA, Murch SJ. Biomagnification of cyanobacterial neurotoxins and neurodegenerative disease among the Chamorro people of Guam. „Proc Natl Acad Sci”. 100. 23, s. 13380-13383, 2003. PMID: 14612559.
- ↑ Cox PA, Banack SA, Murch SJ, Rasmussen U, Tien G, Bidigare RR, Metcalf JS, Morrison LF, Codd GA, Bergman B. Diverse taxa of cyanobacteria produce beta-N-methylamino-L-alanine, a neurotoxic amino acid. „Proc Natl Acad Sci”. 102. 14, s. 5074-8, 2005. Erratum. „Proc Natl Acad Sci”. 102. 27, s. 9734, 2005. PMID: 15809446.
- ↑ Spencer PS, Nunn PB, Hugon J. Guam amyotrophic lateral sclerosis-parkinsonism-dementia linked to a plant excitant neurotoxin. Science 1987; 237:17–22
- ↑ a b Spencer PS, Ohta M, Palmer VS. Cycad use and motor neurone disease in Kii peninsula of Japan. „Lancet”. 2. 8573, s. 1462-3, 1987.
- ↑ a b Spencer PS, Palmer VS, Herman A, Asmedi A. Cycad use and motor neurone disease in Irian Jaya. „Lancet”. 2. 8570, s. 1273-1274, 1987. PMID: 2890883.
- ↑ Banack SA, Murch SJ, Cox PA. Neurotoxic flying foxes as dietary items for the Chamorro people, Marianas Islands. „J Ethnopharmacol”. 106 (1), s. 97-104, 2006. PMID: 16457975.
- ↑ Cox PA, Banack S, Murch S, Sacks O. Commentary on: Return of the cycad hypothesis--does the amyotrophic lateral sclerosis/Parkinsonism dementia complex (ALS/PDC) of Guam have new implications for global health?. „Neuropathol Appl Neurobiol”. 32. 6, s. 679-682, 2006. PMID: 17083482.
- ↑ Cox PA, Sacks OW. Cycad neurotoxins, consumption of flying foxes, and ALS-PDC disease in Guam. „Neurology”. 58. 6, s. 956-959, 2002. PMID: 11914415.
- ↑ F.J. Bonaccorso i inni, Pteropus tokudae, [w:] The IUCN Red List of Threatened Species [online] [dostęp 2021-02-13] (ang.).
- ↑ Elizabeth A. Proctor, David D. Mowrey, Nikolay V. Dokholyan, β-Methylamino-L-alanine substitution of serine in SOD1 suggests a direct role in ALS etiology, „PLOS Computational Biology”, 2019, DOI: 10.1371/journal.pcbi.1007225 (ang.).
- ↑ Murakami N. Parkinsonism-dementia complex on Guam – Overview of clinical aspects. „J Neurol”. 246. Suppl 2, s. 16-18, 1999. PMID: 10525998.
- ↑ Ahlskog JE, Waring SC, Petersen RC, Esteban-Santillan C, Craig UK, O’Brien PC, Plevak MF, Kurland LT. Olfactory dysfunction in Guamanian ALS, parkinsonism, and dementia. „Neurology”. 51. 6, s. 1672-1677, 1998. PMID: 9855521.
- ↑ Cox TA, McDarby JV, Lavine L, Steele JC, Calne DB. A retinopathy on Guam with high prevalence in Lytico-Bodig. „Ophthalmology”. 96. 12, s. 1731-1735, 1989. PMID: 2622619.
- ↑ Campbell RJ, Steele JC, Cox TA, Loerzel AJ, Belli M, Belli DD, Kurland LT. Pathologic findings in the retinal pigment epitheliopathy associated with the amyotrophic lateral sclerosis/parkinsonism-dementia complex of Guam. „Ophthalmology”. 100. 1, s. 37-42, 1993. PMID: 8433825.
- ↑ Hanlon SD, Steele JC. An unusual retinal pigment epitheliopathy endemic to the island of Guam. „Optom Vis Sci”. 70. 10, s. 854-859, 1993. PMID: 8247490.
- ↑ Hira NK, Marciniak MM, Penner SL. Ophthalmomyiasis interna posterior and pigmentary retinopathy of Guam. „J Am Optom Assoc”. 68. 7, s. 452-458, 1997. PMID: 9280754.
- ↑ Kokubo Y. [Clinical aspects, imaging and neuropathology of Kii ALS/PDC]. „Rinsho Shinkeigaku”. 47. 11, s. 966-969, 2007. PMID: 18210850 (jap.).
- ↑ Sacks, s. 116
- ↑ Sacks s. 152-153
- ↑ a b Oyanagi K, Makifuchi T, Ohtoh T, Chen KM, van der Schaaf T, Gajdusek DC, Chase TN, Ikuta F. Amyotrophic lateral sclerosis of Guam: the nature of the neuropathological findings. „Acta Neuropathol”. 88. 5, s. 405-12, 1994. PMID: 7847068.
- ↑ Hof PR, Perl DP, Loerzel AJ, Morrison JH. Neurofibrillary tangle distribution in the cerebral cortex of parkinsonism-dementia cases from Guam: differences with Alzheimer's disease. „Brain Res”. 564. 2, s. 306-313, 1991. PMID: 1810629.
- ↑ a b Hof PR, Perl DP, Loerzel AJ, Steele JC, Morrison JH. Amyotrophic lateral sclerosis and parkinsonism-dementia from Guam: differences in neurofibrillary tangle distribution and density in the hippocampal formation and neocortex. „Brain Res”. 650. 1, s. 107-116, 1994. PMID: 7953661.
- ↑ Buée-Scherrer V, Buée L, Hof PR, Leveugle B, Gilles C, Loerzel AJ, Perl DP, Delacourte A. Neurofibrillary degeneration in amyotrophic lateral sclerosis/parkinsonism-dementia complex of Guam. Immunochemical characterization of tau proteins. „Am J Pathol”. 146. 4, s. 924-932, 1995. PMID: 7717459. PDF
- ↑ Hirano A, Dembitzer HM, Kurland LT, Zimmerman HM. The fine structure of some intraganglionic alterations. Neurofibrillary tangles, granulovacuolar bodies and „rod-like” structures as seen in Guam amyotrophic lateral sclerosis and parkinsonism-dementia complex. „J Neuropathol Exp Neurol”. 27, s. 167–182, 1968. PMID: 5646193.
Bibliografia
- Paweł P Liberski, Wielisław Papierz, Wojciech Kozubski, Iwona Kłoszewska, Mirosław Jan Mossakowski: Neuropatologia Mossakowskiego. Lublin: Wydawnictwo Czelej, 2005, s. 608-612. ISBN 83-89309-63-7.
- Irene Litvan: Atypical Parkinsonian Disorders: Clinical And Research Aspects (Current Clinical Neurology). Totowa: Humana Press, s. 47-48, 127-128. ISBN 1-58829-331-9.
- Plato CC, Garruto RM, Galasko D, Craig UK, Plato M, Gamst A, Torres JM, Wiederholt W. Amyotrophic lateral sclerosis and parkinsonism-dementia complex of Guam: changing incidence rates during the past 60 years. „Am J Epidemiol”. 157. 2, s. 149-57, 2003. PMID: 12522022.
- Morris HR, Steele JC, Crook R, Wavrant-De Vrièze F, Onstead-Cardinale L, Gwinn-Hardy K, Wood NW, Farrer M, Lees AJ, McGeer PL, Siddique T, Hardy J, Perez-Tur J. Genome-wide analysis of the parkinsonism-dementia complex of Guam. „Arch Neurol”. 61. 12, s. 1889-1897, 2004. DOI: 10.1001/archneur.61.12.1889. PMID: 15596609.
- Morris HR, Al-Sarraj S, Schwab C, Gwinn-Hardy K, Perez-Tur J, Wood NW, Hardy J, Lees AJ, McGeer PL, Daniel SE, Steele JC. A clinical and pathological study of motor neurone disease on Guam.. „Brain”. 124. Pt 11, s. 2215-22, 2001. DOI: 10.1093/brain/124.11.2215. PMID: 11673323.
- Hirotsugu Shiraki, Yoshiro Yase: Chapter 16. Amyotrophic lateral sclerosis and parkinsonism-dementia in the Kii Peninsula: comparison with the same disorders in Guam and with Alzheimer disease. W: PJ Vinken, GW Bruyn, Harold L Klawans, JMBV de Jong: Diseases of the motor system. Amsterdam: Elsevier Science Publishers, 1991. ISBN 0-444-81278-4.
Linki zewnętrzne
- Amyotrophic lateral sclerosis-parkinsonism/dementia complex 1 w bazie Online Mendelian Inheritance in Man (ang.)
- John Pickrell. Bat-Eating Linked to Neurological Illness. 2003-06-13. National Geographic News (ang.)
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.Autor: Filip em, Licencja: CC BY-SA 3.0
Schemat przedstawiający zmiany stężeń BMAA związanego i niezwiązanego z białkami w cyjanobakteriach, nasionach sagowców, mięśniach nietoperzy i w ciele żyjących na Guam ludzi. W czerwonych ramkach wyliczony iloraz frakcji związanej i wolnej. Według Murcha, 2004.
Autor: PeregrinusX, Licencja: CC BY-SA 3.0
Cycas circinalis - Coralloir Roots
South Sea cruise 99-1900, Ladrone Islands, Guam, Caroline islanders village near Agana.
L-3-Methylamino-L-alanine; L-BMAA; L-β-Methylamino-L-alanine
Autor: Filip em, Licencja: CC-BY-SA-3.0
Distribution of amyotrophic lateral sclerosis/parkinsonism-dementia complex (ALS/PDC) in the Western Pacific (Mariana Islands, Kii Peninsula in Japan, and west New Guinea).
Autor: Filip em, Licencja: CC BY 3.0
Chamorro pedigree from village of Umatac; after Plato et al, 1967