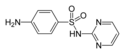
Sulfadiazyna
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny | C10H10N4O2S | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 250,28 g/mol | ||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||
| Stosowanie w ciąży | kategoria C[3] | ||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
Sulfadiazyna (łac. sulfadiazinum) – wielofunkcyjny organiczny związek chemiczny, sulfonamid o działaniu bakteriostatycznym.
Mechanizm działania
Mechanizm działania sulfadiazyny polega na zaburzeniu syntezy kwasów nukleinowych bakterii poprzez hamowanie przemiany kwasu p-aminobenzoesowego w kwas foliowy[4].
Zastosowanie
- sulfadiazyna jest sulfonamidem o działaniu bakteriostatycznym o aktywności w stosunku do bakterii Gram-dodatnich w szczególności paciorkowców grupy A, niektórych szczepów Streptococcus pneumoniae, Bacillus anthracis, Nocardia (szczególnie Nocardia asteroides), a w mniejszym stopniu gronkowców i Clostridium perfringens oraz Gram-ujemnych z których często wrażliwe są Haemophilus influenzae i Haemophilus ducreyi, wrażliwość jest zmienna wśród enterobakterii, niekiedy wrażliwe są Escherichia coli, Klebsiella, Proteus, Salmonella, Serratia oraz Vibrio cholerae, istnieją doniesienia również o wrażliwości pośród Actinomyces, Brucella, Legionella, Yersinia pestis, Chlamydie i Burkholderia pseudomallei[5],
- sulfadiazyna w połączeniu z trimetoprymem lub tetroksoprymem ma podobne działanie jak kotrimoksazol, może być również łączona z sulfamerazyną[4].
Sulfadiazyna znajduje się na wzorcowej liście podstawowych leków Światowej Organizacji Zdrowia (WHO Model Lists of Essential Medicines) (2015)[6].
Sulfadiazyna nie jest dopuszczona do obrotu w Polsce (2018)[7].
Działania niepożądane
Działania niepożądane sulfadiazyny są częstsze u wolnych acetylatorów[5]. Głównymi działania ubocznymi sulfonamidów są ból głowy, nudności, biegunka, wysypka oraz hiperkaliemia[4][8].
Przypisy
- ↑ a b c Sulfadiazine, [w:] PubChem [online], United States National Library of Medicine, CID: 5215 (ang.).
- ↑ Sulfadiazyna (nr S8626) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck KGaA) na obszar Stanów Zjednoczonych. [dostęp 2018-06-08]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Drugs and Supplements Sulfadiazine (Oral Route) (ang.). Mayo Foundation for Medical Education and Research, 2017-03-01. [dostęp 2018-06-08].
- ↑ a b c d e f g Jan K. Podlewski, Alicja Chwalibogowska-Podlewska: Leki współczesnej terapii. T. 2. Warszawa: Medical Tribune, 2010, s. 775–776. ISBN 978-83-60135-95-2.
- ↑ a b Wockhardt UK Ltd: Sulfadiazine 500mg Tablets BP Summary of Product Characteristics (ang.). Medicines & Healthcare products Regulatory Agency, 2015. [dostęp 2018-06-08]. [zarchiwizowane z tego adresu (2018-06-12)].
- ↑ WHO Model List of Essential Medicines 19th List (ang.). Światowa Organizacja Zdrowia, 2015. s. 17. [dostęp 2018-06-08].
- ↑ Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 16 kwietnia 2018 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej. Dziennik Urzędowy Ministra Zdrowia, 2018-04-16. [dostęp 2018-06-08].
- ↑ Biseptol (200 mg + 40 mg)/5 ml, zawiesina doustna – Charakterystyka Produktu Leczniczego. Centrum Systemów Informacyjnych Ochrony Zdrowia Rejestr Produktów Leczniczych. [dostęp 2018-06-08]. [zarchiwizowane z tego adresu (2018-06-12)].
![]() Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Przeczytaj ostrzeżenie dotyczące informacji medycznych i pokrewnych zamieszczonych w Wikipedii.
Media użyte na tej stronie
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
The Star of Life, medical symbol used on some ambulances.
Star of Life was designed/created by a National Highway Traffic Safety Administration (US Gov) employee and is thus in the public domain.