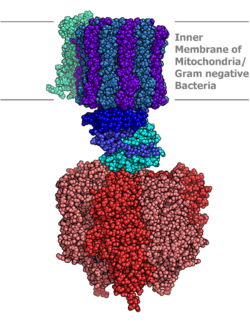
Syntaza ATP
Syntaza ATP, (EC 3.6.3.14[1]) – enzym z grupy syntaz katalizujący reakcję wytwarzania ATP z ADP i fosforanu nieorganicznego Pi. Energia niezbędna do syntezy pochodzi z gradientu elektrochemicznego protonów - w wyniku tego gradientu następuje ruch protonów, a następnie ich energia przekształcana jest w energię wiązań chemicznych w ATP.
Reakcja syntezy ATP ma postać:
- ADP + Pi + 3H+out ⇌ ATP + H2O + 3H+in
Syntaza ATP znajduje się w wewnętrznej błonie mitochondriów, w błonach tylakoidów wewnątrz chloroplastów oraz w błonach komórkowych organizmów prokariotycznych. Enzym bierze udział w kluczowych procesach uzyskiwania energii przez organizmy żywe fosforylacji oksydacyjnej będącej głównym źródłem ATP wytwarzanego podczas oddychania komórkowego oraz fosforylacji fotosyntetycznej będącej źródłem ATP powstającego w fazie jasnej fotosyntezy.
Inhibitorem syntazy ATP wykorzystywanym w badaniach biologicznych jest antybiotyk – oligomycyna.
Rola fizjologiczna
Wewnątrz błony mitochondrialnej (u eukariontów) lub w błonie komórkowej (u bakterii) następuje utlenianie NADH do NAD+. Uwolnione elektrony uczestniczą w łańcuchu oddechowym, aby napędzić przeniesienie protonów w poprzek błony (z macierzy mitochondrialnej do przestrzeni międzybłonowej) przez składające się na ten łańcuch odpowiednie przenośniki (pompy). W chloroplastach i błonach fotosyntetyzujących organizmów prokariotycznych protony przenoszone są ze stromy do wnętrza tylakoidu dzięki energii uzyskanej poprzez pochłonięcie kwantów światła przez odpowiednie kompleksy.
ATP wytwarzane jest z ADP i Pi (reszty ortofosforanowej) w wyniku działania syntazy ATP. Rotacja jej odpowiedniego segmentu umożliwia syntezę ATP. Energia niezbędna do syntezy dostarczana jest przez gradient elektrochemiczny. W procesie tym protony samoczynnie powracają z przestrzeni międzybłonowej lub wnętrza tylakoidu odpowiednio do macierzy mitochondrialnej lub stromy chloroplastu.
Budowa enzymu
Ze względu na miejsce występowania wyróżnia się trzy podstawowe kompleksy syntazy ATP.
Są to:
- Syntaza ATP mitochondrialna określana jako FoF1 lub MFoF1
- Syntaza ATP chloroplastowa określana jako CFoF1
- Syntaza ATP prokariotyczna
Wszystkie trzy syntazy ATP zaliczane są do grupy F-ATPaz i mają zbliżoną budowę. Każda z nich składa się z dwóch domen. Pierwsza z nich – Fo – jest białkiem wewnątrzbłonowym tworzącym kanał jonowy dla jonów H+. Druga domena jest właściwą syntazą składająca się z kilkunastu polipeptydów tworzących kulista strukturę o średnicy ok. 100 Å.
Ewolucja
Uważa się, że ewolucja syntazy ATP zachodziła modułowo. Obie domeny wraz ze swoimi wartościowościami połączyły się zyskując nową funkcję. Domena F1 wykazuje znaczne podobieństwo do heksamerycznej helikazy DNA, a domena Fo jest podobna do kompleksów tworzących motor molekularny napędzający wici komórek.
Heksamer α3β3 tworzący domenę F1 podobnie jak helikaza DNA składa się z obracającego się pierścienia z otworem pośrodku. U obu enzymów obroty pierścienia umożliwiają pełnienie funkcji. Helikaza DNA porusza się po helisie DNA przy jednoczesnej hydrolizie nukleotydów. Domena F1 wykorzystuje zmiany konformacyjne podczas obrotu podjednostki γ do przeprowadzenia reakcji enzymatycznej.
Jony H+ przepływające przez domenę Fo w bardzo podobny sposób jak przy napędzaniu motoru molekularnego poruszającego wicią. Ich wspólną cechą jest pierścień składający się z wielu alfa-helikalnych białek, które obracają się w stosunku do innych białek zużywając jednocześnie gradient protonowy jako źródło energii. Jest to jednakże dość wątły związek, ogólna struktura motorów molekularnych jest zdecydowanie większa, zawierają 30 polipeptydów, w porównaniu do 10, 11, lub 14 znanych polipeptydów domeny Fo.
Modułowa teoria pochodzenia syntazy ATP sugeruje, że dwie domeny o niezależnych funkcjach, helikaza DNA posiadająca właściwości ATPazy i motor molekularny napędzany siłą protonomotoryczną, mogły się połączyć i doprowadzić do odwrócenia właściwości ATPazy powstałej z helikazy DNA. Dalszy rozwój prowadziłby do powstania kompleksu syntazy ATP znanej dzisiaj. Alternatywnie kompleks helikazy DNA i motoru molekularnego mógł wykazywać początkowo aktywność ATPazy, która przenosiła jony H+ zużywając ATP. Dalsza ewolucja kompleksu mogłaby doprowadzić do odwrócenia przeprowadzanej reakcji i powstania funkcji spełnianej przez syntazę ATP.
Zobacz też
- ATPazy – enzymy hydrolizujące ATP
- Paul Boyer – laureat Nagrody Nobla za badania syntezy ATP
Przypisy
Bibliografia
- P.D. Boyer, The binding change mechanism for ATP synthase – some probabilities and possibilities, „Biochimica et Biophysica Acta”, 1140 (3), 1993, s. 215–250, DOI: 10.1016/0005-2728(93)90063-L, PMID: 8417777.
- P.D. Boyer, The ATP synthase – a splendid molecular machine, „Annual Review of Biochemistry”, 66, 1997, s. 717–749, DOI: 10.1146/annurev.biochem.66.1.717, PMID: 9242922.c?
- R.J. Devenish i inni, Insights into ATP synthase assembly and function through the molecular genetic manipulation of subunits of the yeast mitochondrial enzyme complex, „Biochimica et Biophysica Acta”, 1458 (2-3), 2000, s. 428–442, DOI: 10.1016/S0005-2728(00)00092-X, PMID: 10838056.
- J. Velours i inni, Organisation of the yeast ATP synthase F0: a study based on cysteine mutants, thiol modification and cross-linking reagents, „Biochimica et Biophysica Acta”, 1458 (2-3), 2000, s. 443–456, DOI: 10.1016/S0005-2728(00)00093-1, PMID: 10838057.
- M.J. Gresser, J.A. Myers, P.D. Boyer, Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model, „Journal of Biological Chemistry”, 257 (20), 1982, s. 12030–12038, PMID: 6214554.c?
Media użyte na tej stronie
Syntaza ATP
Autor: Alex.X, Licencja: CC-BY-SA-3.0
Using 1QO1 as framework to combine 1C17(FO) and 1E79(F1). PyMOL was used for rendering.