Szarobrewka bagienna
| Melospiza georgiana[1] | |||
| (Latham, 1790) | |||
 | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Infragromada | |||
| Rząd | |||
| Podrząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek | szarobrewka bagienna | ||
| Synonimy | |||
| |||
| podgatunek | |||
| |||
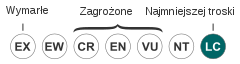
| Kategoria zagrożenia (CKGZ)[2] | |||
 | |||
| Zasięg występowania | |||
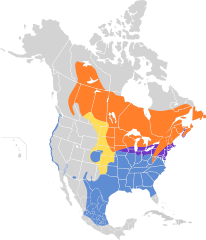 w sezonie lęgowym występuje przez cały rok przeloty zimowiska | |||
Szarobrewka bagienna[3], pasówka bagienna[4] (Melospiza georgiana) – gatunek małego ptaka z rodziny pasówek (Passerellidae). Występuje od Kanady poprzez większą część Stanów Zjednoczonych po Meksyk. Wędrowny. Niezagrożony wyginięciem.
Długość ciała wynosi 13–15 cm. Gatunek ten cechuje rudobrązowe upierzenie wierzchu głowy i grzbietu, poprzecinanego czarnymi pasami. Z wyjątkiem brązowej brwi, ciemnoszarych pokryw usznych oraz białawego kantarka – głowa i kark mają barwę szarą. Spód niemal biały, zaś boki i pokrywy podogonowe płowe do piaskowobrązowych. Lotki i sterówki czarniawo-kasztanowe.
Środowisko życia szarobrewki bagiennej stanowią mokradła, bagna i podmokłe łąki. Pożywienie zależnie od pory roku stanowią owady lub nasiona. Gniazdo w kształcie kubeczka, utworzone z trawy, mieści się często nad wodą, niekiedy w kępie traw. Jaja w liczbie 4–6 wysiaduje wyłącznie samica przez 13–15 dni. Młode po 11–13 dniach są gotowe, by opuścić gniazdo.
Taksonomia
Gatunek opisał po raz pierwszy John Latham w roku 1790, w dziele Index Ornithologicus, Sive Systema Ornithologiae. Przydzielił szarobrewce bagiennej nazwę Fringilla georgiana. Za miejsce występowania, toteż i zebrania holotypu, wskazał środkową Georgię[5]. Do rodzaju Melospiza gatunek przypisał Spencer Fullerton Baird w wydanym w 1858 roku dziele Reports of explorations and surveys. Zastosował jednak inną nazwę gatunkową, określając tę pasówkę jako Melospiza palustris i sugerując, jakoby lepiej byłoby pozostawić nazwę nadaną przez Alexandra Wilsona – Fringilla palustris[6]. IOC[7] oraz NACC akceptują gatunek pod nazwą Melospiza georgiana[8].
Podgatunki
Wedle IOC wyróżniane są trzy podgatunki: M. g. ericrypta, nominatywny M. g. georgiana oraz M. g. nigrescens (szarobrewka atlantycka[3])[7].
Takson nigrescens różni się od podgatunku nominatywnego ekologią, biologią lęgową i charakterem wędrówek[9]. Holotyp tego podgatunku (dorosły samiec) znajduje się w Muzeum Historii Naturalnej w Waszyngtonie, oznaczony numerem 418565, zebrany został 24 czerwca 1950 w hrabstwie Wicomico, na bagnach rzeki Nanticoke River przez Gormana M. Bonda i Roberta E. Stewarta[10].
Holotyp podgatunku ericrypta, dorosłego samca, zebrał 6 maja 1921 roku J. A. Loring w Fort McMurray (Alberta). Podobnie jak u M. g. nigricens, znajduje się w posiadaniu Smithsonian Institution. Otrzymał numer 283543[11].
Etymologia nazwy naukowej
Nazwa rodzajowa Melospiza pochodzi z greki od słów melo – pieśń, melodia – i spiza – zięba. Nazwa gatunkowa georgiana odnosi się do wspomnianej przez Lathama centralnej Georgii[12].
Morfologia
- Wymiary średnie
Całkowita długość ciała okazów wspomnianych przez Bairda waha się między 13,3 a 15,2 cm, zaś długość skrzydła 5,9–6,3 cm[6]. Skok mierzy u podgatunku nominatywnego 19,5–23 mm długości, u ericrypta 18,5–22,5 mm, zaś u nigrescens ok. 19,5–24,5 mm[13]. Osobniki z Muzeum Brytyjskiego mają sterówki długości 5,5–5,8 cm[14]; dla ptaków z Nowego Jorsku, Pensylwanii i Wirginii Zachodniej przedział wynosi 55–63,5 mm[13], u pewnego osobnika z Massachusetts 53 mm[15]. Dziób ma długość 8,1–8,8 mm[13], zaś autorzy Catalogue of Birds in the British Museum podają około 1,2 cm górnej krawędzi (culmen)[14]. Masa ciała wynosi 13,1–24 g[9].
- Morfologia
Występuje dymorfizm płciowy. U dorosłego samca wierzch ciała w większości brązowy, wewnątrz piór obecne są czarne pasy, na obrzeżach natomiast jasnobrązowe. W górnej części grzbietu na piórach obwódki białe. Niższa część grzbietu i kuper jasnobrązowe, pióra w środku z czarnym paskiem, mniej lub bardziej widocznym. Na pokrywach skrzydłowych o barwie kasztanowej także wewnątrz widnieją czarne plamki, bardziej uwidocznione na pokrywach dużych, które niekiedy wieńczą białokremowe plamki. Czarne skrzydełko jest biało obrzeżone. Pokrywy lotek I rzędu, jak i lotki I rzędu brązowe, rudawo obrzeżone. Chorągiewki zewnętrzne lotek II rzędu kasztanowe; najbardziej wewnętrzne spośród tych lotek przechodzą w barwę czarną, na których kasztanowa barwa obrzeżenia od zewnętrznej strony przechodzi ku końcowi w białą. Pokrywy nadogonowe rdzawe, pokryte czarnymi pasami. Spośród szarobrązowych sterówek o rudych krawędziach jedynie środkową parę cechuje czarna barwa wokół stosiny. Czoło czarne z wąską, szaropłową linią. Jednolicie szary kark i tył szyi pokrywają czarne pasy. Kantarek biały, przechodzi za okiem w szeroką brew. Także za okiem obecne są białe pióra. Pokrywy uszne szarobrązowe z białymi stosinami. Policzki białawe, od oczu biegnie czarna kreska. Gardło, podobnie jak pierś i brzuch, czysto białe. Boki piersi o barwie płowej przecinają czarne paski. Na bokach ciała jak i pokrywach podogonowych obecna jest barwa piaskowobrązowa. Górna część dzioba ciemnobrązowa, natomiast dolna biaława z niebieskawym odcieniem. Tęczówki brązowe, nogi i stopy żółtobrązowe[14].
Samica nie różni się zbytnio od samca. Cechuje ją jedynie jaśniejsza dolna szczęka i żółte nogi, tęczówka tak samo brązowa. Wymiary nieznacznie mniejsze. Osobniki w szacie spoczynkowej (zimowej) pokrywają z wierzchu głowy czarne pasy, a upierzenie ogólnie jest ciemniejsze. Boki bardziej jednolicie piaskowobrązowe. U wielu osobników stwierdzono ciemnoszare pasy z tyłu karku; prawdopodobnie to młode w swej pierwszej dorosłej szacie[14]. Podgatunek ericrypta wyróżnia jaśniejsze upierzenie i jasne kreskowanie na grzbiecie[16].
8 grudnia 1921 roku w Mount Pleasant (Karolina Południowa) Arthur T. Wayne odłowił niemal całkowicie albinotyczny – z wyjątkiem jednej sterówki i jednego pióra w zgięciu skrzydła – okaz szarobrewki bagiennej. Był to dorosły samiec, jak opisał autor: bardzo tłusty[17].
Odmienność morfologiczna M. g. nigrescens
Osobniki opisane jako podgatunek nigrescens, włączany później często do georgiana[13], cechuje znacznie bardziej wyraziste czarne kreskowanie wierzchu ciała, a obrzeżenia ich grzbietowych piór są intensywniej szare. Początkowo na podstawie małej ilości okazów określono, że osobniki te mają nieznacznie większe wymiary[18]. Badania, których wyniki opublikowano w roku 1990, przyniosły dalsze informacje dotyczące różnic między osobnikami podgatunku nominatywnego a opisanego jako nigricens. Dziób tego podgatunku cechuje się większymi wymiarami. Podobne zjawisko zachodzi u innych ptaków. Gdy bagiennik ostrosterny (Ammodramus caudacutus) i płowy (A. nelsoni) uznawane były jeszcze za jeden gatunek (jako A. caudatus), u podgatunku subvirgutus występował większy dziób niż u wewnątrzkontynentalnej populacji. U szarobrewki śpiewnej (M. melodia) podg. maxillaris występuje największy dziób spośród wszystkich podgatunków; forma ta zasiedla okolice Zatoki Suisun, a więc obszar poza interiorem kontynentu. Również u podgatunków rostratus i beldingi bagiennika żółtobrewego (Passerculus sandwichensis) dziób jest duży w porównaniu do innych podgatunków[13]. Wykazano także, że dziób pod względem objętości największy jest u nigrescens – objętości dzioba między 210 a 300 mm³ występują tylko u tego podgatunku; zaobserwowano również zależność, że im większa objętość dzioba, tym mniej rudej barwy w upierzeniu wierzchu głowy – w wymienionych badaniach osobniki z mniej niż 70% barwy rudej z wierzchu głowy należały tylko do podgatunku nigrescens[13].
Barwa rdzawa u nigrescens zastąpiona jest szarawą. Jest to częsta różnica między zasiedlającymi słodkowodne bagna wróblowymi a wróblowymi z bagien słonawych. U bagiennika żółtoczelnego (A. maritimus), występującego u wybrzeży, obecne jest mniej barwy rdzawej niż u innych przedstawicieli Ammodramus. U wspomnianej pasówki obrożnej trzy podgatunki zamieszkujące bagna słonawe cechują się mniejszą ilością barwy rdzawej i szarszym lub czarniejszym upierzeniem. Przykład podobnego zjawiska występuje także poza wróblowymi – wodnik królewski (Rallus elegans) posiada więcej rudej barwy niż osiadły na wybrzeżach wodnik długodzioby (R. longirostris)[13].
Szarobrewka bagienna podgatunku nigriscens obserwowana była na stojących bagnach i połaciach błota – prawdopodobnie mniejsza ilość barwy rdzawej zapewnia lepsze zlanie się ptaka z otoczeniem[13]. Ciemniejsze upierzenie nie może być wyjaśnione regułą Glogera, ponieważ każdy z podgatunków występuje w wilgotnym środowisku. Pojawiło się także inne wyjaśnienie, jakoby ciemniejsza barwa piór miała chronić szarobrewki podgatunku nigrescens przed laseczkami (głównie Bacillus licheniformis), odpornymi na duże zasolenie i wpływającymi niszcząco na upierzenie. Na podstawie badań osobników z zatoki Delaware (zasolenie 10–15 ppt; nigrescens) i Maryland (zasolenie 0 ppt; georgiana) stwierdzono większą obecność Bacillus i w ogóle mikroorganizmów u nigrescens. Dzięki znoszeniu dużego zasolenia Bacillus nie mają wielu konkurentów w słonych środowiskach, przez co mogą efektywniej zwiększać swoją populację. Prawdopodobnie melanizacja zaszła u omawianego podgatunku celem ochrony upierzenia[19].
Zasięg występowania
Szarobrewka bagienna posiada bardzo duży zasięg występowania; same obszary lęgowe lub miejsca, gdzie ptaki są osiadłe pokrywają 4,07 mln km²[20]. Wędrowny. Osobniki podgatunku nominatywnego gnieżdżą się od wschodniej Dakoty Południowej na wschód do południowo-wschodniej Kanady (Wyspa Księcia Edwarda i Nowa Szkocja) oraz na południe do wschodniej Nebraski, północnego Missouri, Illinois, Ohio i Wirginii Zachodniej. Osobniki nielęgowe (zimujące) przebywają na obszarze na południe od wymienionego, do południowego Teksasu oraz stanów skupionych wokół Zatoki Meksykańskiej[9].
Kanadyjska część obszarów lęgowych M. g. ericrypta rozciąga się od południowo-wschodniego systemu rzecznego Mackenzie do centralnego Quebec i Nowej Fundlandii, wraz z południową i południowo-wschodnią Kolumbią Brytyjską, centralną Albertą, południowym Saskatchewan, zachodnim Ontario i południowo-wschodnim Quebec. Dalej na południe w Stanach Zjednoczonych zasiedla obszar do wschodniej Dakoty Północnej i północnej Minnesoty. Zimuje od skrajnie południowo-zachodniej Kanady: od południowej Wyspy Vancouver do centralno-zachodniej Kalifornii i centralnej Nevady, także od wschodniego Teksasu do południowej Georgi i północno-wschodniej Florydy. W Meksyku w stanach Sonora i Chihuahua, Coahuila i Tamaulipas na południe do Durango, Jalisco, San Luis Potosí oraz Veracruz[9].
Podgatunek nigrescens ma swoje obszary lęgowe na wschodnich wybrzeżach USA – od New Jersey na południe do południowo-wschodniego Maryland[9]. Osobniki tego podgatunku początkowo uznano za nieodbywające wędrówek[18]; do roku 1990 zostało ustalone, że migrują, jednak nie jest znane miejsce docelowe wędrówki[13]. Do roku 2011 (roku wydania 16. tomu HBW) obszar zimowania pozostał nadal nieznany[9].
Szarobrewka bagienna opuszcza tereny lęgowe w Ontario w październiku[21], zaś w Maine już pod koniec września; niektóre osobniki pozostają do listopada[22].
Biotop
Obszary lęgowe stanowią słodkowodne (w przypadku georgiana i ericrypta) bagna, trzęsawiska i mokradła, niekiedy podmokłe łąki[18]; spotykany także w innych typach środowisk, np. zaroślach cyprysików (Chamaecyparis)[9]. Podgatunek nigrescens zamieszkuje nadbrzeżne, słonawe mokradła. Podczas gdy bagiennik żółtoczelny – sympatryczny wobec szarobrewki bagiennej – zamieszkuje na wybrzeżach zbiorowiska sitów (Juncus) i traw Spartina, tak szarobrewka preferuje skupienia Iva fructescens i Baccharis hamifolia[13]. W Maryland gatunek został stwierdzony jako gniazdujący także na mokradłach porośniętych przez choiny (Tsuga). W Ohio zasiedla zbiorowiska roślinne Juncus-Scirpus, Decodon-Typha, Ilex mucronata-Alnus, Cephalanthus-Alnus i w skupiskach chamedafne północnej (Chamaedaphne calyculata)[18].
Behawior
Szarobrewka bagienna jest bardziej skrytym gatunkiem niż szarobrewka śpiewna, niechętnie opuszcza ukrycie. Zaniepokojona na gnieździe, raczej nie odfruwa, a wychodzi i po gałęziach oddala się. Czasem w trakcie żerowania brodzi w wodzie, zbierając nasiona i owady z jej powierzchni. Kość udowa i skokowa tego ptaka są proporcjonalnie dłuższe niż u szarobrewki śpiewnej. Doniesiono o osobniku w niewoli, który wolał zbierać nasiona z powierzchni wody w poidełku niż z przeznaczonego nań kubeczka. Poza migracjami rzadko przelatuje więcej niż 10 m. W locie porusza ogonem w górę i w dół. Obciążenie powierzchni skrzydeł wynosi 4,3 cm³/g – u kongenerycznej szarobrewki śpiewnej jest to 3,94 cm³/g[18].
Głos
Zawołanie stanowi metaliczne chink lub chiip[18]. Pieśń przypomina tę wykonywaną przez spizelę białobrewą (Spizella passerina), jednak jest mniej sucha, głośniejsza i bardziej zróżnicowana; brzmi jak łit-łit-łit-łit-łit. Odzywa się także zróżnicowanymi ćwierknięciami. Śpiewający samiec siada na wyeksponowanej gałęzi z rozłożonym ogonem. Niekiedy wykonuje pieśń w locie, lecąc kilka stóp (1 stopa ≈ 30,5 cm) nad ziemią, wydając z siebie krótkie, radosne i dość chaotyczne dźwięki inne od zwykłego, urywanego trylu. Pieśń wykonuje nawet po północy, a w trakcie jasnych nocy śpiewa równie intensywnie, co za dnia[18].
Pożywienie
Szarobrewka bagienna jest prawdopodobnie najbardziej owadożernym gatunkiem w rodzaju. Poskutkowało to zmniejszeniem czaszki jak i dzioba oraz objętościowo mięśni szczęk w stosunku do nasionożernej szarobrewki śpiewnej. Wedle publikacji z 1951 roku 55% diety stanowią owady zimą, zaś na wiosnę 88%. Pożywienie stanowią głównie chrząszcze, mrówkowate i inne błonkoskrzydłe (Hymenoptera), gąsienice i prostoskrzydłe (Orthoptera). Spośród chrząszczy, odnaleziono w żołądkach pancerzyki biegaczowatych (Carabidae) i ryjkowcowatych (Curculionidae). Późnym latem i jesienią ptak przechodzi na zjadanie ziaren, stanowiących wtedy 84–97% pokarmu. Są to nasiona głównie. ciborowatych, rdestów, prosa i werbeny. W żołądkach znajdywano także nasiona ambrozji trójdzielnej (Ambrosia trifida)[18].
Lęgi
W Ontario przybywa na lęgowiska w maju[23]; jaja odnotowywano od środka maja do niemal końca czerwca. W Quebecu natomiast zniesienia stwierdzano od początku maja do początku czerwca. W Nowej Anglii pojawienie się na obszarach gniazdowania zauważano już w marcu – wraz ze śpiewem; najliczniej jednak przybywało w środku maja. W Minnesocie szarobrewki bagienne powracają na lęgowiska od początku kwietnia do końca maja[24]. W Maine przybywa w środku lub pod koniec kwietnia[22]. LeRoy C. Stegman zauważył, że w okresie wiosennym M. georgiana jest lżejsza niż na jesieni[18].
Wielkość terytorium, badana u wybrzeży Maryland, wynosi 0,4–0,5 ha[13]. Gniazduje pojedynczo, niekiedy w sprzyjającym warunkach w pół-koloniach. Wedle Chandlera S. Robbinsa zagęszczenie (badane w Maryland) wynosi średnio 21 gniazd/par na 100 akrów. W Ohio współwystępuje z epoletnikami krasnoskrzydłymi (Agelaius phoeniceus) i wodnikiem błotnym (Rallus limicola) w zbiorowiskach Juncus-Scirpus; z wyżej wymienionymi i lasówką złotawą (Setophaga petechia) w zbiorowiskach Nemopanthus-Alnus; z szarobrewką śpiewną, czyżem złotawym (Carduelis tristis), drozdem wędrownym (Turdus migratorius), przedstawicielami Geothlypis, Tyrannus i empidonką wierzbową (Empidonax traillii) w zbiorowiskach Cephalantus-Alnus oraz z Geothlypis i szarobrewką śpiewną w zaroślach chamedafne północnej[18].
Samica sama buduje gniazdo. Może się ono mieścić się zarówno na ziemi, jak i nad nią. „Naziemne” gniazda zbudowane są w kępie trawy[22] – np. turzyc (Carex) lub pałki[18]. Umieszczone mogą być również na krzewie nad wodą – na wysokości określonej jako osiągalnej przez stanięcie w łódce. Gniazdo nieco mniejsze niż u innych gatunków rodzaju Melaspiza. Zewnętrzna jego średnica wynosi około 10 cm, głębokość 4 cm. Zewnętrzna warstwa spleciona jest z różnych typowo mokradłowych roślin, zaś warstwa wewnętrzna z cieńszych źdźbeł traw – niekiedy jeszcze świeżych[18].
Jaja szarobrewki bagiennej przypominają jaja szarobrewki śpiewnej. Składane są w liczbie 4–6[21][13], niekiedy 3; u podgatunku nigrescens zniesienie jest mniejsze i liczy 2–4 jaja – mało jak na rodzaj Melospiza[13]. Jaja M. georgiana różnią się od należących do M. melodia zagęszczonymi szczególnie w jednym miejscu plamami, nachodzącymi na siebie. Na niebieskawym lub szarobiałym tle znajdują się czerwonobrązowe[21] plamki. Jaja mierzą około 18–20,5 na 14,2–14,7 mm[23], średnio (n=50) 19,4×14,6 mm. Ich masa to 1,85–2,25 grama[18]. Składane są jedno na dzień, aż zniesienie nie jest kompletne. Inkubacja trwa 12–15 dni, wysiaduje jedynie samica[22].
Świeżo wyklute młode (dane ze sztucznie inkubowanych jaj) ważą średnio 1,46 g; nie mają otwartych oczu. Wnętrze ich dzioba ma barwę różową z wyraziście żółtymi obrzeżeniami. Żebrząc o pokarm, nie wydają dźwięków. Cechuje je bardzo cienka skóra – naczynia krwionośne i wnętrzności na brzuchu są widoczne. Występuje ząb jajowy długości 1 mm. Miejsca, gdzie wyrosną lotki, wyraźnie widoczne po obecnym pigmencie. Z czasem krawędzie dzioba stają się jaskrawopomarańczowe z żółtymi obrzeżeniami[18]. Puch na spodzie ciała czarnobrązowy. Spędzają w gnieździe 11[18]-13 dni[25]. Osobniki z wybrzeży, które cechuje mniejsze zniesienie, rzadziej przebywają w pobliżu gniazda (ułatwiają wtedy zlokalizowanie go). Dzieje się tak niezależnie od stadium rozwoju młodych lub jaj. Reagują silniej na drapieżnika niż wewnątrzkontynentalne ptaki[26].
Osobniki w szacie młodocianej z wierzchu cynamonowobrązowe, kasztanowe na wierzchu głowy, czarno paskowane. Brew oliwkowoszara, szaro plamkowana. Skrzydła i sterówki czarne, szeroko kasztanowo obrzeżone. Od spodu płowożółty, wyraźnie płowy po bokach brody, w niższej części gardła, na bokach i w okolicy kloaki. Z wyjątkiem brody i środkowej części brzucha występuje czarne paskowanie. Dziób i nogi różowopłowe, przechodzące potem w szarawe, następnie brązowe[18].
- Przyczyny niepowodzeń w lęgach
Starzyk brunatnogłowy (Molothrus ater) niezbyt często pasożytuje na M. georgiana[18]. Jako że gniazdo często mieści się nad wodą, młode po swoim pierwszym locie wpadając do wody są zjadane przez większe żaby, żółwie lub ryby[25]. W 2006 poddano badaniu populacje z wybrzeży oraz interioru. U populacji gnieżdżącej się na słonawych mokradłach wybrzeży za 79% niepowodzeń w wyprowadzeniu lęgu odpowiadało drapieżnictwo (228 gniazd), za 14% zalanie gniazda (40 gniazd), zaś za pozostałe 7% (20 gniazd) porzucenie lęgu lub nieznane przyczyny. U populacji wewnątrzkontynentalnej 98% niepowodzeń w lęgu spowodowało splądrowanie gniazda przez drapieżnika (62 gniazda). Pozostałe jedno zostało opuszczone, zalania nie stwierdzono[26].
- Długość życia
Najdłużej żyjący zaobrączkowany osobnik przeżył co najmniej 7 lat i 9 miesięcy[27].
Pasożyty
Z szarobrewki bagiennej pozyskano roztocz Ptilonyssus japuibensis[28] i P. morofskyi[29], także larwę pasożytującego na zającach kleszcza Haemaphysalis leporispalustris[30] i przenoszącego boreliozę Ixodes scapularis[31].
Status, zagrożenia
Przez IUCN szarobrewka bagienna została uznana za gatunek najmniejszej troski (LC, Least Concern)[2]. Populacja ma trend wzrostowy. W 2007 roku oszacowano, że przez ostatnie 40 lat populacja tego gatunku wzrosła o 81,4%. M. georgiana nie służy za gatunek mogący częściowo zaważyć na utworzeniu ostoi ptaków IBA[20].
Głównym zagrożeniem środowiska szarobrewki bagiennej są zmiany poziomów wody, zarówno naturalne, jak i spowodowane przez człowieka. Jeśli gniazdo mieści się kilka cali nad wodą, taka zmiana może spowodować zatopienie się gniazda oraz jego ewentualnej zawartości[18]. W latach 90. XIX w. stwierdzono ślady szarobrewki bagiennej w wypluwkach płomykówki (Tyto alba podg. pranticola); spośród 1821 zdobyczy 4 stanowiła M. georgiana[32]. Na podstawie badań ptaków obrączkowanych znalezionych martwych dowiedziono również drapieżnictwa ze strony psów, kotów, dzierzb i gryzoni oraz śmierć w wyniku zderzeń z samochodem lub przez warunki pogodowe[18].
Przypisy
- ↑ a b Melospiza georgiana, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ a b BirdLife International, Melospiza georgiana, [w:] The IUCN Red List of Threatened Species 2015 [online], wersja 2015-4 [dostęp 2015-12-25] (ang.).
- ↑ a b Systematyka i nazwy polskie za: P. Mielczarek & M. Kuziemko: Rodzina: Passerellidae Cabanis & Heine, 1850-51 - pasówki - New world sparrows and allies (wersja: 2021-01-20). [w:] Kompletna lista ptaków świata [on-line]. Instytut Nauk o Środowisku Uniwersytetu Jagiellońskiego. [dostęp 2021-02-10].
- ↑ P. Mielczarek & W. Cichocki. Polskie nazewnictwo ptaków świata. „Notatki Ornitologiczne”. Tom 40. Zeszyt specjalny, s. 368, 1999.
- ↑ John Latham: Index Ornithologicus, Sive Systema Ornithologiae. T. I. Londyn: 1790, s. 460.
- ↑ a b Spencer Fullerton Baird: Reports of explorations and surveys, to ascertain the most practicable and economical route for a railroad from the Mississippi River to the Pacific Ocean. T. 9. 1858, s. 483.
- ↑ a b F. Gill, D. Donsker & P. Rasmussen (red.): New World Sparrows, Bush Tanagers. IOC World Bird List (v11.1). [dostęp 2021-02-10]. (ang.).
- ↑ species: Melospiza georgiana. AOU Checklist of North and Middle American Birds. [dostęp 2014-03-24].
- ↑ a b c d e f g del Hoyo, J.; Elliot, A. & Christie, D.A.: Handbook of the Birds of the World. T. 16. Cardinals to New World Blackbirds. Lynx Edicions, 2011, s. 549. ISBN 978-84-96553-78-1.
- ↑ Gorman N. Bond & Robert E. Stewart. A new Swamp Sparrow from the Maryland Coastal Plain. „The Willson Bulletin”. 63, s. 38–40, 1951.
- ↑ Melospiza georgiana ericrypta Oberholser. Smithsonian Institution, 27 maja 2011.
- ↑ James A. Jobling: Helm Dictionary of Scientific Bird Names. Christopher Helm Publishers Ltd, 2009, s. 250 i 172. ISBN 1-4081-2501-3.
- ↑ a b c d e f g h i j k l m Russell Greenberg & Sam Droege. Adaptations to Tidal Marshes in Breeding Populations of the Swamp Sparrow. „The Condor”. 92 (2), s. 393–404, 1990.
- ↑ a b c d R. Bowdler Sharpe: Catalogue of Bird in the British Museum. T. 12. Fringilliformes. 1888.
- ↑ Maurice Broun. Some Live Weights and Measurements of Small Birds. „Bird-Banding”. 4 (1), 1933.
- ↑ A Note on the Western Swamp Sparrow (Melospiza georgiana eicrypta Oberholser). „The Auk”. 65, 1948.
- ↑ Arthur T. Wayne. An Albino Swamp Sparrow (Melospiza georgiana). „The Auk”. 39 (2), 1922.
- ↑ a b c d e f g h i j k l m n o p q r s Wetherbee, D.. Life Histories of Life Histories of North American Cardinals, Grosbeaks, Bunitngs, Towhees, Finshes, Sparrows, and Allies. „Bulletin - United states National Museum”. 237 (3), s. 1474–1476, 1490, 1968.
- ↑ Ashley M. Peele. Dark Color of the Coastal Plain Swamp Sparrow (Melospiza georgiana nigrescens) may be an Evolutionary Response to Occurrence and Abundance of Salt-Tolerant Feather-Degrading Bacilli in Its Plumage. „The Auk”. 126 (3), s. 531–535, 2009.
- ↑ a b Swamp Sparrow Melospiza georgiana. BirdLife International. [dostęp 2014-03-24]. [zarchiwizowane z tego adresu (26 marca 2014)].
- ↑ a b c McIlwraith, Thomas: The birds of Ontario. 1886, s. 266.
- ↑ a b c d Ralph. S. Palmer. Maine Birds. „Bulletin of the Museum of Comparative Zoology at Harvard College”. 102, s. 573–574, 1949.
- ↑ a b Oliver Davie: Nests and eggs of North American birds. 1889, s. 321–322.
- ↑ Phil L. Hatch: Notes on the Birds of Minnesota. 1892.
- ↑ a b E.H. Forbush: Birds of massachusetts and other New england States. T. 3. 1929.
- ↑ a b Brian J. Olsen, Joshua M. Felch, Russell Greenberg & Jeffrey R. Walters. Causes of reduced clutch size in a tidal marsh endemic. „Oecologia”. 158 (3), 2006.
- ↑ Longevity Records Of North American Birds. USGS, listopad 2013.
- ↑ Danny B. Pence. The Nasal Mites of Birds from Louisiana. IV. The Genus Ptilonyssus (Dermanyssidae: Rhinonyssinae) with a Description of Two New Species. „The Journal of Parasitology”. 58 (6), s. 1162–1169, 1972.
- ↑ Ptilonyssus morofskyi Hyland, 1962. University of Alberta, 22 stycznia 2010.
- ↑ Scott et al.. Birds Disperse Ixodid (Acari: Ixodidae) and Bowelia burgdorferi - Infected Ticks in Canada. „Journal of Medical Entomology”. 38 (4), 2001.
- ↑ A.R. Weisbrod & R.C. Johnson. Lyme disease and migrating birds in the Saint Croix River Valley. „Applied and Environmental Microbiology”. 55 (8), 1989.
- ↑ A. K. Fisher. Food of the Barn Owl (Strix Pratincola). „Science”. 3 (69), s. 623–624, 1896.
Linki zewnętrzne
- Materiały audiowizualne dotyczące gatunku. [w:] eBird [on-line]. Cornell Lab of Ornithology. (ang.).
- Artykuł nt. szarobrewki bagiennej w Animal Diversity Web (ang.)
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor: Cephas, Licencja: CC BY-SA 4.0
Geographical distribution of Swamp sparrow.
Autor: Jonathon Jongsma, Licencja: CC BY-SA 3.0
:Singing from a perch on a stalk in a patch of dead and dried Typha. Starts out singing one song type and then switches to another around 2:02.
- Very cool (~45F) and windy. Very strong gusts sometimes noticeable in the recording. Some noise from rustling of dried Typha stems blowing in the wind.
- Recorded with Olympus LS-10S and homemade parabolic reflector. Filtered below 3kHz for wind and traffic noise.
- bird-seen:yes
- playback-used:no
- Common name: Swamp Sparrow
- Type: song
- Genus: Melospiza
- Species: georgiana
- Location: Minnesota Valley NWR, Old Cedar Ave Bridge, Hennepin, MN
- Elevation: 220 m
Autor: Dick Daniels (http://theworldbirds.org/), Licencja: CC BY-SA 3.0
Coastal Plain Swamp Sparrow, a subspecies of the Swamp Sparrow (Melospiza georgiana). Photographed at the Washington National Zoo.









