Szczękoczułkopodobne
| Chelicerata[1] | |
| Heymons, 1901 | |
| Okres istnienia: kambr środkowy–dziś | |
 Przedstawiciele szczękoczułkopodobnych. Lewy górny róg: kikutnica, prawy górny: wielkorak, lewy dolny: ostrogon, prawy dolny: pajęczak | |
| Systematyka | |
| Domena | eukarionty |
|---|---|
| Królestwo | zwierzęta |
| Typ | stawonogi |
| (bez rangi) | pajęczakokształtne |
| Podtyp | szczękoczułkopodobne |
| Synonimy | |
| |
Szczękoczułkopodobne[2], szczękoczułkokształtne[3], szczękoczułkowce[a] (Chelicerata, syn. Cheliceromorpha) – podtyp stawonogów obejmujący nadgromady szczękoczułkowców i kikutnic. Obejmuje około 112 tysięcy opisanych gatunków współczesnych, ale ich faktyczna liczba przekraczać może milion. Ponadto znanych jest około 2 tysięcy gatunków wymarłych, a w zapisie kopalnym występują od środkowego kambru. Pierwotnie słonowodne, ale większość współczesnych jest lądowa, a niektóre wtórnie słonowodne. Ciało mają podzielone na prosomę i opistosomę (czasem zredukowaną) lub na gnatosomę i idiosomę. Charakterystyczna jest obecność szczękoczułków na pierwszym somicie zaocznym. Rozwój pozazarodkowy może mieć charakter epimorfozy, anamorfozy lub metamorfozy. Zamieszkują rozmaite siedliska i przyjmują różne strategie pokarmowe.
Morfologia
Długość ciała różna: od 0,08 mm u niektórych roztoczy[4] po około 2,5 metra u wymarłego wielkoraka Jaekelopterus rhenaniae, będącego największym znanym stawonogiem[5]. Wśród form współczesnych do około 80 cm u Trachypleus gigas z gromady ostrogonów[2]. Ciało typowo podzielone jest na dwie tagmy: prosomę i opistosomę (zwane też głowotułowiem i odwłokiem[3]), jednak u kikutnic ta druga może być zredukowana do niemal szczątkowej formy[2][6], a u roztoczy podział na pierwotne tagmy często zanika, a zamiast niego pojawiają się różne pseudotagmy, w tym gnatosoma i idiosoma[2].

Prosoma w rozwoju zarodkowym powstaje przez zlanie się somitu ocznego („akronu”)[7], z segmentami pozaocznymi. U szczękoczułkowców segmentów zaocznych budujących prosomę jest 6[2][8], a u kikutnic od 7 do 9[2]. Pierwszy z somitów zaocznych, homologiczny z segmentem czułkowym żuwaczkowców[9], zawiera śródmóżdże i unerwione nim przydatki gębowe w postaci szczękoczułków (chelicer, u kikutnic zwanych też cheliforami[10] i mogących być zredukowanymi[3])[10], zbudowanych z 1–4 członów[2] i zwykle zakończonych szczypcami lub pazurkami[3]. Drugi somit zaoczny zaopatrzony jest w nogogłaszczki[8], które jednak ulegają uwstecznieniu u niektórych kikutnic[3]. Pozostałe somity prosomy mieć mogą parę odnóży krocznych[8], przy czym u roztoczy może ich być łącznie od 2 do 4 par, u innych szczękoczułkowców 4 pary[3], a u kikutnic od 4 do 6 par[11]. Ponadto u kikutnic trzecia para przydatków prosomy może mieć postać owigerów[11][3].
Opistosoma może mieć formę od zredukowanej do w pełni rozwiniętej, od niesegmentowanej po maksymalnie 13-segmentową[3][8]. Może być podzielona na przedodwłok (mezosomę) i zaodwłok (metasomę) oraz być zakończona telsonem[8][12]. Znajdujące się na niej odnóża mogą być jedno- lub dwugałęziste i nie pełnią funkcji krocznych. Mogą być zmodyfikowane w narządy oddechowe (odnóża skrzelowe, płucotchawki, worki płucne), zmysłowe (np. grzebienie[12]) lub przędne (przędne)[2][3].
Biologia i ekologia
Rozród i rozwój
U ostrogonów występuje typowe zapłodnienie zewnętrzne i plemniki dostosowane są do przebywania w wodzie morskiej. U kikutnic zapłodnienie również jest zewnętrzne, ale uwalnianie gamet jest zsynchronizowane na tyle, że ich zetknięcie następuje niemal natychmiast po uwolnieniu i plemniki wykazują cechy podobne jak w przypadku zapłodnienia wewnętrznego. U pajęczaków plemniki przekazywane są w spermatoforach składanych na podłożu lub zaplemnienie następuje przez kopulację[13].
Rozwój pozazarodkowy może mieć charakter epimorfozy, anamorfozy lub metamorfozy ze stadiami larwalnymi i nimfalnymi[2][4]. U pasożytów wielożywicielowych pojawiać się mogą złożone cykle życiowe[14].
Pokarm
Szczękoczułkopodobne przyjmują rozmaite strategie pokarmowe. Można wśród nich znaleźć fitofagi (np. fitofagi ssące i indukujące galasy[15]), mykofagi, drapieżniki, saprofagi, detrytusożerców, ektopasożyty i endopasożyty (w tym hematofagi[14] i dermatofagi[16])[2][4][3]. Często odgrywają kluczowe role w ekosystemach, np. mechowce mogą pożerać około połowy biomasy odkładającej się rocznie na dnie lasów[17].
Występowanie i różnorodność
Do 2011 roku opisano około 112 tysięcy gatunków współczesnych szczękoczułkopodobnych, w tym 1322 kikutnic i ponad 110,6 tysiąca pajęczaków[18]. Ich faktyczna liczba jest jednak znacznie większa – współczesną faunę samych roztoczy szacuje się na około miliona gatunków[4]. Ponadto liczny jest zapis kopalny – do 2008 roku opisano na jego podstawie 1952 gatunki wymarłe[19].
Szczękoczułkopodobne rozprzestrzenione są we wszystkich krainach zoogeograficznych, sięgając również za oba koła podbiegunowe[4]. Pierwotnie były to zwierzęta słonowodne[2], ale 99% gatunków współczesnych jest lądowych[3]. Niektóre gatunki są wtórnie wodne. Zamieszkują rozmaite siedliska, w szczególności roztocze dostosowały się dzięki miniaturyzacji do nisz niedostępnych dla innych stawonogów[4].
Systematyka i filogeneza
Dominujący w 2020 pogląd na relacje współczesnych stawonogów[10][20]
|
Na monofiletyzm szczękoczułkopodobnych wskazują liczne molekularne analizy filogenetyczne przeprowadzone w XXI wieku[10]. Ich morfologiczne apomorfie nie są jednak zbyt liczne[6], a jako główną wymienia się odnóża unerwione przez śródmóżdże wykształcone w formie szczękoczułków[10]. We wcześniejszych pracach szczękoczułkopodobne często uznawane były za parafiletyczne. W pracach z połowy dominował pogląd o braku bliskiego pokrewieństwa kikutnic z którymikolwiek stawonogami i często wywodzone je od pazurnic[6]. Z kolei na przełomie XX i XXI wieku, na podstawie wczesnych analiz molekularno-morfologicznych, pojawiła się hipoteza Cormogonida – kladu obejmującego, z wyjątkiem kikutnic, wszystkie współczesne stawonogi (w tym właściwe szczękoczułkowce)[21][22][23][6].
Jeśli brać pod uwagę tylko taksony współczesne to według większości analiz szczękoczułkopodobne zajmują pozycję siostrzaną do pozostałych podtypów zgrupowanych w klad żuwaczkowców[10]. Z nowszych analiz molekularnych wyniki takie otrzymali m.in. Regier i inni w 2010[24], Oakley i inni w 2013[25], Schwentner i inni w 2017[26] czy Lozano-Fernandez i inni w 2019[20]. Alternatywnie niektóre analizy z pierwszej dekady XXI wieku wskazywały na siostrzaną relację szczękoczułkopodobnych z wijami (hipoteza Myriochelata)[27][28], jednak wyniki takie zinterpretowano później jako skutek saturacji i niewystarczającego przekroju taksonomicznego próbek[29][10]. Sytuacja komplikuje się znacząco jeśli uwzględnić taksony wymarłe. Paleontolodzy często włączają szczękoczułkopodobne w skład dużego kladu pajęczakokształtych (Arachnomorpha), obejmującego liczne taksony wymarłe, w tym cały podtyp trylobitokształtnych[30]. Odkrycie w 2019 roku u trylobitów oczu złożonych o fasetkach zbudowanych z soczewki i stożka krystalicznego może podważać ten pogląd, jako że są to struktury charakterystyczne dla żuwaczkowców, nieznane u szczękoczułkopodobnych[31]. Za bliskich krewniaków szczękoczułkopodobnych uznawane bywają wymarłe Aglaspidida[30], czasem włączane w ich skład[2].
W obrębie szczękoczułkopodobnych wyróżnia się zwykle dwie nadgromady: kikutnic (Pycnogonida) i szczękoczułkowców (Euchelicerata). Ta pierwsza obejmuje gromadę Pantopoda oraz taksony wymarłe niższej rangi[6]. Systematyka drugiej z nich ulegała licznym zmianom. Do szczękoczułkowców należą dwie gromady całkiem wymarłe: wielkoraki i Chasmataspida, przy czym te drugie bywają włączane do tych pierwszych[32][33] oraz dwie gromady współczesne: ostrogony i pajęczaki[2][33]. Dawniej ostrogony łączono z wielkorakami w gromadę staroraków, jednak późniejsze analizy wykazały bliższe pokrewieństwo wielkoraków z pajęczakami niż z ostrogonami[34], np. według wyników analizy Lamsdella z 2013 pajęczaki stanowią grupę siostrzaną dla wielkoraków, tworząc z nimi klad Sclerophorata, który to z Chasmataspida tworzy klad Dekariata[35]. Największe kontrowersje budził monofiletyzm i podział pajęczaków[10], stąd w drugiej połowie XX wieku zamiast lub obok nich w randze gromad pojawiały się takie taksony jak Acaromorpha, Apatellata, Cryptognomae, Dromopoda, Epimera, Opillonidea, Micrura, Scorpionomorpha czy Solifugomorpha[2].
Najstarsze skamieniałości sklasyfikowane bez wątpliwości do szczękoczułpodobnych pochodzą z kambru środkowego i należą do rodzaju Sanctacaris[36].
Kladogram pajęczakokształtnych (Arachnomorpha) wg Lamsdella (2013)
|
Uwagi
- ↑ W lit. polskojęz. nazwa szczękoczułkowce bywa używana zamiennie z poprzednimi[3], jednak wg nowszych pozycji odnosi się ona do taksonu niezawierającego kikutnic, czyli Euchelicerata (Chelicerata s.str.), podczas gdy dwie poprzednie dla szerszego taksonu je obejmującego (Chelicerata s.lato, Cheliceromorpha)[2]
Przypisy
- ↑ Chelicerata, [w:] Integrated Taxonomic Information System [online] (ang.).
- ↑ a b c d e f g h i j k l m n o Czesław Błaszak: Podtyp: szczękoczułkopodobne – Cheliceromorpha; Nadgromada: szczękoczułkowce – Chelicerata. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ a b c d e f g h i j k l Czesław Jura: Bezkręgowce. Podstawy morfologii funkcjonalne, systematyki i filogenezy. Wyd. 3. Warszawa: PWN, 2005, s. 488-531.
- ↑ a b c d e f Czesław Błaszak: Rząd: roztocze – Acari. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ Simon J Braddy, Markus Poschmann, O. Erik Tetlie. Giant claw reveals the largest ever arthropod. „Biology Letters”. 4 (1), s. 106–109, 2008. DOI: 10.1098/rsbl.2007.0491.
- ↑ a b c d e Jason A. Dunlop. Pycnogonid affinities: a review. „Journal of Zoological Systematics and Evolutionary Research”. 43 (1), s. 8-21, 2005. Blackwell Verlag. DOI: 10.1111/j.1439-0469.2004.00284.x.
- ↑ a b Ortega-Hernández, Javier; Janssen, Ralf; Budd, Graham E.. Origin and evolution of the panarthropod head – A palaeobiological and developmental perspective. „Arthropod Structure & Development. Evolution of Segmentation”. 46 (3), s. 354–379, 2017. DOI: 10.1016/j.asd.2016.10.011. ISSN 1467-8039.
- ↑ a b c d e f Jason A. Dunlop, James C. Lamsdell. Segmentation and tagmosis in Chelicerata. „Arthropod Structure & Development.”. 46 (3), s. 395–418, 2017. DOI: 10.1016/j.asd.2016.05.002. ISSN 1467-8039.
- ↑ Maximilian J. Telford, Richard H. Thomas. Expression of homeobox genes shows chelicerate arthropods retain their deutocerebral segment. „Proceedings of the National Academy of Sciences”. 95 (18), s. 10671–10675, 1998. DOI: 10.1073/pnas.95.18.10671.
- ↑ a b c d e f g h Gonzalo Giribet, Gregory Edgecombe: The Invertebrate Tree of Life. Princeton University Press, 2020. ISBN 978-0-691-17025-1.
- ↑ a b Maciej Skoracki, Bożena Sikora: Gromada: kikutnice – Pantopoda. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ a b Marek Żabka: Rząd: skorpiony – Scorpionida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ Wojciech Witalicki: Spermatogeneza, budowa plemników i filogeneza Cheliceromorpha. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ a b Krzysztof Siuda: Kohorta: kleszcze — Ixodida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 153-173. ISBN 978-83-01-16568-0.
- ↑ Andrzej Kaźmierski: Kohorta: Prostigmata. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ Jacek Dabert: Kohorta: Astigmata. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ Ziemowit Olszanowski: Kohorta: mechowce – Oribatida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ Nigel E. Stork. How Many Species of Insects and Other Terrestrial Arthropods Are There on Earth?. „Annual Review of Entomology”. 63 (1), s. 31–45, 2018). DOI: 10.1146/annurev-ento-020117-043348.
- ↑ Jason A. Dunlop, David Penney, O. Erik Tetlie, Lyall I. Anderson. How many species of fossil arachnids are there?. „Journal of Arachnology”. 36 (2), s. 267-272, 2008. DOI: 10.1636/CH07-89.1.
- ↑ a b Jesus Lozano-Fernandez, Mattia Giacomelli, James F. Fleming, Albert Chen, Jakob Vinther, Philip Francis Thomsen, Henrik Glenner, Ferran Palero, David A. Legg, Thomas M. Iliffe, Davide Pisani, Jørgen Olesen. Pancrustacean Evolution Illuminated by Taxon-Rich Genomic-Scale Data Sets with an Expanded Remipede Sampling. „Genome Biol. Evol.”. 1 (8), s. 2055-2070, 2019. DOI: 10.1093/gbe/evz097.
- ↑ J. Zrzavý, V. Hypsa, M. Vlásková: Arthropod phylogeny: taxonomic congruence, total evidence and conditional combination approaches to morphological and molecular data sets. W: Arthropod Relationships. Richard A. Fortey, Richard H. Thomas (red.). London: Chapman & Hall, 1998, s. 97–107.
- ↑ G. Giribet; G. D. Edgecombe, W.C. Wheeler. Arthropod phylogeny based on eight molecular loci and morphology. „Nature”. 413, s. 157-161, 2001.
- ↑ Gonzalo Giribet, Gregory D. Edgecombe: The Arthropoda: a Phylogenetic Framewor. W: Arthropod Biology and Evolution: Molecules, Development, Morphology. Alessandro Minelli, Geoffrey Allan Boxshall, Giuseppe Fusco (red.). Springer, 2013, s. 28.
- ↑ Jerome C. Regier; Jeffrey W. Shultz; Andreas Zwick; April Hussey; Bernard Ball; Regina Wetzer; Joel W. Martin; Clifford W. Cunningham. Arthropod relationships revealed by phylogenomic analysis of nuclear protein-coding sequences. „Nature”. 463 (7284), s. 1079–1083, 2010. DOI: 10.1038/nature08742.
- ↑ Todd H. Oakley; Joanna M. Wolfe; Annie R. Lindgren; Alexander K. Zaharoff. Phylotranscriptomics to bring the understudied into the fold: monophyletic ostracoda, fossil placement, and pancrustacean phylogeny. „Molecular Biology and Evolution”. 30 (1). s. 215–233. DOI: 10.1093/molbev/mss216.
- ↑ Martin Schwentner, David J. Combosch, Joey Pakes Nelson, Gonzalo Giribet. A Phylogenomic Solution to the Origin of Insects by Resolving Crustacean-Hexapod Relationships. „Current Biology”. 27, s. 1–7, 2017. Elsevier. DOI: 10.1016/j.cub.2017.05.040.
- ↑ S. Richter. The Tetraconata concept: hexapod-crustacean relationships and the phylogeny of Crustacea. „Organisms Diversity & Evolution”. 2 (3), s. 217–237, 2002.
- ↑ Casey W. Dunn; Andreas Hejnol; David Q. Matus; Kevin Pang; William E. Browne; Stephen A. Smith; Elaine Seaver; Greg W. Rouse; Matthias Obst; Gregory D. Edgecombe; Martin V. Sørensen; Steven H. D. Haddock; Andreas Schmidt-Rhaesa; Akiko Okusu; Reinhardt Møbjerg Kristensen; Ward C. Wheeler; Mark Q. Martindale; Gonzalo Giribet. Broad phylogenomic sampling improves resolution of the animal tree of life. „Nature”. 452 (7188), s. 745–749, 2008. DOI: 10.1038/nature06614.
- ↑ Omar Rota-Stabelli, Lahcen Campbell, Henner Brinkmann, Gregory D. Edgecombe, Stuart J. Longhorn, Kevin J. Peterson, Davide Pisani, Herve Philippe, Maximilian J. Telford. A congruent solution to arthropod phylogeny: phylogenomics, microRNAs and morphology support monophyletic Mandibulata. „Proceedings of the Royal Society B: Biological Sciences”. 278 (1703), s. 298-306, 2011. DOI: 10.1098/rspb.2010.0590.
- ↑ a b J. Bergström, X.G. Hou. Arthropod origins. „Bulletin of Geosciences”. 78 (4), s. 323–334, 2003.
- ↑ Gerhard Scholtz, Andreas Staude, Jason A. Dunlop. Trilobite compound eyes with crystalline cones and rhabdoms show mandibulate affinities. „Nature Communications”. 10 (2503), 2019.
- ↑ E.O. Tetlie, S.J. Braddy. The first Silurian chasmataspid, Loganamaraspis dunlopi gen. et sp. nov. (Chelicerata: Chasmataspidida) from Lesmahagow, Scotland, and its implications for eurypterid phylogeny. „Transactions of the Royal Society of Edinburgh: Earth Sciences”. 94 (3), s. 227–234, 2003. DOI: 10.1017/S0263593300000638.
- ↑ a b J.W. Schultz. A phylogenetic analysis of the arachnid orders based on morphological characters. „Zoological Journal of the Linnean Society”. 150 (2), s. 221–265, 2007. DOI: 10.1111/j.1096-3642.2007.00284.x.
- ↑ Jacek Dabert: Gromada: ostrogony – Xiphosurida. W: Zoologia: Stawonogi. T. 2, cz. 1. Szczękoczułkopodobne, skorupiaki. Czesław Błaszak (red. nauk.). Warszawa: Wydawnictwo Naukowe PWN, 2011. ISBN 978-83-01-17447-7.
- ↑ James C. Lamsdell. Revised systematics of Palaeozoic 'horseshoe crabs' and the myth of monophyletic Xiphosura. „Zoological Journal of the Linnean Society”. 167 (1), s. 1–27, 2013. DOI: 10.1111/j.1096-3642.2012.00874.x. ISSN 0024-4082.
- ↑ David A. Legg. Sanctacaris uncata: the oldest chelicerate (Arthropoda). „Naturwissenschaften”. 101 (12), s. 1065–1073, 2014. DOI: 10.1007/s00114-014-1245-4.
Media użyte na tej stronie
Autor: (of code) -xfi-, Licencja: CC BY-SA 3.0
The Wikispecies logo created by Zephram Stark based on a concept design by Jeremykemp.
Autor:
- Eurypterids Pentecopterus Vertical.jpg: Patrick Lynch
- Pycnogonid.jpg: Steve Childs
- Limulus polyphemus (aq.).jpg: Hans Hillewaert
- Gasteracantha cancriformis 2.jpg: Mike Kullen
Collage of chelicerates, including a pycnogonid, an eurypterid, a xiphosuran and an arachnid.
Autor: Junnn11, Licencja: CC BY-SA 4.0
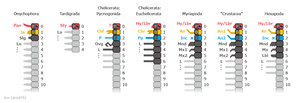
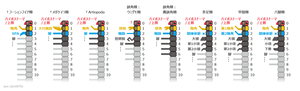
Alignment of anterior segments (somites) and appendages across various euarthropod taxa, based on the most widely accepted current (2017) observations. The eye-bearing anteriormost segment (ocular somite) labeled as '0'. The next ten segments labeled as shown numbers. The remaining segments, if exist, are not figured.
Dark grey: Segments correspond to the anteriormost tagma (prosoma of Euchelicerata and head/cephalon of the remaining taxa)
Red/P: Protocerebral segment/appendage
Yellow/D: Deutocerebral segment/appendage
Green/T: Tritocerebral segment/appendage
Fuxianhuiida (fuxianhuiid):
- Hy: Hypostome
- An: Antenna
- SPA: Specialized post-antennal appendage
- L: (Arthropodized) Leg/walking leg
Megacheira (megacheiran/great appendage arthropod):
- Hy: Hypostome
- SGA: Short-great appendage
- L: (Arthropodized) Leg/walking leg
Artiopoda (Artiopodan/trilobite and related taxa):
- Hy: Hypostome
- An: Antenna
- L: (Arthropodized) Leg/walking leg
Chelicerata: Pycnogonida (pycnogonid/sea spider):
- ?: (Appendage unknown)
- Chf: Chelifore
- P: Palp
- Ovg: Oviger
- L: (Arthropodized) Leg/walking leg
Chelicerata: Euhelicerata (euchelicerate/merostome and arachnid):
Myriapoda (myriapod):
- Lbr: Labrum
- An: Antenna
- Inc: intercalary segment
- Mnd: Mandible
- Mx1: First maxilla
- Mx2: Second maxilla
- L: (Arthropodized) Leg/walking leg
"Crustacea" (crustacean):
- Lbr: Labrum
- An1: First antenna/antennula/antennule
- An2: Second antenna/antenna
- Mnd: Mandible
- Mx1: First maxilla/maxillula
- Mx2: Second maxilla/maxilla
- L: (Arthropodized) Leg/walking leg
Hexapoda (Hexapod/entognathan and insect)
- Lbr: Labrum
- An: Antenna
- Inc: intercalary segment
- Mnd: Mandible
- Mx: Maxilla
- Lab: Labium
- L: (Arthropodized) Leg/walking leg
Panarthropod version:
References:
- Ortega-Hernández, Javier; Janssen, Ralf; Budd, Graham E. (May 2017). Origin and evolution of the panarthropod head – A palaeobiological and developmental perspective. Arthropod Structure & Development 46 (3): 354–379. doi:10.1016/j.asd.2016.10.011
- Dunlop, Jason A.; Lamsdell, James C. (May 2017). Segmentation and tagmosis in Chelicerata. Arthropod Structure & Development 46 (3): 395.
Three kinds of chelicerae
Life stages of Chaetodactylus krombeini (Astigmata); male not shown; individual LT-SEM photos (excluding phoretic deutonymph photo) by Ron Ochoa and Gary Bauchan, USDA-ARS.